超声波及高压均质制备大豆蛋白-磷脂酰胆碱纳米乳液的特性比较
王中江 常宗明 张 翠 尹 花* 寻崇荣
(1 啤酒生物发酵工程国家重点实验室 山东青岛266000 2 东北农业大学食品学院 哈尔滨150030)
β-胡萝卜素是一种天然色素,动、植物和微生物均可自然形成,其有红、橙、黄3 种颜色,广泛用于食品加工中;且β-胡萝卜素具有维生素A 活性,可抑制心血管疾病、眼疾、癌症及其它慢性疾病[1-2],可用作保健品。β-胡萝卜素疏水性强,溶解性低,限制了其生物利用率。此外,β-胡萝卜素是一种多不饱和分子,在食品生产、运输和储存过程中易被化学降解[3-5],需要开发一种有效的β-胡萝卜素传递系统,克服上述技术难题。
纳米乳液是热力学不稳定的胶体分散体,至少两种互不相溶的液体通过分散作用将其中的一种液体分散为小的球形液滴到其它液体中,直径范围在20~500 nm 内[6-8]。油-水(O/W)纳米乳剂的制备通常是将油相分散到含有乳化剂的水相中[6]。O/W 型纳米乳液可将难溶性或脂溶性的食品生物活性物质,如茶多酚和类胡萝卜素等封装起来,确保这些活性化合物能够安全运送到身体所需的部位[9]。由于纳米乳液的粒径小,比表面积大,因此能够减少液滴的重力分离、絮凝和聚结的发生,从而具有较好的动力学稳定性,可以控制功能性成分的释放或吸收,改善产品的光学清晰度[6,10]。
大豆蛋白因特殊的表面性能,使其能够吸附在油水界面上,形成致密的保护层,降低界面张力,故大豆蛋白可作为理想的乳化剂稳定油滴于连续相水溶液中[11]。磷脂酰胆碱是一种两性离子表面活性剂,其作为最有效的天然乳化剂,广泛用来降低乳液的界面张力[12]。文献[13],[14]研究表明,向大豆蛋白添加磷脂酰胆碱可提高复合乳化剂的稳定性。Comas 等[15]研究发现磷脂酰胆碱可提高天然或改性大豆分离蛋白的乳化稳定性。本研究采用大豆蛋白与磷脂酰胆碱作为乳化剂制备纳米乳液[16]。
制备纳米乳剂的方法很多,在食品工业中主要用传统的制备方法——膜均质器来制备纳米乳液[17-18]。目前主要采用高速搅拌、高压均质、自动乳化、超声乳化及高压微射流等方法制备纳米乳液[19-23]。其中,超声和高压均质制备方法工艺简单,表面活性剂的需量小,生产成本低,污染小,制备的乳液粒径小,分布窄,乳液稳定[24-25]。超声波的空化作用和高压均质的剪切作用促使体系内溶剂的扩散,加速功能成分的溶解,使乳液颗粒尺寸变小,表面积增加,这有利于纳米乳液的制备[26]。鉴于此,本研究通过超声及高压均质制备大豆蛋白-磷脂酰胆碱纳米乳液,通过乳液特性、稳定性、界面行为等方面的评价,比较两种纳米乳液制备方式的优势。
1 材料与方法
1.1 材料
大豆蛋白(蛋白含量89.21%),山东省高唐蓝山集团;大豆磷脂酰胆碱、β-胡萝卜素,美国Sigma公司;葵花籽油,中粮集团福临门压榨一级葵花籽油;实验所需基础试剂均为分析纯级,北京化学试剂公司。
1.2 仪器与设备
AL204 型分析天平,梅特勒-托利多仪器(上海)有限公司;Scientz-IID 型超声波细胞破碎仪,宁波新芝生物科技股份有限公司;LW-1600FC 紫外-可见分光光度计,上海菁华科技仪器有限公司;PHS-3C 雷磁pH 计,上海精科;Turbiscan Lab Expert 浓缩体系稳定性分析仪,法国Formulaction 公司;Bohlin Gemini 2 型旋转流变仪,英国Malvern 公司;Dionex Ultimate HPLC 系统,美国Thermo Fisher 公司;Zetasizer Nano-ZS90 光散射粒径分析仪,英国Malvern 公司;S22-2 型恒温磁力搅拌器,上海司乐仪器有限公司;Ultra-Turrax T25 高速分散器,德国IKA 公司;FPG12800E.N00实验型高压均质机,岛津公司;HYP-Ⅱ八孔消化炉,上海纤检仪器有限公司;LNK-871 型凯氏定氮快速自动蒸馏器,江苏省宜兴市科教仪器研究所;XW-80A 旋涡混合器,上海青浦沪西仪器厂。
1.3 复合乳化剂的β-胡萝卜素纳米乳液的构建
1.3.1 超声制备纳米乳液 取1.48 g 大豆蛋白与0.2 g 磷脂酰胆碱混合溶解于98.5 mL pH 7.0 磷酸盐缓冲液中作为水相,另取0.01 g β-胡萝卜素溶于5 g 葵花籽油中作为油相,采用磁力搅拌器充分搅拌,直至β-胡萝卜素完全溶解。将油相与蛋白质水相溶液混合均一,用高速分散器14 000 r/min分散5 min,获得大豆蛋白-磷脂酰胆碱粗乳液。取30 mL 粗乳液于烧杯中,置超声波细胞破碎仪中,液面浸没变幅杆3 cm,在超声功率500 W 条件下超声9 min,工作时间和间歇时间均为5 s,以循环冷热水控制超声温度,得到超声大豆蛋白-磷脂酰胆碱纳米乳液(U-SP-PC)进行后续实验[27]。
1.3.2 高压均质制备纳米乳液 另将1.5 g 大豆蛋白与0.22 g 磷脂酰胆碱溶解于98.5 g pH 7.0 磷酸盐缓冲液中作为水相,取0.01 g β-胡萝卜素溶于5 g 葵花籽油中作为油相,采用磁力搅拌器充分搅拌,直至β-胡萝卜素完全溶解。将油相与水相溶液混合均匀,用高速分散器20 000 r/min 分散5 min,得到高速分散乳液,用高压均质机将高速分散处理的粗乳液在100 MPa 的均质压力下处理4 次,得到高压均质大豆蛋白-磷脂酰胆碱纳米乳液(H-SP-PC)进行后续实验[28]。
1.4 纳米乳液的粒径分布、PDI 及ζ-电位
用Zetasizer Nano-ZS 90 光散射粒度分析仪分别测定上述大豆蛋白-磷脂酰胆碱乳液的粒径分布规律及ζ-电位变化,β-胡萝卜素油滴的折射率设置为1.45,水相溶液折射率设为1.33。为了降低多重光散射效应,分析前用pH 7.5 的磷酸盐缓冲液稀释大豆蛋白-磷脂酰胆碱乳液1 000 倍,测粒径及PDI,稀释50 倍测ζ-电位。
1.5 纳米乳液浊度测定
将大豆蛋白-磷脂酰胆碱纳米乳液用磷酸盐缓冲液溶液稀释40 倍,以磷酸盐缓冲液为空白对照,用紫外分光光度计测定600 nm 处的吸光度,浊度计算公式:
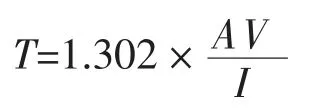
式中:A——稀释乳液在600 nm 处的吸光度;V——稀释倍数;I——光程差0.01 m。
1.6 纳米乳液界面蛋白吸附量测定
界面蛋白含量测定参照刘丽娅[29]的方法。将新制备的纳米乳液经12 000 r/min 离心60 min,离心温度为20 ℃。离心结束后,将离心管顶部的乳析层小心地转移到滤纸上,滤去多余水分,然后用水复溶到初始体积。用注射器转移离心管下层的清液,0.22 μm 的滤膜过滤。采用凯氏定氮法测定下清液中的蛋白含量(N×6.25)。通过下式计算界面蛋白含量。

式中:Γ——界面蛋自吸附量 (mg/m2);Ctotal——最初乳状液中总的蛋白含量(g/g);Cserum——乳清层中的蛋白含量 (g/g);A——液滴的比表面积(m2/g)。
1.7 纳米乳液界面吸附蛋白亚基组成
采用SDS-聚丙烯酞胺凝胶电泳(SDS-PAGE)分析纳米乳液界面处大豆蛋白的亚基组成。参照Laemmili[30]的方法,在BIORAD 垂直电泳附件模具中制胶。将300 μL 复溶的乳析层与630 μL SDS样品缓冲液(150 mmol/L Tris-HCl,20%甘油,1%SDS,4% 2-琉基乙醇,pH 6.8)混合均匀,于95 ℃下加热5 min,高速离心分离 (10 000 r/min,10 min)。电泳上样量10 μL,浓缩胶和分离胶的质量分数分别为5%和13%。初始电泳电流控制于10 mA,待样品进入分离胶后电流调整为25 mA,结束后取下胶块,用0.25%考马斯亮蓝R-250 染色,乙酸脱色。
1.8 大豆蛋白-磷脂酰胆碱纳米乳液的乳化产率
以乙醇/正己烷(体积比1∶1)混合有机相萃取纳米乳液中的β-胡萝卜素,用HPLC 分析β-胡萝卜素的含量。选用C30 色谱柱,流动相为甲醇和甲基叔丁基醚,流速为1.0 mL/min,等梯度洗脱,样品进样量20 μL,用DAD 检测器在450 nm 处检测。实验数据采用Dionex Chromeleon 色谱管理与量化系统软件进行分析,确定纳米乳液中β-胡萝卜素的浓度[31]。通过上述方法确定纳米乳液中β-胡萝卜素的浓度,并按照下式计算乳化产率。

1.9 纳米乳液稳定性的测定
利用Turbiscan Lab Expert 浓缩体系稳定性分析仪分析纳米乳液的稳定性。取18 mL 大豆蛋白-磷脂酰胆碱纳米乳液于Turbiscan 专用圆柱形的玻璃杯中,在55 ℃条件下每30 min 扫描1 次,扫描6 h。由此可获得反映大豆蛋白-磷脂酰胆碱纳米乳液稳定性的差值反射光量(ΔBS)随时间的动态变化,即作为衡量大豆蛋白-磷脂酰胆碱纳米乳液稳定性的图谱,记录TSI。Turbiscan Stability Index(TSI)是纳米乳液用Turbiscan lab expert 仪器进行乳液快速稳定性扫描时计算出的纳米乳液稳定性指数[32]。
1.10 β-胡萝卜素纳米乳液的贮藏稳定性研究
将大豆蛋白-磷脂酰胆碱纳米乳液置于37 ℃条件下密封避光保存30 d。按照1.8 节计算纳米乳液中β-胡萝卜素残留量。
1.11 纳米乳液β-胡萝卜素保留率的测试
在1.0 mL 纳米乳液中,加入3.0 mL 正己烷,振荡混合均匀后离心(10 000 g,5 min),取上清液,按照1.8 节计算未包埋的β-胡萝卜素含量。β-胡萝卜素保留率计算公式:

1.12 乳液静态流变学特性的测定
流变学性质测定采用剪切速率扫描模式。将经不同方式制备的大豆蛋白-磷脂酰胆碱纳米乳液加到流变仪平板上,流变仪平板直径为40 mm,探头尺寸为20 mm,板间距0.5 mm。采用石蜡油对两平行板间的缝隙封口,防止水分蒸发。测定参数:初始温度25 ℃,以5 ℃/min 升温速率升温至90 ℃后保温20 min,之后以5 ℃/min 速率降温至25 ℃。角频率为0.63 r/s,固定形变0.01。记录下弹性模量G’数值的变化[33]。
1.13 数据处理
每组试验做3 次平行试验,对试验数据进行误差分析。采用统计学软件Spass 18 对试验数据进行方差分析、相关性和差异显著性分析。采用Origin 8.5 软件作图。采用Design-Expert 软件进行响应面数据及方差分析。
2 结果与分析
2.1 超声波及高压均质处理对大豆蛋白-磷脂酰胆碱纳米乳液平均粒径、粒径分布和乳化产率的影响
纳米乳液液滴粒径对纳米乳液的稳定性、颜色、外观、结构和流变性能有重要影响。由斯托克斯定律知,液滴移动速度与其半径平方成正比,因此乳液的稳定性可能与液滴粒径有关,粒径越小,乳液的稳定性越强[34]。超声及高压均质制备的大豆蛋白-磷脂酰胆碱纳米乳液平均粒径及PDI 值如图1、表1所示。两种方式制备的纳米乳液粒径均呈单峰分布,比较可知,超声制备的大豆蛋白-磷脂酰胆碱纳米乳液平均粒径为282.4 nm,明显大于高压均质制备。Jafari 等[35]对高压均质和超声制备乳液的最小粒径进行比较,发现高压均质制备的乳液最小粒径为0.1 μm,而超声波处理的最小粒径范围为0.1~0.2 μm,说明高压均质制备大豆蛋白-磷脂酰胆碱纳米乳液稳定性更强。

表1 超声和高压均质制备的纳米乳液特性对比Table 1 Characteristic comparison of nano emulsions prepared by ultrasound and high pressure homogenization

图1 超声和高压均质制备纳米乳液的粒径分布Fig.1 Particle size distribution of nanoemulsion prepared by ultrasound and high pressure homogenization
PDI 值表示液滴尺寸分布的均匀程度,该值越低纳米乳液的粒径分布越均一,表明粒径分布越一致[36]。由表1可知超声及高压均质制备的纳米乳液稳定性较接近,且经高压均质制备纳米乳液的PDI 比超声制备略小。Jafari[37]和Silva[38]发现高压均质处理和超声处理可促进纳米乳液分散,防止纳米乳液液滴的重聚集,进一步证明高压均质和超声处理可减小纳米乳液的PDI 值。
超声和高压均质制备的纳米乳液乳化产率均高于90%,表明这两种工艺制备的乳液对营养素具有良好的包封效果,而高压均质制备的纳米乳液乳化产率更高。梁荣[39]用高压均质制备的β-胡萝卜素纳米乳液乳化产率高达97.71%,高于本研究的乳化产率,原因可能是薄荷油及中链甘油三酸酯较葵花籽油更易包埋。
2.2 超声波及高压均质制备大豆蛋白-磷脂酰胆碱纳米乳液ζ-电位及浊度的影响
研究指出,当ζ 电位绝对值大于30 mV 时,乳化剂间仅依靠强烈的静电斥力即可稳定乳滴。由表1数据可知,超声及高压均质均可用于制备稳定的大豆蛋白-磷脂酰胆碱纳米乳液,比较可知高压均质制备纳米乳液的ζ-电位绝对值更大,表明其稳定性相对强于超声处理。高压均质制备的大豆蛋白-磷脂酰胆碱纳米乳液浊度低于超声处理,这可能是由于乳液浊度与乳液微粒界面静电相互作用及水动力作用有关,而ζ-电位绝对值越大纳米乳液微粒之间的静电斥力越强烈,乳滴间不易形成聚结及絮凝,乳液的浊度小,纳米乳液的稳定性能较强[38]。结合平均粒径和PDI 可知高压均质对纳米乳液有较佳的稳定效果。
2.3 大豆蛋白-磷脂酰胆碱纳米乳液界面蛋白吸附量及界面蛋白亚基组成
由表1可知,超声及高压均质制备的纳米乳液界面蛋白含量分别为25.1 mg/m2和20.6 mg/m2。大豆蛋白-磷脂酰胆碱复合乳化体系的疏水基团可通过疏水作用自发地吸附于油-水界面上,形成蛋白-磷脂酰胆碱乳化界面吸附层,降低界面张力[40-41]。高志明[42]研究发现添加磷脂酰胆碱可增加超声处理制备的油体蛋白在油水界面的吸附量。刘丽娅[15]研究发现乳液体系中存在较大的蛋白聚集体颗粒或不可溶性蛋白-多糖复合物时,这类物质吸附于乳液液滴表面,引起界面蛋白吸附量显著增加。罗昭锋等[43]研究发现超声处理可诱导蛋白聚集,而高压处理不会引起聚集。结合浊度分析可知,超声处理可部分诱导纳米乳液液滴表面蛋白聚集,增加了界面蛋白含量。
通过SDS-PAGE 凝胶电泳分析界面蛋白的亚基组成,由图2可知界面吸附的大豆蛋白亚基主要由分子质量为20 ku 的11 S 球蛋白碱性亚基及分子质量为35 ku 的11 S 球蛋白酸性亚基构成。由此可知,11 S 球蛋白是纳米乳液界面吸附的主要蛋白组分。比较可知,在两种纳米乳液的电泳图谱中均存在分子质量10 ku 左右的多肽组分,这可能是超声处理及高压均质作用下大豆蛋白降解形成的[44]。超声及高压均质制备纳米乳液的界面吸附蛋白亚基组成较为接近,表明纳米乳液形成过程中蛋白亚基可能发生相似的选择性吸附。
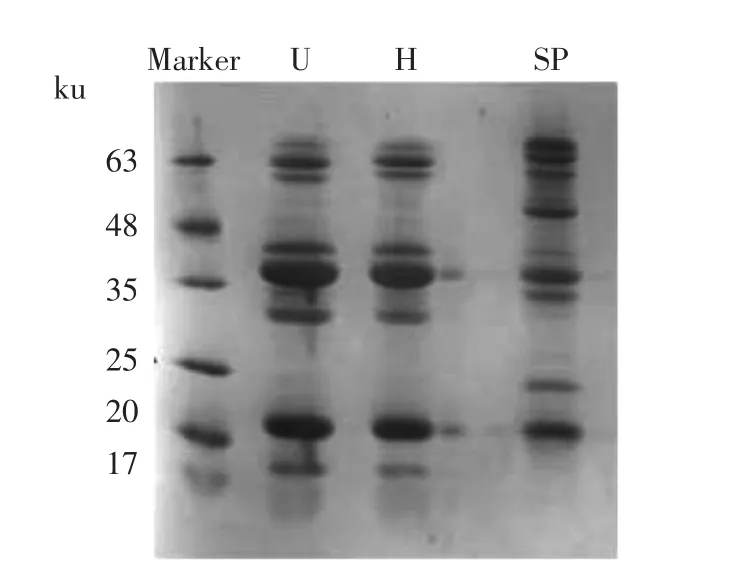
图2 超声及高压均质制备纳米乳液的界面蛋白电泳图Fig.2 The interface protein electrophoresis of nanoemulsions prepared by ultrasound and high pressure homogenization
2.4 大豆蛋白-磷脂酰胆碱纳米乳液稳定性分析
Turbiscan Lab 分散稳定性分析仪能够定性、定量分析体系稳定性的变化情况。图3和图4是不同制备方法获得的纳米乳液的稳定性分析仪扫描图谱。由图3可知,超声制备的大豆蛋白-磷脂酰胆碱纳米乳液中部背散射光在31.24%~30.83%范围轻微波动,纳米乳液体系很少有聚团现象,顶部背散射光自24.29%显著增至46.61%,纳米乳液出现脂肪上浮,而底部背散射光自21.44%降至14.83%,纳米乳液出现水析现象。图4显示高压均质制备的大豆蛋白-磷脂酰胆碱纳米乳液中部背散射光在26.90%~27.08%范围内轻微波动,表明纳米乳液体系很少有聚团现象,顶部背散射光自24.77%增至25.92%,纳米乳液有轻微的脂肪上浮现象,而底部背散射光自18.83%降至13.34%,纳米乳液出现轻微水析现象[45]。上述结果表明,超声及高压均质制备的纳米乳液稳定性强,相对于超声制备,高压均质制备的纳米乳液稳定性较强。本研究中纳米乳液稳定性与刘蕾等[46]利用高压微射流制备的纳米乳液稳定性接近,表现出较强的稳定性。TSI 值越小表明乳液的稳定性越好[32]。综合表1中TSI 值及两种纳米乳液的平均粒径、粒径分布、浊度和ζ-电位,进一步验证了上述分析结果。

图3 超声纳米乳液的稳定性分析仪扫描图谱Fig.3 Scanning atlas of stability analysis of ultrasonic nanoemulsion

图4 高压均质纳米乳液的稳定性分析仪扫描图谱Fig.4 Scanning atlas of stability analysis of high pressure homogeneous nanoemulsion
2.5 大豆蛋白-磷脂酰胆碱纳米乳液β-胡萝卜素包埋率及贮藏稳定性
对于水包油的纳米乳液,营养素的包埋率决定了其生物利用率及贮藏稳定性[47]。在包埋率较高的乳液中,β-胡萝卜素充分溶解于油脂中,生物可利用率较高;游离β-胡萝卜素易与水相中自由基和金属离子相互作用而发生氧化反应,因此β-胡萝卜素的包埋率越高,其纳米乳液的贮藏稳定性越好[48]。由图5可知,超声和高压均质制备纳米乳液β-胡萝卜素包埋率接近100%,且贮藏30 d后,两种方式制备的纳米乳液β-胡萝卜素包埋率均在85%以上,证实了两种工艺制备纳米乳液的高效性。高压均质制备的纳米乳液β-胡萝卜素包埋率略高。
由图5可知超声和高压均质制备的纳米乳液β-胡萝卜素包埋率随贮藏时间的延长呈现降低的变化趋势。刘蕾[46]研究发现β-胡萝卜素乳液的粒径在贮藏过程中有增大的趋势,并伴随着ζ-电位的降低。研究指出β-胡萝卜素乳液在贮藏期内ζ-电位减小,导致油滴间斥力减小,发生油滴聚集,乳液粒径增大,乳液在贮藏过程中物理稳定性降低。本研究中β-胡萝卜素在储存过程中包埋率的降低可能是纳米乳液液滴聚集,粒径变大的原因。
另外,Adachi[49]研究指出氧通过纳米乳液油-水界面引起油相氧化,尽管纳米乳液粒径较小,界面乳化剂疏水基团的稀释作用对油氧化具有阻隔作用,进而提高油脂氧化稳定性。不排除β-胡萝卜素受油脂氧化诱导而降解,引起包埋率降低的可能性。
2.6 大豆蛋白-磷脂酰胆碱纳米乳液静态流变学特性
流变学特性直接影响纳米乳液在食品加工及饮料行业中的应用,研究乳液的流变行为,有利于表征乳液的特性,包括乳液的稳定性和破乳机制等[50]。鉴于此,本研究考察了超声及高压均质制备大豆蛋白-磷脂酰胆碱纳米乳液的流变学特性。
超声及高压均质制备的纳米乳液表观黏度随剪切速率的变化曲线如图6所示。两种纳米乳液的表观黏度均随剪切速率的增大而减小。在小于1s-1的低剪切速率时,表观黏度随剪切速率的增大而急剧下降,表现出剪切变稀的流体特征,这是因为在流速场中,纳米乳液液滴形成的絮体变形并瓦解。在剪切速率大于1s-1时,表观黏度基本保持稳定,表现为牛顿流体特征,这可能是因为絮体被瓦解成单个液滴,或絮体形成与瓦解速率相等,絮体保持相对的稳定状态[51-52]。对比可知,高压均质制备的纳米乳液具有更大的黏度,表明乳液黏度会随着粒径的减小而增大,这是由于液滴粒径的减小使体系的界面面积增大,液滴间的相互作用增强,分散相的相对体积分数增大,导致乳液黏度增大[17]。由此推断,高压均质制备的纳米乳液具有较大黏度与较低的平均粒径有关。

图5 超声和高压均质纳米乳液的β-胡萝卜素包埋率随贮藏时间的变化Fig.5 The change of the β-carotene entrapment efficiency with storage time in ultrasonic and high pressure homogeneous nanoemulsion

图6 超声及高压均质制备的纳米乳液表观黏度随剪切速率的变化曲线Fig.6 The apparent viscosity curves with the change of shear rate of nanoemulsions prepared by ultrasonic and high pressure homogenization
3 结论
纳米乳液可实现生物活性分子的运输、传递,解决其不稳定、易氧化、生物利用率低等问题。本研究以大豆蛋白-磷脂酰胆碱复合物为乳化相,葵花籽油为油相,利用超声和高压均质技术制备β-胡萝卜素纳米乳液。采用动态光散射技术测定β-胡萝卜素纳米乳液的粒径、PDI 及ζ-电位,结果表明高压均质制备的纳米乳液平均粒径和PDI 值较小,且两种制备方式的纳米乳液ζ-电位绝对值均大于30 mV,其中高压均质制备的纳米乳液ζ-电位绝对值较大。用紫外分光光度计测定纳米乳液的浊度,结果超声制备的纳米乳液浊度较大。使用Turbiscan Lab 分散稳定性分析仪分析纳米乳液的稳定性,发现超声和高压均质制备的纳米乳液稳定性指数TSI 分别为3.10 和3.02,结合稳定性分析仪扫描图谱可知两种处理工艺得到的纳米乳液稳定性能较强,且高压均质制备的纳米乳液稳定性较好。由HPLC 分析得到超声和高压均质制备的纳米乳液乳化产率和β-胡萝卜素保留率分别为91.83%,93.35%和98.30%,99.91%,说明这两种工艺制备的纳米乳液对营养素具有良好的包封效果和稳定性。测定纳米乳液的贮藏稳定性,发现这两种制备工艺得到的纳米乳液在37 ℃贮藏30 d 后β-胡萝卜素保留率仍在85%以上,说明纳米乳液贮藏稳定性很好。
通过SDS-PAGE 凝胶电泳可知超声及高压均质制备纳米乳液的界面吸附蛋白亚基组成较为接近,主要是分子质量为20 ku 的11 S 球蛋白碱性亚基及分子质量为35 ku 的11 S 球蛋白酸性亚基,且超声制备的纳米乳液界面蛋白含量较高为25.1 mg/m2,而高压均质制备得纳米乳液界面蛋白含量为20.6 mg/m2。用旋转流变仪分析纳米乳液的表观黏度特性,高压均质制备的纳米乳液具有较大的黏度。

