酒曲果胶酯酶产生菌降低白酒中甲醇含量的研究
周姝颖 杨青杨 赵 辉*
(1 黑龙江大学 农业微生物技术教育部工程研究中心 哈尔滨150500 2 黑龙江大学生命科学学院 黑龙江省普通高校微生物重点实验室 哈尔滨150080)
中国白酒历史悠久,因具有独特的发酵工艺、蒸馏技术、储存方法,在世界酒类行业中占有重要地位[1-3]。在白酒生产时会产生甲醇等有害物质[4-5],国标蒸馏酒甲醇含量小于0.036 g/100 mL[6],应尽量去除或控制其含量。酒曲中微生物将原料发酵生成乙醇的同时,微生物分泌的果胶酯酶也将果胶质分解生成甲醇。果胶质主要结构是由α-1,4糖苷键链接D-半乳糖醛酸及其甲酯的聚合物[7],其存在于水果、蔬菜和谷类的细胞壁中[8]。我国每年用于白酒生产的玉米、高粱、大麦、小麦、豆类等谷物中都含有果胶物质[9]。果胶酶(pectinases)是由聚半乳糖醛酸酶(polygalacturonase,简称PG)、果胶裂解酶 (pectin lyase,简称PL) 和果胶酯酶(pectin methyl esterase,简称PE)等酶协同作用将果胶物质分解的酶类总称[10-13]。果胶酯酶水解果胶质中半乳糖醛酸与甲氧基(-OCH3)相连的酯建,使甲氧基从半乳糖醛酸链上游离出来,形成果胶酸和甲醇;果胶酸进一步被PG,PL 分解生成半乳糖醛酸和不饱和产物,被酿酒酵母等微生物利用[14]。
白酒生产中甲醇的来源大体分为两个方面:一是原料中果胶质受热分解产生,二是微生物分泌果胶酯酶将原料中果胶质分解生成甲醇[15]。张文叶[16]、Nicolini 等[17]对山楂果酒和葡萄酒的研究发现,许多因素影响甲醇的生成,如原料品种,原料中果胶质类型与含量,酿酒工艺,使用不同酿酒微生物、发酵条件和蒸馏方法等[18-19]。Glatthar 等[20]通过降低梨汁的pH 值和缩短发酵时间控制果酒中甲醇的含量。Hang 等[21]在苹果酒发酵时,不同品种的苹果和果汁发酵前经高温处理,都可降低甲醇的生成。Roberto 等[22]研究发现,用果胶甲酯酶处理原料无法降低甲醇含量,而采用分离的酵母发酵可使甲醇浓度降低。细菌、丝状真菌和酵母等都可产生果胶酶,可以通过选择优良的功能微生物控制发酵酒中甲醇的含量[23-26]。
本文以黑龙江省某酒业有限公司的优质酒曲为样品,从酒曲中分离、筛选PE 酶活较低的菌株。将优选菌株做白酒发酵试验,通过气相色谱测定发酵液中产甲醇最低的1 株细菌,对其进行形态学观察,生理生化指标和16S rDNA 鉴定。筛选菌株以不同接种量接种于添加曲粉和酿酒酵母的玉米水解液发酵培养基中,通过菌株菌群优势抑制酒曲中其它果胶降解菌的生长[27-28],以期降低白酒中甲醇的含量,确定最佳接种量。
1 材料与方法
1.1 材料、试剂与培养基
优质酒曲,由黑龙江省富裕老窖酒业有限公司提供。
89 株果胶酶产生菌,分离自优质酒曲。
酿酒酵母(S.cerevisiae),本实验室保藏菌株。
果胶(HM),安徽宇宁生物科技有限公司;甲醇、正丁醇(色谱纯),天津市精细化工研究所;耐高温α-淀粉酶;基因组DNA 提取试剂盒(细菌)、dNTP 混合液、耐热DNA 聚合酶,生工生物工程(上海)股份有限公司等。
富集培养基:牛肉膏3 g、氯化钠5 g、蛋白胨10 g、蒸馏水1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。
分离培养基:果胶4 g、氯化钠5 g、牛肉膏3 g、琼脂18~20 g,蒸馏水1 000 mL,pH 7.0~7.2,121℃灭菌20 min。
种子培养基:牛肉膏3 g、蛋白胨10 g、果胶5 g、磷酸氢二钠0.3 g、氯化钠5 g、硫酸镁0.5 g、氯化钙0.2 g、蒸馏水1 000 mL,pH 7.0,121 ℃灭菌20 min。
玉米水解液的制备:取100 g 玉米粉,加入250~300 mL 蒸馏水,搅拌升温至70 ℃,加入2.0 g耐高温α-淀粉酶,升温至90~95 ℃后,保温20~40 min,测定玉米水解液糖含量为15%~20%时停止水解。
玉米水解发酵培养基:糖含量为15%玉米水解液,硫酸铵2%,pH 自然。
1.2 仪器与设备
PCR 扩增仪,德国BIOMETRA;岛津气相色谱仪(GC-2010),武汉顿杰测量仪器有限公司;高速冷冻离心机(GS-15R),上海兆茗电子科技有限公司等。
1.3 方法
1.3.1 酒曲中产果胶酶菌株的初筛 在超净工作台中取曲块表面和内部的酒曲混匀作为样品,于4 ℃保存。
在灭菌后的99 mL 富集培养基中加入1 g 酒曲,37 ℃、120 r/min 摇床培养12 h。取菌液0.5 mL,加入盛有4.5 mL 的无菌水试管中,梯度稀释。每个梯度取0.1 mL 菌液,涂布于以果胶为唯一碳源的分离培养上,37 ℃恒温培养12~24 h。待长出单菌落后,将菌株分别影印接于2 个新的分离培养基上,将刚果红染色呈现透明圈的菌株,根据菌落形态、颜色等初步归类,纯化后4 ℃保藏于冰箱中。
1.3.2 产果胶酶菌株的复筛
1.3.2.1 酶活测定 在白酒发酵过程中PE 酶活越高,产甲醇量越高。PG 与PL 酶活越高有利于原料利用,增加乙醇的含量。对初筛菌株进行酶活测定,以筛选PE 酶活低,PG 和PL 酶活相对较高的菌株作为复筛标准。
PE 的测定为滴定法[29]:粗酶液与果胶溶液底物在35 ℃下反应,用NaOH 溶液滴定产生羧基。酶活单位定义为:每毫升酶液每分钟释放出1 μmol 羧基为一个PE 酶活力单位。PG 和PL 酶活通过比色法进行的测定。PG 酶活力单位定义[30]:在50 ℃,每毫升PG 单位时间内分解果胶生成1 μg 还原糖量。PL 酶活力单位定义[31]:50 ℃下,每毫升PL 在单位时间内水解聚半乳糖醛酸释放1 μg 不饱和多聚半乳糖酸量。
1.3.2.2 白酒发酵条件 筛选的菌株均具有3 种酶活力,且酶活力不同。以5%的接种量将筛选菌株的种子液分别接种于玉米水解液培养基中,在37 ℃下静止发酵,当残糖降至1%以下且趋于不变,停止发酵后蒸馏,采用气相色谱测定发酵液中甲醇的含量和乙醇的含量,选取产甲醇量低的菌株作为初发菌株。
1.3.2.3 气相色谱条件 进样温度200 ℃,检测器温度200 ℃;程序升温:50 ℃保温3 min,以5 ℃/min 升温至150 ℃,保温10 min,高纯氮载气流速为0.5~1.0 mL/min,进样量0.2 μL。
1.3.3 菌株形态学及生理生化 依照《伯杰细菌鉴定手册》[32]对低活性PE 菌株进行形态特征描述和生理生化鉴定,每个试验重复3 次[33-35]。
1.3.4 酒曲中筛选菌株的16SrDNA 鉴定
1.3.4.1 细菌基因组DNA 的提取 按菌株基因组DNA 提取按试剂盒说明书的步骤进行,通用引物设计如下:
正向引物fz1:8F 5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物Rz2:1512R 5′-ACGGCTACCTTGTTACGACTT-3′。
1.3.4.2 PCR 反应体系和程序 PCR 反应体系如表1所示。
取5 μL 扩增样品,在1%的琼脂糖凝胶、电压108 V 下进行电泳检测,将条带清晰、亮度高的PCR 产物置于-20 ℃下保存,待测序。
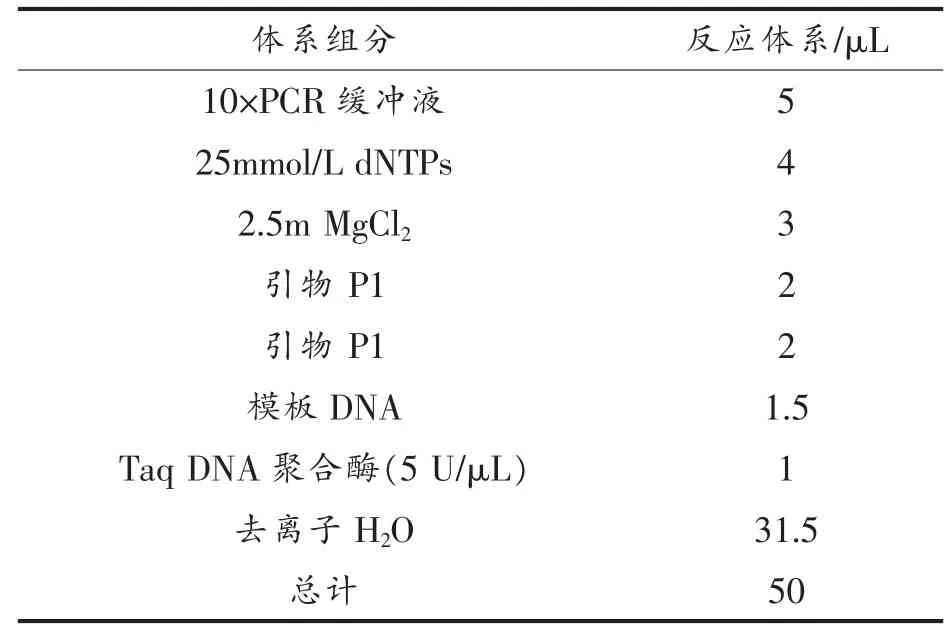
表1 PCR 扩增反应体系Table 1 System of PCR
PCR 扩增反应程序:

1.3.4.3 16Sr DNA 片段的测序与系统发育分析将PCR 产物进行测序(生工生物工程股份有限公司),测序结果与Gen Bank 数据库中已报道的序列进行BLAST 比对分析,经MEGA 软件构建系统发育树,确定该菌株在微生物系统发育学地位。
1.3.5 ZS04 生长曲线的绘制及培养条件的研究
1.3.5.1 ZS04 生长曲线的绘制 以菌体浓度为考察依据,37 ℃培养,以菌液的OD 值为指标,绘制菌株ZS04 生长曲线,确定最佳培养时间。
1.3.5.2 ZS04 培养条件研究 采用稀释涂布法,考察接种量、温度、初始pH 对ZS04 菌株浓度的影响。
1) 最佳接种量确定 温度37 ℃、初始pH 7.0,将种子液分别以1%,2%,3%,4%和5%的接种量接入发酵培养基中,培养36 h,测定菌体浓度。
2) 最佳培养温度确定 接种量为4%,初始pH 7.0,培养36 h,测定31,34,37,40,43 ℃,测定菌体浓度。
3) 最佳pH 确定 培养基初始为pH 5.5,6.0,6.5,7.0,7.5,接种量为4%,37 ℃培养36 h,测定菌体浓度。
4) 以优化后培养条件培养菌株ZS04,通过涂板计数,确定最大菌体浓度,以备下一步试验。
1.3.6 菌株ZS04 降低白酒发酵中甲醇含量的研究 将优化后含量为7.9×107CFU/mL 的种子液(表2),按0.5%,1%,2%,3%,4%的接种量接种于玉米水解液发酵培养基中,并分别添加酒曲和接种酿酒酵母,做白酒发酵试验。空白实验不添加菌株ZS04,其它成分添加量与试验组相同。37 ℃静止发酵,残糖降至1%以下且趋于不变,停止发酵,蒸馏得到蒸馏酒。通过气相色谱测定甲醇含量,确定甲醇含量与菌株ZS04 接种量的关系。

表2 发酵对比试验Table 2 Fermentation comparison test
2 结果与分析
2.1 低果胶酯酶活性菌株的分离筛选结果
测定89 株菌株的酶活并进行比较,对株菌ZS04、ZY23 所产3 种酶的酶活力进行分析,结果见表3。细菌ZS04 所产PE 酶活力在分选菌株中最低,为0.093 U/mL,真菌的PE 酶活最高为0.189 U/mL。细菌ZS04 的PG、PL 酶活比真菌ZY23 的PG、PL 酶活低。为比较3 种酶活力高、低与白酒中甲醇含量的关系,对细菌ZS04 和真菌ZY23 进行液体白酒发酵试验。

表3 株菌ZS04、ZY23 所产3 种酶的酶活力比较Table 3 Comparison of three enzyme activities from ZS04 and ZY23 strains
发酵72 h 后,终止发酵,蒸馏并测定甲醇含量。对照组与两株优选菌株在白酒发酵中产甲醇量见表4。接菌株ZS04 组的甲醇含量比接真菌组低45.3%,比对照组低39.01%,说明白酒发酵中甲醇含量增加仅与PE 酶活有关,与PG 和PL 活力无关。
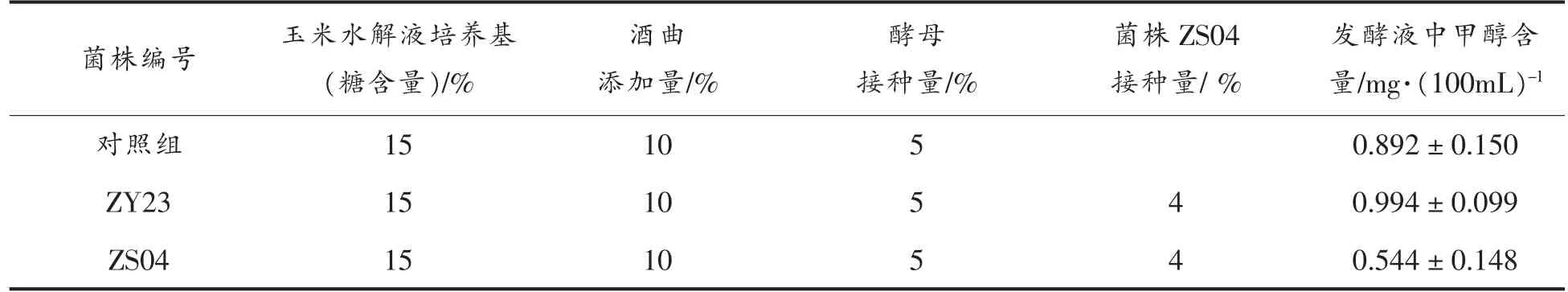
表4 菌株ZS04、ZY23 在白酒发酵中甲醇含量Table 4 The methanol contents of ZS04、ZY23 in liquor fermentation
2.2 菌株的鉴定结果
2.2.1 筛选菌株初步鉴定结果 菌株ZS04 为圆形白色,表面湿润褶皱,边缘不整齐,杆状、芽孢着生前段,革兰氏染色为阳性。生理生化鉴定,结果见表5。从以上试验结果可初步鉴定菌株ZS04 为芽孢杆菌属。
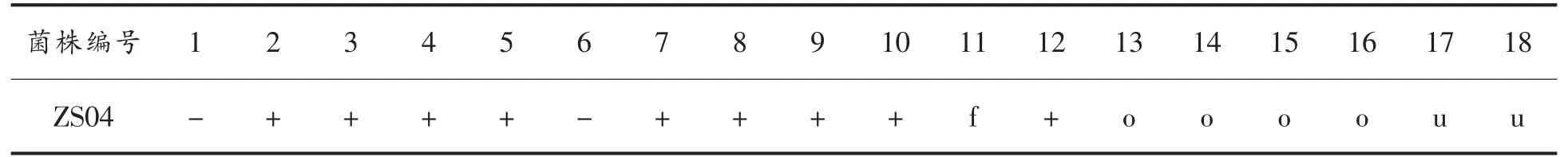
表5 ZS04 菌株生理生化鉴定结果Table 5 The physiology and biochemistry properties of ZS04 strain
2.2.2 菌株ZS04 的16Sr DNA 鉴定及系统发育分析结果 ZS04 菌株基因组DNA 经PCR 扩增、凝胶电泳检测,结果表明 (图1),与DL2000 Marker 比较,在1 000~2 000 bp 处有一明亮、无其它非特异性条带,与测序结果1 154 bp 相吻合。
将ZS04 菌株的基因测序结果与GenBank 数据库进行BLAST 比对分析,绘制系统发育树。结果见图2,菌株ZS04 与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)相似度为99%,确定菌株ZS04为解淀粉芽孢杆菌。
2.3 ZS04 生长曲线的绘制及培养条件
2.3.1 ZS04 生长曲线 从图3可知,0~12 h 为菌株ZS04 的迟缓期,12~34 h 为对数期,稳定期为34~43 h,衰亡期为43~60 h。最终确定该菌株最佳培养时间为36 h。
2.3.2 ZS04 培养条件 从图4可知,当接种量为5%时,菌体浓度达到最高值。从图5可知,ZS04 菌株的最佳培养温度为37 ℃。从图6可知,菌体生长的最适pH 值为6.5。
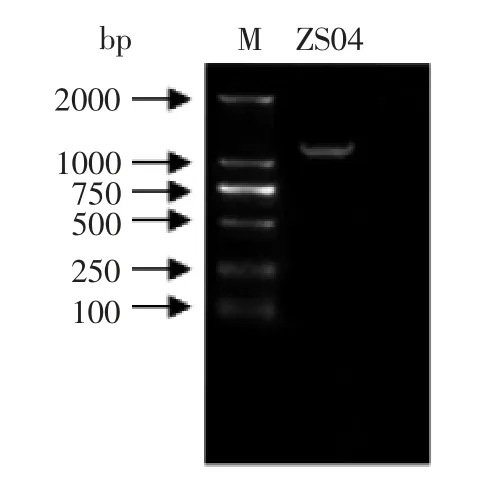
图1 PCR 扩增产物电泳图Fig.1 The electrophoresis photographs of PCR amplified prod

图2 ZS04 的16S rDNA 的系统发育树Fig.2 Phylogenetic tree of 16SrDNA gene of ZS04
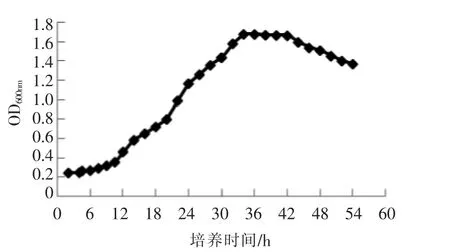
图3 ZS04 菌株的生长曲线Fig.3 The growth curve of ZS04 strain
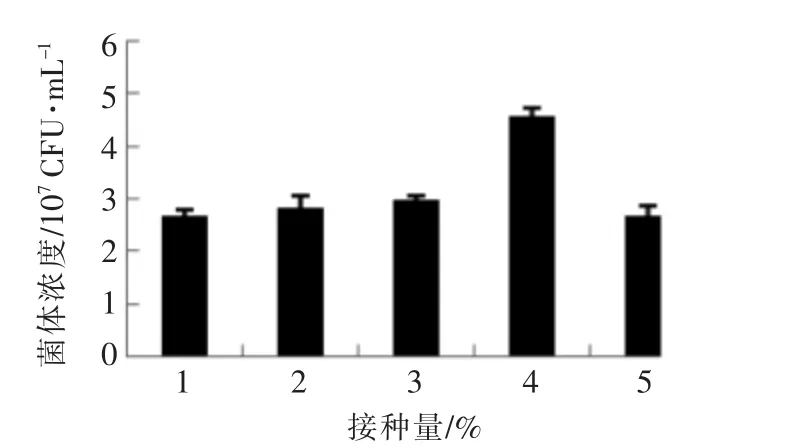
图4 接种量对菌体浓度的影响Fig.4 The influence of inoculation amount on bacteria growth

图5 温度对菌体生长的影响Fig.5 The influence of temperature on bacteria
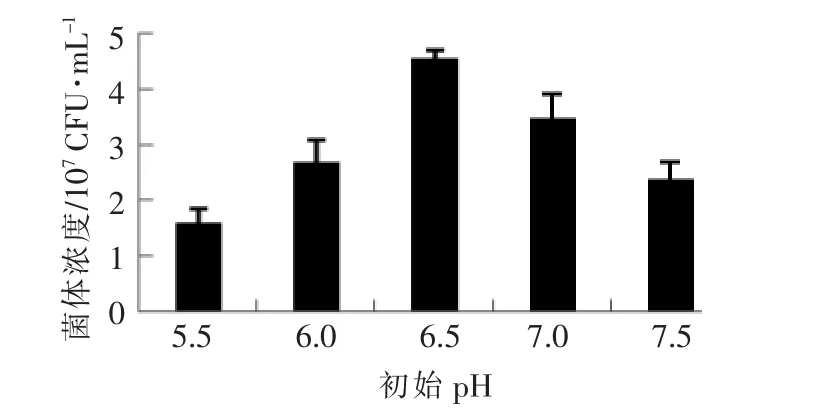
图6 初始pH 对菌体浓度的影响Fig.6 The influence of initial pH on the bacteria growth
以此条件培养菌株ZS04,菌体浓度最大为7.9×107CFU/mL。
2.4 ZS04 菌株在白酒发酵试验中的接种量
模拟白酒发酵进行至72 h 时终止发酵,蒸馏,用气相色谱测定发酵液中甲醇含量。如表6和图7可知,试验组各接种量的发酵液中甲醇含量比对照组的甲醇含量低。试验组接种量从0.5%,1%,2%,3%逐渐升高,而甲醇含量逐渐降低。接种量为0.5%时甲醇含量为0.705 mg/100 mL,比对照组低20.96%。接种量为3%时甲醇含量最低为0.313 mg/100 mL,比对照组降低66.03%。接种量为4%时发酵液中甲醇含量开始升高,高于对照组甲醇含量。发酵过程中接种菌株ZS04,抑制其它果胶降解菌的生长,而菌株ZS04 PE 酶活低,产甲醇量也随之降低;当接种量提高于3%时,可能因菌种接种量过高,导致产甲醇量也随之升高。接种量为0.5%时乙醇含量为8 739.0 mg/100 mL,比对照组和其它接种量高,说明在菌株ZS04 分泌的PG、PL 共同作用下,生成短链的聚半乳糖醛酸及其不饱和产物,为酿酒酵母提供了碳源,提高乙醇的产量[36-37]。而接种量高于0.5%时,过高的菌株ZS04 浓度抑制了酒曲中酵母的生长,使酒精产量降低。
GBT/10781.1-2006 《浓香型白酒》 高度酒(41°~68°)要求甲醇含量(g/100 mL)≤0.0400。将发酵液蒸馏为45°白酒后,试验组的甲醇含量均小于国家标准和对照组。白酒发酵中既要求乙醇含量高,又要求降低甲醇含量,可选0.5%接种量。如果对甲醇的含量有较高要求(如欧盟标准),可选3%接种量进行发酵,能大幅度降低甲醇的含量。

图7 ZS04 菌株不同接种量产生甲醇和乙醇含量Fig.7 The contents of methanol and ethanol by different inoculation amount from strain ZS04
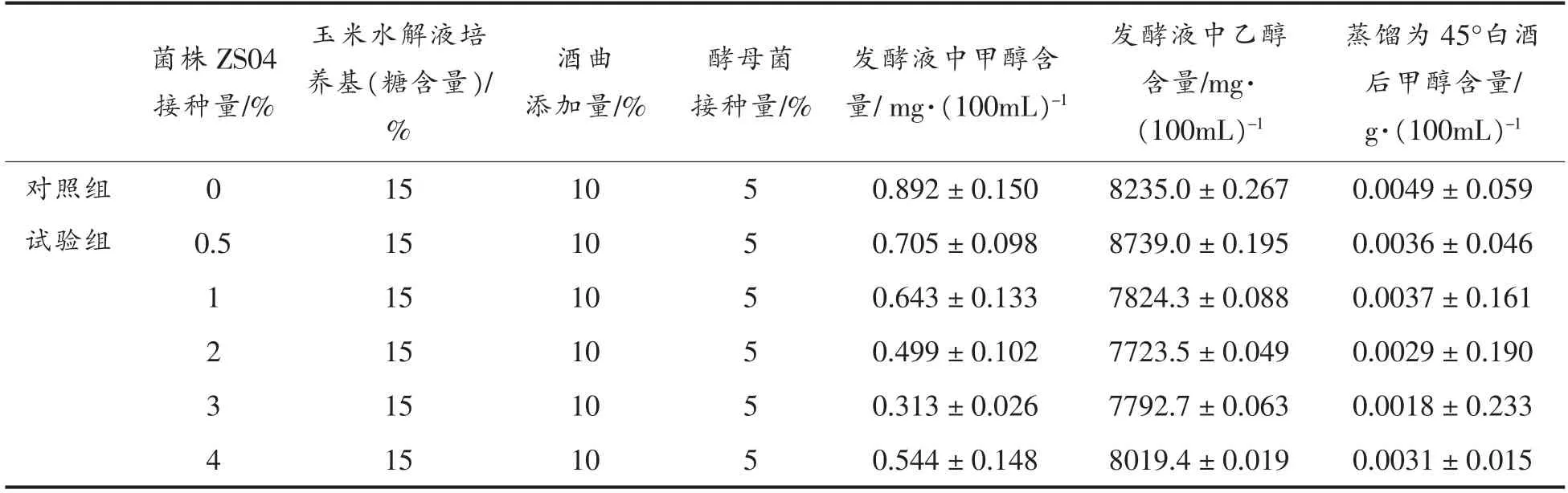
表6 ZS04 菌株不同接种量时发酵液中甲醇含量Table 6 The methanol content of ZS04 adding by the different inoculation in the liquor fermentation
3 结论
从优质酒曲中筛选PE 酶活力较低的菌株进行白酒液态发酵,确定产甲醇量最少的菌株。经形态学、生理生化和16S rDNA 鉴定,确定为解淀粉芽孢杆菌 (Bacillus amyloliquefaciens),命名为ZS04。对其培养条件进行初步研究,菌株生长的最适温度37 ℃、pH 6.5,在此条件下最低菌浓度为7.9×107CFU/mL。模拟白酒发酵,探究对菌株ZS04接种量与甲醇含量的关系。试验组接种量从0.5%,1%,2%,3%逐渐升高,甲醇含量逐渐降低,当接种量为4%时甲醇含量升高。接种量3 %时甲醇含量最低,比对照组降低66.03%;接种量为0.5%时甲醇含量为0.705 mg/100 mL,比对照组低20.96%,同时乙醇含量比对照组高5.77%。发酵中如果要求降低甲醇含量,并要求乙醇含量较高,可选0.5%接种量进行白酒发酵;如果对白酒中甲醇含量要求较苛刻,则可选3%接种量进行发酵,该方法同样可用于固体白酒发酵,以期从源头减少发酵中甲醇的生长,提高发酵白酒的品质。

