超声引导下细针穿刺细胞学检查联合BRAFV600E检测与甲状腺乳头状癌侵袭性病理特征的相关性
张 颖,罗渝昆,张 艳,张明博,广 旸,谢 芳,姜 波,唐 杰
1南开大学医学院,天津 3000712中国人民解放军总医院第一医学中心超声科,北京 100853
近年来,由于精准诊断技术如高频超声的不断发展以及环境因素的影响,甲状腺癌的发病率与检出率在全球范围内出现增长,目前已成为近年来发病率增长最快的恶性肿瘤[1]。甲状腺乳头状癌(papillary thyroid cancer,PTC)是甲状腺癌最常见的病理学类型,占所有甲状腺癌的85%~90%[1]。大多数PTC具有惰性生物学特征,但仍有部分PTC出现淋巴结转移或包膜外侵犯等侵袭性病理特征,进而改变临床分期,影响预后[1-2]。细针穿刺细胞学检查(fine-needle aspiration,FNA)被视为超声发现的甲状腺可疑结节最准确的诊断方法,具有风险小、准确性高等诸多优点,在指南中推荐,并在临床中广泛应用[2]。甲状腺细胞病理学Bethesda报告系统(Bethesda System for Reporting Thyroid Cytopathology,BSRTC)是FNA结果的规范解读,89%~95%的FNA可以得到满意的解读,并指导临床治疗[3]。但仍有近40%的FNA结果是不确定的,使得临床难以决定手术治疗方案,可能导致不必要的外科干预,增加医疗成本及风险[3]。BRAFV600E突变是PTC中最重要的基因突变,其突变率可高达28%~90%,特异性几乎达100%,但BRAFV600E基因突变频率在不同文献报道中差别较大,关于其突变能否提示PTC侵袭性的说法不一[4-7]。因此,本研究旨在探讨超声引导下FNA、BRAFV600E基因突变检测及两者联合与PTC临床病理特征的相关性,以期在FNA结果不确定时,指导临床治疗方案。
对象和方法
对象 选取2016年4月至2017年7月超声提示甲状腺可疑恶性结节,行超声引导下FNA及BRAFV600E基因突变检测,最终经手术病理证实为PTC的患者。其中在术前超声检查及术中探查均未发现异常淋巴结者,依据癌灶位置行预防性中央区淋巴结清扫或不清扫;在术前超声发现异常淋巴结或在术中触及肿大淋巴结者,依据异常淋巴结位置行中央区淋巴结清扫及选择性或预防性颈侧区淋巴结清扫。纳入标准:(1)行甲状腺切除术并经手术病理证实为PTC;(2)术前均经过超声、FNA检查及BRAFV600E基因突变检测。排除标准:(1)拒绝手术或未于中国人民解放军总医院行甲状腺切除术的患者;(2)手术病理不明确或为良性病变、除PTC之外的其他恶性病变;(3)甲状腺肿瘤复发或2次手术的患者。最终263例患者共263个结节(多发癌灶选择较大者)纳入本研究。检查前均获得患者本人知情同意并签署知情同意书。
超声引导下FNA 采用百胜MyLabTM Twice超声诊断仪,L 5-12 MHz高频探头。患者取仰卧位,颈部垫枕,头向后仰充分暴露颈前区,彩色多普勒超声选定拟穿刺结节,常规消毒后,以23G或25G针在彩超引导下,针尖进至可疑结节中心,在无负压情况下针尖在结节内不同部位来回提插10~15次,将穿刺所得样本立即涂片并置于95%酒精中固定,同时将穿刺针置于盛有180 μl细胞裂解液的1.5 ml EP 管中冲洗,以备BRAFV600E检测。
FNA病理判读 由经验丰富的病理科医师依照BSRTC结果分为Ⅰ~Ⅵ类,Ⅰ类:标本不能诊断或不满意;Ⅱ类:良性病变;Ⅲ类:意义不明确的细胞非典型病变或滤泡性病变;Ⅳ类:滤泡性肿瘤或可疑滤泡性肿瘤;Ⅴ类:可疑恶性肿瘤;Ⅵ类:恶性肿瘤[3]。
BRAFV600E基因检测 应用厦门艾德公司生产的人类BRAF基因V600E突变荧光PCR检测试剂盒,完全按照其说明书进行检测。将每例患者穿刺针的冲洗液使用DNA提取试剂盒法提取,利用实时荧光定量PCR法扩增。BRAFV600E突变检测结果判断:待测样品的内控HEX(或VIC)信号应升起;如待测样本外控FAM信号的每个反应管内的荧光信号到达设定的域值时所经历的循环数(cycle threshold,Ct)≥28,则样本为阴性(野生型),如样本的FAM信号Ct值<28,则样本为阳性(突变型)。
患者病变分期 采用美国癌症联合会TNM分期方案中的各项描述进行[8]。
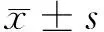
结 果
BRAFV600E基因突变与PTC临床病理特征的关系 共纳入263例患者,其中男性55例、女性208例,平均年龄(43.4±10.7)岁,45岁以下患者130例、45岁及以上患者133例。263例PTC中,最大径≤1 cm者[甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)]168例,最大径>1 cm者(非PTMC)95例。
263例PTC中,FNA诊断敏感度为86.3%(227/263);BRAFV600E基因突变率为85.9%(226/263),其中PTMC突变率为91.1%(153/168),非PTMC突变率为76.8%(73/95)。共225例患者进行淋巴结清扫,淋巴结转移率为35.6%(80/225),其中PTMC转移率为23.8%(34/143),非PTMC转移率为56.1%(46/82);包膜外侵犯的患者占9.9%(26/263)。
依照TNM分期,T1 222例(84.4%)、T2 11例(4.2%)、T3 30例(11.4%)。NX(未行淋巴结清扫,淋巴结转移情况不明)38例(14.4%)、N0 145例(55.1%)、N1a 46例(17.5%)、N1b 34例(12.9%)。所有患者癌灶未侵及皮下软组织、喉、气管、食管或喉返神经,均无远处转移。Ⅰ期225例(85.6%)、Ⅱ期1例(0.4%)、Ⅲ期26例(9.9%)、ⅣA期11例(4.2%)。
每项临床特征分为两组进行BRAFV600E突变率的比较,其中FNA病理结果分为标本不能诊断或不满意、良性病变、意义不明确的细胞非典型病变或滤泡性病变(不明确诊断)与可疑恶性肿瘤、恶性肿瘤(明确诊断)两组;肿瘤大小分为最大径≤1 cm(微小癌)与最大径>1 cm(非微小癌)两组;包膜侵犯情况分为无甲状腺外侵犯与甲状腺外侵犯两组;原发肿瘤T分期分为TI与T2~T3两组;淋巴结转移情况分为无转移(N0)与有转移(N1a/N1b)两组;临床分期分为Ⅰ期与Ⅱ~ⅣA期两组。BRAFV600E基因突变与年龄(<45 岁/≥45 岁,81.5% 比 90.2%,χ2=4.104,P=0.043)、FNA病理结果(无法诊断、良性、病理不明确/可疑恶性、恶性,72.2% 比88.1%,χ2=6.484,P=0.011)、是否为微小癌(≤1 cm/>1 cm,91.1% 比76.8%,χ2=10.164,P=0.001)、原发肿瘤T分期(T1/T2~T3,87.8% 比75.6%,χ2=4.281,P=0.039)有关,其中年龄≥45 岁、FNA诊断为恶性或可疑恶性、肿瘤最大径≤1 cm(微小癌)、原发肿瘤分期为T1者BRAFV600E突变率更高。而BRAFV600E突变与性别(男/女,85.5% 比 86.1%,χ2=0.013,P=0.909)、甲状腺包膜外侵犯(无甲状腺外侵犯/甲状腺外侵犯,86.1% 比 84.6%,χ2=0.000,P=1.000)、淋巴结转移(无区域淋巴结转移/有区域淋巴结转移,86.9% 比 78.8%,χ2=2.546,P=0.111)、肿瘤临床分期(Ⅰ期/Ⅱ期~Ⅳa期,86.7% 比81.6%,χ2=0.696,P=0.404)无关。
FNA病理结果与PTC临床病理特征的关系 单因素分析显示FNA诊断敏感度在不同年龄、性别、肿瘤大小、是否有甲状腺包膜外侵犯、原发肿瘤T分期、是否淋巴结转移、临床分期中差异均无统计学意义(表1)。以FNA病理结果(不明确诊断/明确诊断)为因变量,年龄是否>45岁、性别、肿瘤最大径是否≥1 cm、是否有甲状腺包膜外侵犯、是否淋巴结转移作为自变量,进行多因素分析,结果显示差异均无统计学意义(P>0.05)(表2)。

表1 FNA病理结果与PTC临床病理特征的关系Table 1 Relationship between FNA pathological findings and PTC clinicopathological characteristics
FNA:细针穿刺细胞学检查;PTC:甲状腺乳头状癌;ND/UNS:标本无法诊断或不满意;AUS/FLUS:意义不明的细胞非典型性病变或滤泡性病变;SM:可疑恶性肿瘤;淋巴结未清扫的病例不参与淋巴结是否转移中诊断率的比较;a:采用连续校正χ2值
FNA:fine-needle aspiration;PTC:papillary thyroid cancer;ND/UNS:nondiagnostic or unsatisfactory;AUS/FLUS:atypical cells of undetermined significance/ follicular lesions of undetermined significance;SM:suspicious for malignancy;patients without lymph node dissection did not participate in the comparison of the diagnostic rates in lymph node metastasis;a:continuous correction ofχ2is used
超声引导下FNA联合BRAFV600E基因突变检测与PTC侵袭性的关系 为明确当FNA明确诊断且BRAFV600E基因突变时,是否应当采取更积极的治疗策略,将患者分为FNA与BRAFV600E双阳性及非双阳性患者进行比较,即以下两组:FNA病理结果为Ⅴ、Ⅵ类且BRAFV600E为突变型的患者,及所有FNA病理结果为Ⅰ~Ⅲ类或BRAFV600E为野生型的患者。单因素分析显示,两组在不同临床病理特征(肿瘤最大径是否≥1 cm、是否有甲状腺包膜外侵犯、原发肿瘤T分期、是否有淋巴结转移、临床分期)中差异均无统计学意义(P>0.05)(表3)。以超声引导下FNA联合BRAFV600E基因突变检测结果为因变量,肿瘤最大径是否≥1 cm、是否有甲状腺包膜外侵犯、是否淋巴结转移作为自变量,进行多因素分析,结果显示差异均无统计学意义(P>0.05)(表4)。
讨 论
相关研究显示,甲状腺癌近年在全球范围内发病率持续增长,但死亡率没有明显上升,且增长的甲状腺癌主要是PTMC[1]。伴随着大样本长期随访研究的进行,目前认为大多数PTC,尤其是PTMC预后良好,一项包含18 445例PTMC患者的研究显示,其20年生存率可达95%,疾病特异性死亡率仅0.5%[9]。然而,仍有20%~30%的甲状腺癌因甲状腺外侵犯、淋巴结转移等高侵袭性表现影响预后[1]。因此,对甲状腺癌进行危险分层,明确哪些可以积极随访观察、哪些必须及时手术治疗,以及进行何种术式治疗尤为重要。

表2 FNA病理结果影响因素的Logistic回归分析结果Table 2 Logistic regression analysis of influencing factors of FNA pathological results

表3 超声引导下FNA联合BRAFV600E基因突变检测与PTC临床病理特征的关系Table 3 Ultrasound-guided FNA combined with BRAFV600E gene mutation detection and its relationship with PTC clinicopathological characteristics
淋巴结未清扫的病例不参与淋巴结是否转移中病理结果的比较
Patients without lymph node dissection did not participate in the comparison of pathological results in lymph node metastasis

表4 超声引导下FNA联合BRAFV600E基因突变检测的Logistic回归分析结果Table 4 Logistic regression analysis of ultrasound-guided FNA combined with BRAFV600E mutation detection
FNA是目前术前诊断甲状腺结节最可靠的方法,但仍有近40%的FNA结果是不确定的,使得临床难以决定治疗方案[3,10]。为了提高FNA的诊断价值,近年分子基因检测已成为研究热点,其中BRAFV600E突变在PTC中最为常见,其突变率可高达28%~90%[7]。有研究认为当FNA病理结果更明确时可提示PTC高侵袭性[4],而BRAFV600E在判断PTC侵袭性中的价值近年一直存在争议[4-7]。本研究通过结合FNA结果及BRAFV600E突变情况,与手术病理及临床分期相对照,探讨超声引导下FNA联合BRAFV600E检测与PTC侵袭性病理特征的相关性,为临床治疗提供参考依据。
本研究共纳入263例手术病理证实为PTC的患者,仍有36例术前FNA病理不明确,FNA诊断敏感度为86.3%,与相关研究结果[11]相近。对比分析FNA诊断为Ⅰ、Ⅱ、Ⅲ类及Ⅴ、Ⅵ类的PTC,两组患者在不同年龄分组、性别、肿瘤大小、是否有甲状腺包膜外侵犯、原发肿瘤T分期、是否淋巴结转移以及临床分期中差异均无统计学意义。Vanderlaan等[5]认为患者的性别、年龄、肿瘤是否多发与FNA诊断明确与否无关,但FNA诊断为Ⅵ类的PTC倾向于更高的临床分期,Ⅲ类时则多数最终证实为滤泡亚型PTC,表现为更低的侵袭性。然而,本研究FNA最初诊断为Ⅲ类的PTC中,有1例为弥漫硬化型PTC,为高侵袭性亚型,术前已发生明显的淋巴结转移,FNA诊断不明确的原因可能是穿刺时无法对癌灶进行准确定位。此外,36例FNA结果不明确的PTC中,PTMC占77.8%(28/36),在剩余的8例非PTMC中,除1例弥漫硬化型PTC外,4例伴桥本氏甲状腺炎,1例伴周围腺体腺瘤样增生,因此,穿刺标本不足或受到周围腺体良性病变的影响可能是导致FNA结果不明确的原因,并非因侵袭性低所致。
本研究BRAFV600E基因突变与年龄、是否为微小癌、原发肿瘤T分期有关,而与性别、甲状腺包膜外侵犯、淋巴结转移、肿瘤临床分期无关。其中年龄≥45 岁、肿瘤最大径≤1 cm(微小癌)、原发肿瘤分期为T1者BRAFV600E突变率更高。这一结果与Trovisco等[6]的研究结果相似。Trovisco等[6]通过分析来自7所医院的多中心数据,得出BRAFV600E与PTC大小、血管侵犯、甲状腺外侵犯、淋巴结转移等高侵袭性特征无关,而与年龄有关,年龄大者BRAFV600E突变率更高。在年老的人群中BRAFV600E突变率更高,可能是带有BRAFV600E突变的PTC更容易出现在年老的人群中,或者是在同等年龄的人群中,带有BRAFV600E突变的PTC进展更慢。而后一种假设表明BRAFV600E突变并不意味高侵袭性,反而可能相对于其他类型的基因突变使PTC表现得更为惰性,而这一假设也可以解释本研究的结果。肿瘤最大径≤1 cm、原发肿瘤分期为T1均为低侵袭性指标,并且本研究2例弥漫硬化型PTC及1例低分化PTC均未见BRAFV600E突变。本研究PTMC占63.9%(168/263),BRAFV600E在PTMC中的突变率(91.1%)显著高于非PTMC(76.8%)(P=0.001),造成整体BRAFV600E突变率升高,研究对象的不同也可能是导致与一些研究结论[12]相反的原因。由于PTC相对良好的临床预后与BRAFV600E基因的高突变率,不良事件的发生与BRAFV600E突变之间缺乏相关性是合乎逻辑的[13]。此外,在进展迅速的儿童PTC、弥漫硬化型PTC等高危亚型中罕有BRAFV600E突变也可说明这一结论[14]。
有研究指出,明确的FNA结果与BRAFV600E突变同时存在可以预测PTC更高的侵袭性与临床分期[4]。为明确当FNA明确诊断且BRAFV600E基因突变时,是否应当采取更积极的治疗策略,本研究进一步将FNA与BRAFV600E双阳性及非双阳性患者进行比较,结果证实两组患者在不同临床及病理特征下差异无统计学意义。因此,不论是FNA明确诊断为恶性,还是BRAFV600E存在突变,都不应是扩大甲状腺切除范围或者对临床淋巴结转移阴性的患者进行预防性中央区淋巴结清扫的指征。在今后的研究中,应找寻除BRAFV600E外更适于评价PTC侵袭性的分子诊断指标,建立更加有效的甲状腺癌风险分层体系。
综上,FNA病理结果及BRAFV600E基因突变检测与PTC的侵袭性病理特征无相关性,双阳性的结果与更高侵袭性病理特征也无相关性。由于BRAFV600E在低侵袭性PTMC中的高突变率,其在评估PTC侵袭性中的价值受限。

