N-乙酰半胱氨酸对术后认知功能障碍模型小鼠认知功能及核因子E2相关因子2/血红素加氧酶-1信号通路的影响
闫 焱
广州市第一人民医院麻醉科,广州 510180
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是手术和麻醉引起的众多并发症之一,Eckenhoff和Laudansky[1]认为麻醉和手术时,炎症介质如白介素-6(interleukin-6,IL-6)等的爆发经迷走神经传入和通过血脑屏障作用于中枢神经系统,引起级联炎症反应,损伤突触和神经元,最终导致POCD,血浆中IL-6水平升高程度与认知功能的损害密切相关[2]。与学习和记忆相关的海马组织在炎症反应中最易受累[3],有研究从恐惧记忆、空间认知及反转认知等方面证实术后海马组织损伤所致的炎症反应与认知障碍是一致的[4-5]。脑组织的高代谢特性导致其容易发生氧化应激损伤,在炎症反应发生的同时,POCD模型大鼠海马组织中氧化应激标记物丙二醛(malondialdehyde,MDA)含量增加[6],因此抗炎制剂并不能完全防止POCD的发生。核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)是细胞内重要的转录因子,在中枢神经系统表达广泛,对多种脑组织病变具有神经保护功能,其所调控的下游基因血红素加氧酶-1(heme oxygenase-1,HO-1)被认为是最强的抗氧化蛋白,在抗氧化应激中发挥重要作用。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是氨基酸半胱氨酸的衍生物,是体内形成抗氧化剂谷胱甘肽的前体物质,而谷胱甘肽是脑内主要的抗氧化剂,增强大脑对与认知损伤有关的氧化应激的反应能力[7],同时减轻炎性反应对认知的损伤[8]。本研究通过建立POCD小鼠模型,评价NAC对POCD小鼠认知功能、海马组织氧化应激和炎性反应的影响,探讨Nrf2/HO-1信号通路是否POCD发生的相关机制。
材料和方法
实验动物 雄性3~4月龄C57BL/6J小鼠54只,体重25~35 g,由广东省实验动物中心提供,饲养于无特定病原体级动物房,研究遵循实验动物伦理学并通过医院实验动物伦理委员会审查批准。将小鼠置于安静、自然光的环境饲养48 h以上,保持动物在恒温(23±3)℃,相对湿度(50±10)%,12 h~12 h昼夜节律,自然饮水、进食。
POCD小鼠模型建立 所有小鼠行2 %异氟醚吸入麻醉,在切皮前和手术结束时,皮下注射盐酸丁丙诺啡0.1 mg/kg,手术后4 h再次注射,用于镇痛。根据文献[7]行左下肢胫骨骨折固定术,左胫骨剃毛后消毒,在胫骨近端用25号针头钻一0.3 mm的孔,将0.38 mm的不锈钢棒置入髓腔内约15 mm,行髓内固定。分离腓骨和胫骨周围肌肉,剥离10 mm范围内的骨膜,在胫骨中下1/3交界处行截骨术,冲洗伤口,缝合皮肤。手术过程中应用保温毯保温36~37℃,术后小鼠置于加热垫复苏,清醒后送回笼中。
分组 采用随机区组设计,利用随机数字表法将小鼠随机分为3组(n=18):对照组、手术组、手术+NAC组,3组小鼠行相同麻醉与镇痛方案,手术组和手术+NAC组行胫骨骨折内固定术。游离NAC在血浆中的半衰期为2.15 h,为维持血浆浓度,手术+NAC组分别于麻醉前30 min、术后3 h和6 h腹腔内注射NAC(购自碧云天,S0077)150 mg/kg,对照组和手术组在相同时间点腹腔注射0.9 %生理盐水。
水迷宫测试 在直径110 cm、高30 cm的圆形水池内,目标象限有一个直径10 cm的平台,隐藏于距离水面1 cm的水下,水温保持23~25℃。参照文献[9],术后第3天每组利用随机数字表法随机取6只小鼠,小鼠每天训练4次,间隔30~40 min,共训练4 d。在60 s的时间内,若发现平台,则训练结束,小鼠在平台上停留15 s;若无法找到平台,则引导小鼠登上平台并停留15 s。记录到达平台的时间(逃避潜伏期)和游泳速度。术后第7天,实施探索实验用于测试空间记忆,在此实验中,将原有平台移走,记录小鼠60 s内穿越原来平台区域的次数和在目标象限内停留的时间。
海马组织的提取 术后1、3 d各组利用随机数字表法随机选取6只小鼠,行断头处死,从枕骨大孔剪开颅骨,暴露并分离脑组织,置于冰上分离出海马组织。取左侧海马组织用预冷的磷酸盐缓冲液冲洗组织,去除残留血液,在冰上充分研磨。将匀浆液于4℃以5000 r/min(转子半径13.5 cm)离心20 min,取上清液分装,-20℃保存备用。将右侧海马组织加入液氮速冻,-70℃保存备用。
酶联免疫吸附法测定海马组织IL-6和MDA的含量 参照酶联免疫吸附测定试剂盒说明书操作,测定海马组织IL-6(美国Abcam公司,ab100712)和MDA(美国Abcam公司,ab238537)的含量。经MK3 酶标仪读取吸光度光密度值,对应标准曲线得出IL-6和MDA的含量。
Western blot检测海马组织Nrf2和HO-1的蛋白表达 每10 mg海马组织中加入200 μl蛋白裂解液,BCA法测定蛋白浓度,十二烷基硫酸钠聚丙烯酰胺凝胶分离蛋白,电转移至聚偏二氟乙烯膜,封闭膜1 h后加入Nrf2(1∶1500,美国 Santa Cruz公司)、HO-1(1∶1000,美国 Santa Cruz公司)、β-actin抗体(1∶3000,美国 Santa Cruz公司),4℃过夜,第2天洗膜后用二抗生物素标记山羊抗兔IgG杂交(1∶5000,美国Cell Signaling公司),采用Image Lab 3.0软件进行灰度分析。以β-actin作为内参蛋白,待测蛋白条带与β-actin条带灰度值的比值代表其蛋白质相对表达水平。
实时荧光定量PCR检测海马组织Nrf2和HO-1 mRNA表达 采用Trizol法提取总RNA,反转录合成cDNA,扩增Nrf2和HO-1基因片段所需的上下游引物(引物序列及扩增的片段长度见表1)。以β-actin作为内参照,相对定量解析方法用于mRNA表达量解析,采用2-(ΔΔCt)方法,将对照组的mRNA表达量作为1,靶基因相对定量=2-(ΔΔCt),ΔΔCt=ΔCt靶基因-ΔCtβ-actin,Ct值为目标扩增产物达到设定阈值所需反应循环数。
统计学处理 采用SPSS 17.0统计软件,应用完全随机设计的单因素方差分析;水迷宫结果用重复测量方差分析。使用重复测量数据多重比较配对的t检验法(Bonferroni法),对组间和组内不同观测时间点进行两两比较;使用多元方差分析法,对各时点进行组间两两比较。实验数据以均数±标准差表示,P<0.05为差异有统计学意义。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences used in real-time polymerase chain reaction sequence
Nrf2:核因子E2相关因子2;HO-1:血红素加氧酶-1
Nrf2:nuclear factor erythroid 2 related factor 2;HO-1:heme oxygenase-1
结 果
NAC对POCD小鼠认知功能的作用 3组小鼠的游泳速度差异无统计学意义(F=2.135,P=0.114);与对照组和手术+NAC组小鼠相比,手术组小鼠的逃避潜伏期延长(P<0.01),穿越平台次数减少(P<0.01),目标象限停留时间减少(P<0.01),即NAC可降低POCD小鼠的认知功能损伤(图1)。
海马组织IL-6、MDA的水平 与对照组相比,手术组和手术+NAC组术后1 d海马组织IL-6和MDA含量均明显增高(P均=0.000),术后第3天手术组仍高于对照组(P=0.000),手术+NAC组IL-6(P=0.251)和MDA(P=0.103)含量降至对照组水平;与手术组相比,手术+NAC组术后第1、3天海马组织IL-6和MDA含量均明显降低(P均=0.000)(图2)。
海马组织Nrf2和HO-1的蛋白表达 与对照组相比,手术组和手术+NAC组术后海马组织Nrf2和HO-1蛋白表达均增高(P均=0.000);与手术组相比,手术+NAC组术后海马组织Nrf2和HO-1蛋白表达均明显增高(P均=0.000)(图3)。
海马组织Nrf2和HO-1 mRNA的表达 以对照组海马组织Nrf2和HO-1 mRNA 为对照样品,其相对表达量为1,计算各组海马组织Nrf2和HO-1 mRNA 的相对表达量,结果显示手术组和手术+NAC组Nrf2的mRNA表达在术后第1天均明显增加(P均=0.000);NAC可引起表达进一步增强,手术+NAC组明显高于手术组(P=0.000)。在术后第3天,Nrf2和HO-1的mRNA表达进一步增强(图4)。
讨 论
Morris水迷宫是20世纪80年代由英国心理学家Morris设计并应用于评估啮齿类动物学习记忆功能的重要工具[10],与海马依赖性记忆有很强的关联性[11]。Morris水迷宫动物训练形成的空间参考记忆属于陈述性记忆,储存机制主要与海马相关,认知障碍的患者陈述性记忆首先受损且较突出[12],运用Morris水迷宫对NAC防治POCD进行研究是恰当的。本研究行小鼠左下肢胫骨骨折内固定术,建立POCD小鼠模型,应用Morris水迷宫行为学测试,结果显示手术组逃避潜伏期延长,探索时间明显缩短,表明其空间学习记忆能力明显受损,发生认知功能障碍,小鼠POCD模型建立成功。本研究证实NAC预处理可改善手术后小鼠的认知功能,与手术组小鼠相比,逃避潜伏期明显缩短,探索时间延长,表明NAC可能具有潜在的防治POCD的作用。
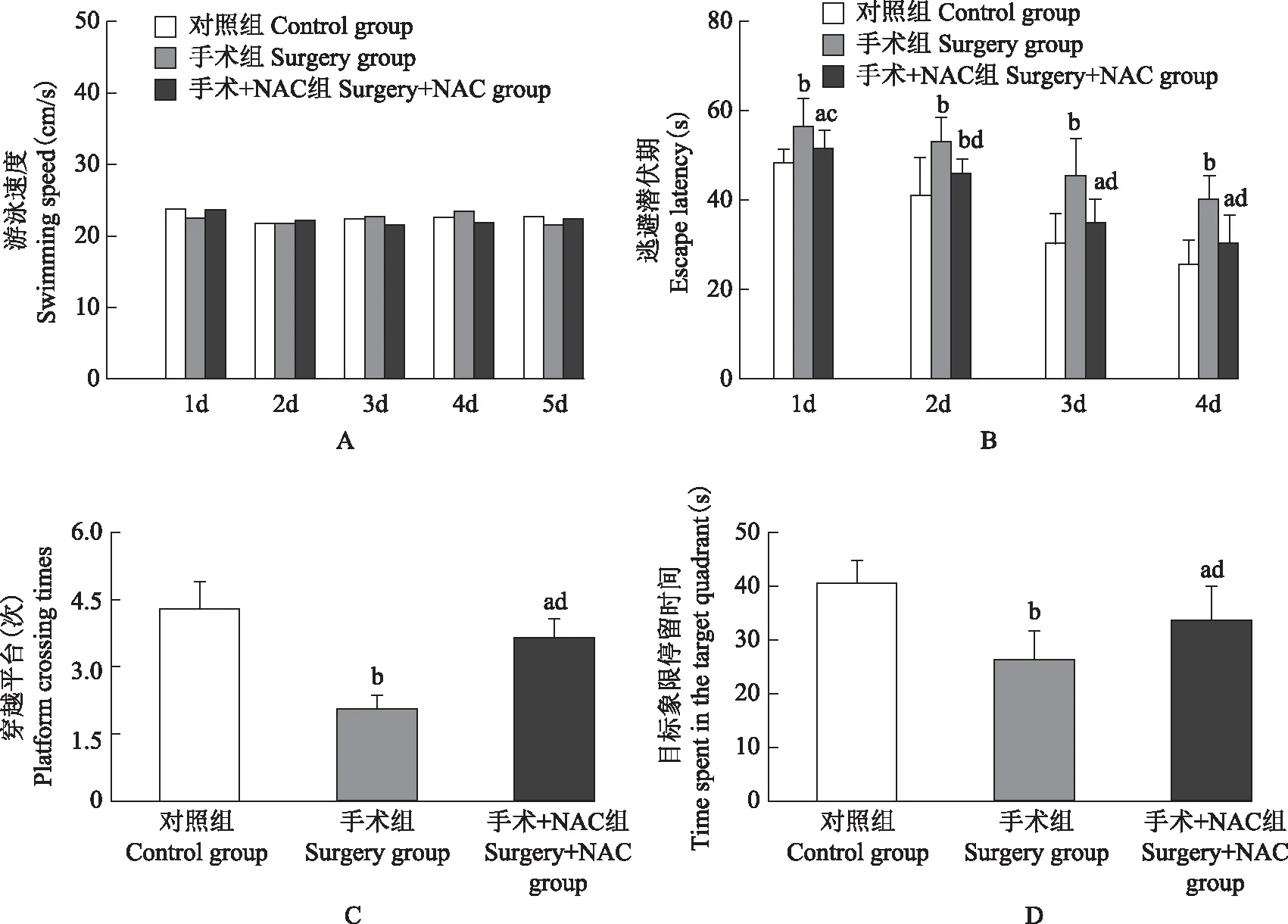
NAC:N-乙酰半胱氨酸;与对照组相比,aP<0.05,bP<0.01;与手术组相比,cP<0.05,dP<0.01
NAC:N-acetyl cysteine;aP<0.05,bP<0.01 compared with the control group;cP<0.05,dP<0.01 compared with the surgery group
图1 3组小鼠游泳速度(A)、逃避潜伏期(B)、穿越平台次数(C)、在目标象限内停留时间(D)的比较
Fig 1 Comparison of the swimming speed(A),escape latency(B),platform crossing times(C)and time spent in the target quadrant(D)of mice in each group

IL-6:白介素-6;MDA:丙二醛;与对照组相比,aP=0.000;与手术组相比,bP=0.000
IL-6:interleukin-6;MDA:malondialdehyde;aP=0.000 compared with the control group;bP=0.000 compared with the surgery group
图2 3组小鼠海马组织IL-6(A)、MDA(B)含量的比较
Fig 2 Expressions of IL-6(A)and MDA(B)in the hippocampus of mice in each group
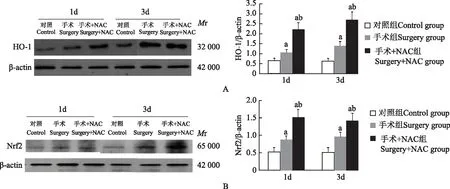
Mr:相对分子质量;与对照组相比,aP=0.000;与手术组相比,bP=0.000
Mr:relative molecular mass;aP=0.000 compared with the control group;bP=0.000 compared with the surgery group
图3 3组小鼠海马组织HO-1(A)、Nrf2(B)的蛋白表达
Fig 3 Expressions of HO-1(A)and Nrf2(B)proteins in the hippocampus of mice in each group
活性氧(reactive oxygen species,ROS)集聚可引起神经元变性,NAC可直接清除ROS,发挥抗氧化、抗炎、调节细胞代谢等作用。脑组织抗氧化能力差,其中海马组织是富含多不饱和脂肪酸的神经组织结构,易受到氧化应激过程中自由基的攻击而损伤。NAC通过修复谷胱甘肽池[13]和清除ROS[14]发挥神经保护作用,在维持神经元稳态中发挥重要的作用[15]。有研究显示,与学习和记忆相关的海马组织发生神经炎性和氧化应激反应是引发POCD的关键机制[16-17]。一项Meta分析表明IL-6水平与POCD相关,可用于指导POCD的预防和治疗[18];另一方面,氧化应激反应产生的超氧化物自由基可引起脑组织损伤、加速脑细胞死亡,氧化应激标记物MDA含量反映细胞损伤的程度[6]。有研究显示NAC可增强抗氧化酶的活性,抑制MDA的形成,降低IL-6水平,发挥脑保护的作用[19]。本研究POCD小鼠术后1、3 d海马组织IL-6水平增加,同时MDA含量上升。经NAC预处理后,IL-6、MDA水平明显低于手术组,降低海马组织氧化应激和炎性反应。

与对照组相比,aP=0.000;与手术组相比,bP=0.000
aP=0.000 compared with the control group;bP=0.000 compared with the surgery group
图4 3组小鼠海马组织HO-1(A)、Nrf2(B)的mRNA表达
Fig 4 The mRNA expressions of HO-1(A)and Nrf2(B)in the hippocampus of mice in each group
为探讨NAC降低POCD小鼠海马组织氧化应激和炎性反应的可能机制,本研究检测Nrf2和HO-1的蛋白和mRNA表达,结果显示Nrf2和HO-1的蛋白和mRNA表达水平均上调,NAC增强了Nrf2/HO-1信号通路的活性,上调抗氧化基因HO-1的表达,从而减轻氧化应激和炎性反应。越来越多的证据表明创伤性脑损伤后,Nrf2的抗氧化作用通过上调Ⅱ相抗氧化酶,如HO-1等完成。Nrf2是保护细胞抗氧化和炎性损伤信号通路的关键协调者,HO-1是受其调控的抗氧化应激和抗炎症反应的重要基因。Nrf2和其调控基因不仅可抑制氧化应激反应,还能调控炎症反应[20]。HO-1是强效抗氧化剂,正常状态下以低水平表达,当受到环境因素的刺激时,尤其是氧化应激和ROS的刺激,其表达迅速上升,清除炎性反应时巨噬细胞产生的氧自由基,具有强效抗脂类和脂蛋白氧化的作用[21]。HO-1通过抑制内膜黏附分子表达而抑制炎性细胞的趋化、黏附和渗透,发挥抗炎作用[22]。笔者推断NAC对POCD小鼠的保护作用与Nrf2/HO-1信号通路的激活密切相关。
本研究结果证实NAC对POCD小鼠的保护作用及其作用机制。NAC预处理后的POCD小鼠降低海马组织氧化应激和炎性反应,改善认知功能,此作用与激活Nrf2/HO-1信号通路相关。但是本研究仅检测了Nrf2和HO-1的蛋白及mRNA表达,在此基础上仍需进一步探讨NAC的作用机制。笔者认为,NAC可作为新的药物用于POCD的防治。

