hBDNF转基因神经干细胞对脑外伤大鼠的神经保护作用
徐忠烨,胡永珍,张立阳,李晓娜,李雪松
(惠州市第三人民医院神经外科,广东 惠州 516002)
创伤性脑外伤常常引起神经细胞大量的死亡和严重的神经功能障碍,内源性神经干细胞不足以有效地重建损伤的结构和恢复神经功能。因此,移植转基因神经干细胞治疗中枢神经系统的损伤具有广阔的应用前景,一方面其分泌的外源性细胞因子可以改善损伤局部的微环境为损伤组织提供营养支持;另一方面神经干细胞可以在中枢神经系统内良好地整合,参与神经结构的重建[1]。脑源性神经营养因子(Brain derived neurotrophic factor,BDNF)是最为重要的神经营养因子之一,在促进神经元存活和防止损伤后神经细胞退行性病变等方面具有重要的作用[2-3]。本研究拟通过移植稳定表达外源性hBDNF基因的神经干细胞治疗创伤性脑外伤大鼠,并探讨可能的保护机制。
1 材料和方法
1.1 实验材料细胞培养基和各种细胞因子为Sigma公司产品,RT-PCR试剂盒为TaKaRa公司产品,TUNEL试剂盒为Roche公司产品。稳定表达hBDNF和增强型绿色荧光蛋白(EGFP)的转基因神经干细胞为本实验室自行制备及冻存, hBDNF ELISA检测试剂盒为北京晶美公司产品。引物的设计与合成:hBDNF扩增上游引物为5'GACATCATTGGCTGACACTTTCG3',下游引物为5'ATGGGATTGCACTTGGTCTCGTA3',引物扩增产物长度为399bp;内参基因GAPDH的扩增上游引物为5'GAAGGTCGGAGTCAACGG3',下游引物为5'GGAAGATGGTGATGGGATT3',引物扩增产物长度为221bp。
1.2 细胞的复苏与扩增将冻存的细胞快速溶解后接种于含bFGF 20ng/mL,EGF 20ng/mL,1% N2和2% B27的DMEM/F12培养基中,37℃,5%CO2条件下培养,3~4d换液一次,7d传代一次。移植前利用流式细胞仪检测细胞表达EGFP的比率,利用RT-PCR(Reverse Transcription-Polymerase Chain Reaction)检测转基因神经干细胞表达外源性hBDNF基因的情况,具体过程包括:由细胞或组织提取总RNA,与试剂盒中的DEPC H2O和Oligo(dT)混合后行逆转录反应获得cDNA;取2μL cDNA与上下游引物、Taq酶、dNTP和PCR buffer混合至50μL总体积后进行PCR反应;反应产物行琼脂糖凝胶电泳,紫外线下观察结果,并应用图像分析系统分析结果。
1.3 动物模型制备成年雄性Wistar大鼠75只由重庆医科大学实验动物中心提供,采用改进的Feeney’s自由落体硬膜外撞击方法制备脑外伤大鼠模型,撞击位置为右侧前囟后3mm,中线旁2mm,将外伤后的大鼠分为3组(每组25只):Ⅰ组(对照组),注射PBS;Ⅱ组,移植神经干细胞;Ⅲ组,移植转基因神经干细胞。具体移植方法和位置:外伤后24h,在伤侧前囟后3mm和中线旁开1.1mm处分别在大脑皮层下2mm和4mm移植10μL PBS或细胞悬液(大约1×106个细胞),每点移植5μL。
1.4 转基因细胞在体内的存活及hBDNF的表达分别在移植后的1周和4周于各组随机选取大鼠,取脑固定后,由注射点前后连续制备冰冻切片,切片厚20μm,并在共聚焦显微镜下观察EGFP阳性细胞在体内的存活、迁移和分化。在移植后0d(伤后24h)、3d、1周、2周、3周和4周由各组中随机选取大鼠,取损伤灶及周边的脑组织200mg,应用RT-PCR和ELISA法检测hBDNF在脑内的表达。
1.5 各脑区细胞凋亡分析分别取移植后0d和移植后1周、2周、3周和4周的脑组织冰冻切片,应用TUNEL法检测神经细胞的凋亡。凋亡结果分析:取5张切片,在显微镜下观察,定量计数每张切片内TUNEL阳性细胞数量。
1.6 神经功能评分(Neurological Serverity Scores,NSS)移植细胞后0d、1周、2周、3周和4周,由每组动物随机选取5只大鼠进行NSS评分,NSS评分包括运动功能、感觉功能、平衡能力和反射能力的测试,评分采用双盲法。
1.7 统计学处理所有数据以SPSS 18.0统计软件建立数据库,数据以“均数±标准差”表示,P<0.05为差异有显著性。
2 结果
2.1 细胞的复苏和检测冻存的神经干细胞和转基因神经干细胞在复苏后7d均可以形成细胞克隆,转基因神经干细胞表达EGFP(图1),而非转基因神经干细胞无EGFP表达(图2),将这些细胞克隆传代2周后可见大量的神经干细胞克隆形成(图3、>4),应用流式细胞仪分析可见神经干细胞基本无EGFP表达,而转基因神经干细胞接近百分百的表达EGFP(图5)。RT-PCR分析表明(图6),神经干细胞无hBNDF基因表达,而转基因神经干细胞表达hBDNF基因。上述结果表明转基因神经干细胞经过复苏后仍可以稳定地表达外源性基因,符合我们实验的需要。
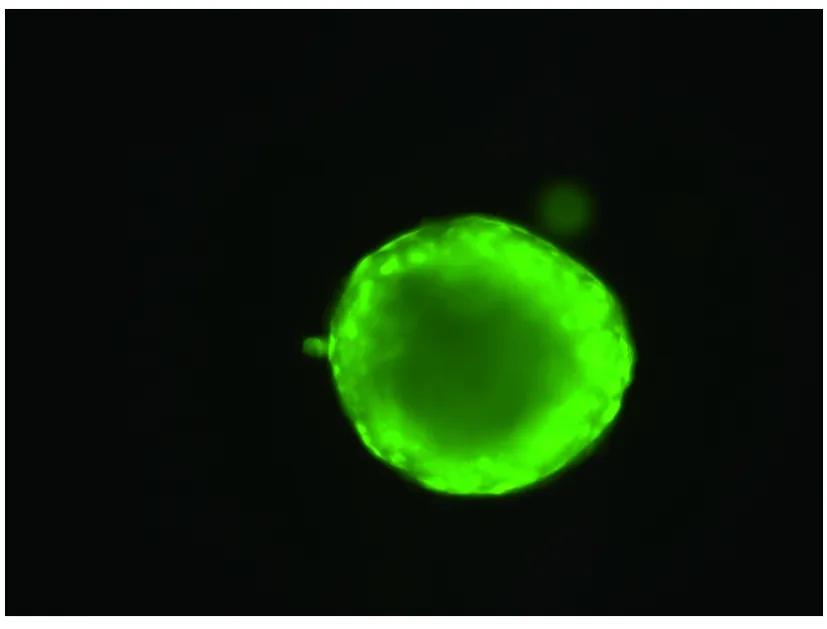
图1 复苏后EGFP阳性的转基因神经干细胞经克隆(×200)
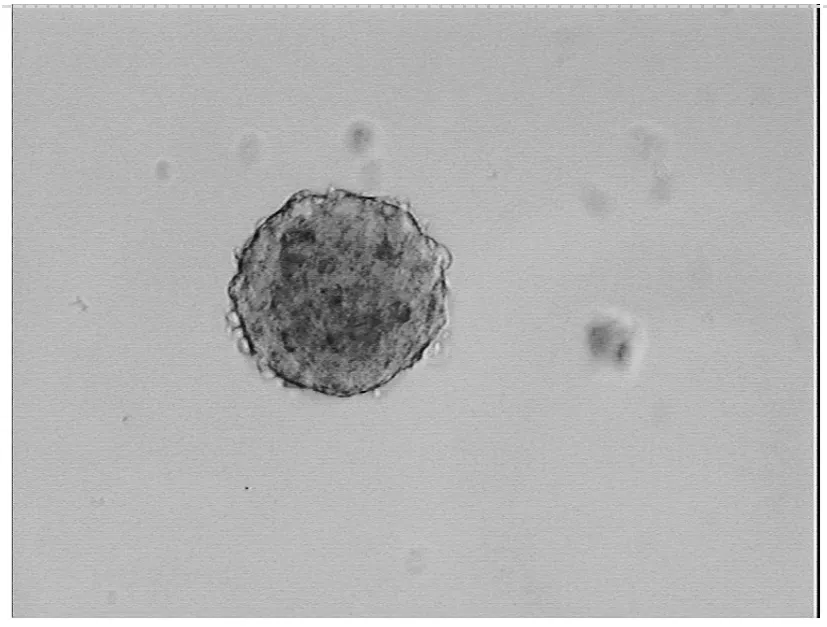
图2 复苏后的神经干细胞克隆(×200)
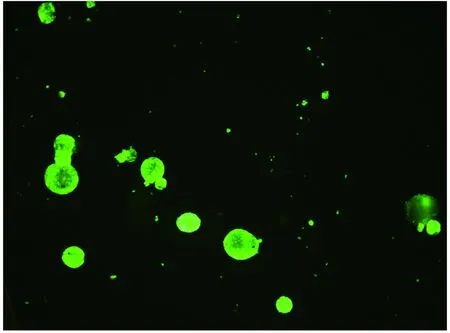
图3 转基因神经干细胞传代后形成大量的

图4 神经干细胞传代后形成大量的细胞克隆(×100)

图5 FACS分析表明98.84%的转基因神经干细胞为EGFP阳性细胞,而神经干细胞为EGFP阴性细胞
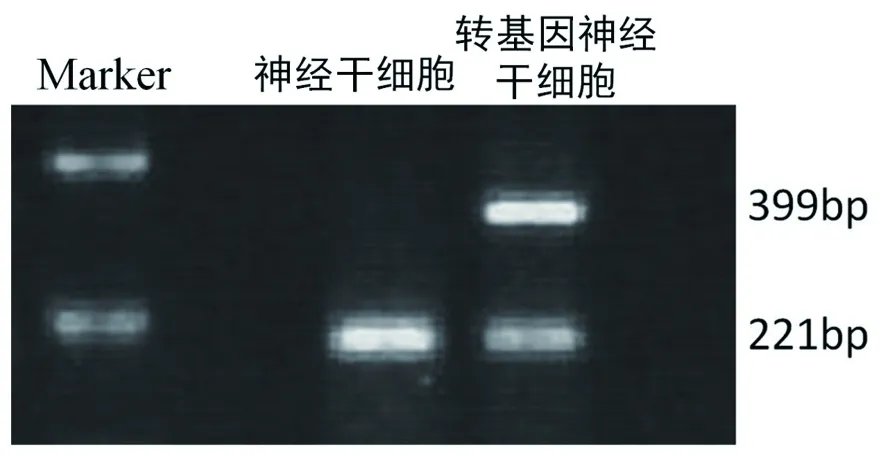
图6 RT-PCR结果表明神经干细胞不表达外源性的hBDNF基因,而转基因神经干细胞表达外源性的hBNDF基因
2.2 转基因细胞在体内的存活、迁移和分化移植后1周和4周在激光共聚焦显微镜下均可以观察到EGFP阳性细胞,移植后1周既可以观察到一些细胞由移植点向损伤区域迁移,而4周后可以观察到在病灶周边有大量的EGFP阳性细胞,并表现出成熟神经元的形态,具有明显的轴突和树突(图7、图8),说明移植细胞可以在宿主体内长期存活、迁移及分化。
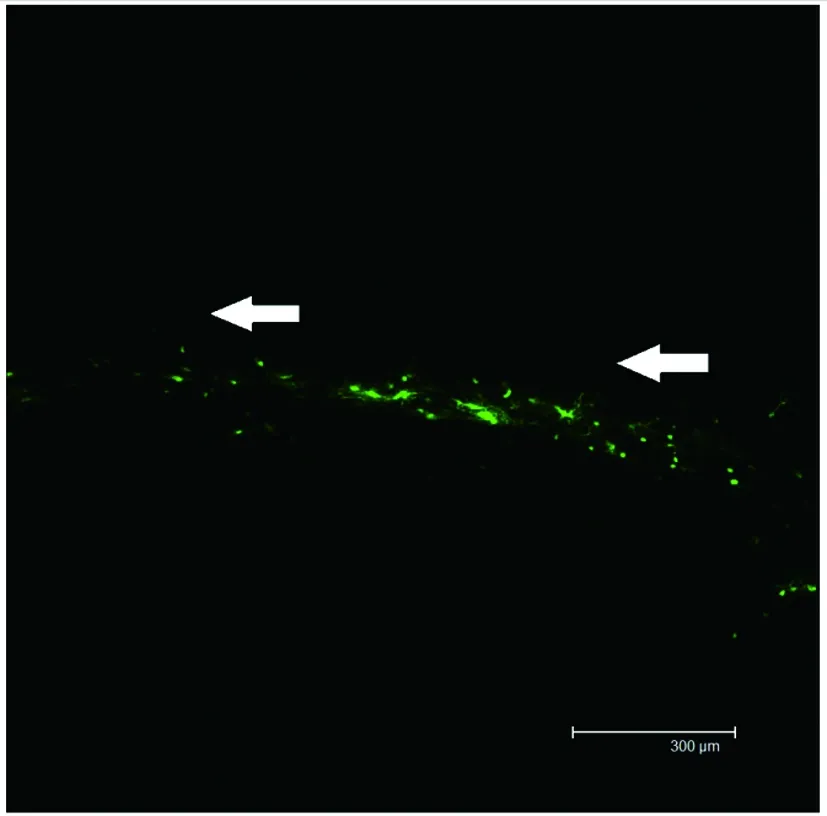
图7 移植到体内1周后可见EGFP阳性转基因细胞的迁移(白色箭头方向)。Scar=300μm

图8 移植4周后,病灶周围可见大量EGFP阳性转基因细胞分化而来的具有明显成熟神经元形态的细胞(白色箭头)。Scar=150μm
2.3 hBDNF在体内的表达RT-PCR结果表明在移植后的较长时间内(3d~4周),转基因神经干细胞可以持续性地表达外源性hBDNF基因,随时间的推移表达水平有所下降,但是在4周后仍可见明显的hBDNF表达(图9)。
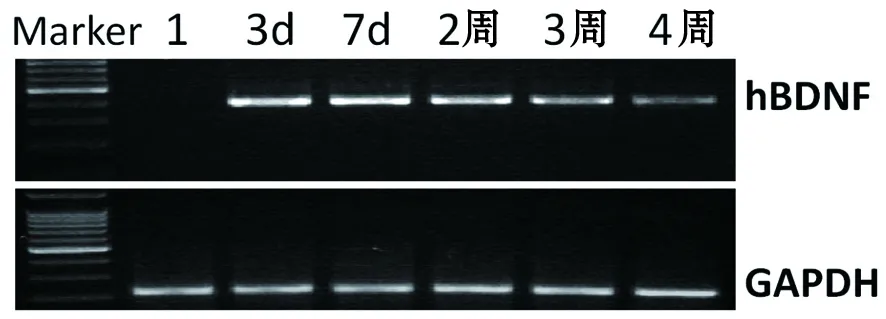
图9 移植后损伤周边区域内外源性hBDNF mRNA表达的RT-PCR分析
注:1为对照组
ELISA检测结果表明在移植后3d、1周、2周、3周和4周时,hBDNF在损伤局部的浓度分别是(4.24±0.52)、(5.12±0.63)、(3.4±0.73)、(3.22±0.58)、(2.56±0.45)ng/mg(总蛋白),变化趋势基本与PR-PCR结果相同,说明转基因神经干细胞可以在较长时间内分泌外源性的hBDNF。
2.4 细胞凋亡数量分析TUNEL检测结果表明,外伤后24h打击区域就有大量的细胞凋亡,各组间无明显差异。在Ⅰ组与Ⅱ组中,损伤后1周凋亡数量最高,随后凋亡数量下降,尽管在1周时Ⅱ组细胞凋亡数量少于Ⅰ组,但是无统计学差异,从2周以后Ⅱ组凋亡细胞数量开始明显低于Ⅰ组。与Ⅱ组相比,Ⅲ组从移植1周后开始各时间点细胞凋亡数量明显降低(P<0.05)。与Ⅰ组相比,Ⅲ组从移植1周后开始细胞凋亡数量降低更为明显(P<0.01),如表1。
表1 病灶周边细胞凋亡数量分析
注:在同一时间Ⅱ组与Ⅰ组比较,*P<0.05;Ⅲ组与Ⅰ组比较**P<0.01;Ⅲ组与Ⅱ组比较,#P<0.05。
2.5 大鼠神经功能的影响各组大鼠外伤后24h NSS评分均较高,说明创伤性脑外伤造成大鼠严重的神经功能障碍。Ⅱ组与Ⅰ组相比,从移植2周后开始NSS评分明显降低(P<0.05);Ⅲ组和Ⅰ组相比,从移植1周后开始NSS评分明显降低(P<0.01);Ⅲ组和Ⅱ组相比,从移植1周后开始NSS评分明显降低(P<0.05),如表2。
表2 细胞移植后脑外伤大鼠的NSS评分
注:与Ⅰ组比较,*P<0.05;**P<0.01。与Ⅱ组比较,#P<0.05。
3 讨论
神经干细胞(neural stem cells,NSCs)是来源于中枢神经系统的干细胞,具有自我更新和向多种神经细胞分化的潜能[4]。神经干细胞的发现为移植外源性细胞替代各种中枢神经系统损伤后的细胞损伤/坏死,促进神经功能障碍的恢复开辟了一个新的领域[5]。此外,神经干细胞还是一种优秀的外源性基因载体,对于利用转基因技术治疗中枢神经系统疾病具有重要意义[6]。
本研究结果表明,复苏后的神经干细胞和转基因神经干细胞可以在体外迅速地增殖,传代后可以形成大量的细胞克隆,提示神经干细胞和转基因神经干细胞经过冻存和复苏后其自我更新能力无明显变化。为了追踪外源性细胞在宿主体内的存活、迁移和分化等,需要在细胞移植前对其进行合适的标记,现有的各种示踪技术包括Brdu标记法、Hoechst标记法、转染LacZ基因、转染EGFP基因等方法[7]。在本研究中我们使用的转基因神经干细胞可以稳定地表达EGFP,EGFP的荧光强度很高,作为报告基因容易被仪器定量检测,并且在与目的基因连接后,可通过光学设备观察和检测外源性基因在细胞中的表达[8]。本研究的FACS结果表明转基因神经干细胞几乎都可以表达EGFP,移植到大鼠脑内后,这些转基因神经干细胞可以持续长时间地表达EGFP,这些EGFP充满了细胞的胞体和突起。在移植1周时我们除了可以观察到大量EGFP阳性细胞在宿主脑内存活外,还可以发现由移植区域向损伤区域的“细胞迁移流”,这些细胞尚未到达损伤区域,在“细胞迁移流”中部分细胞可见分化出明显的胞体和突起。移植4周后,我们仍可以观察到大量的EGFP阳性细胞,部分细胞表现出成熟神经细胞的形态,具有典型的轴突和树突。因此EGFP不仅可以用于示踪细胞,便于我们研究细胞在体内存活和迁移,还可以间接地反应出细胞分化状态。
创伤性脑外伤除了造成严重的原发性损伤外,随后发生的继发性损伤将在一段时间内持续,在7d左右达到高峰,在损伤局部会出现的多种有害因素还可以通过旁观者效应损伤与损伤灶相邻的神经组织或细胞,扩大神经功能障碍[9-10]。在本研究中,TUNEL计数和NSS评分结果证明外伤后24h在各组大鼠损伤灶周边即出现大量凋亡的神经细胞,NSS评分在13~14分之间(NSS评分在13~18为重度损伤、7~12为中度损伤、1~6为轻度损伤),证明脑外伤大鼠产生了严重的神经功能障碍。外伤后1周左右时在Ⅰ组和Ⅱ组中细胞凋亡达到高峰,NSS评分增加,而在Ⅲ组中细胞凋亡数量和NSS评分均下降。这些结果提示,原发性损伤后继发性损伤可以加重神经功能障碍,在1周左右时达到高峰,移植的神经干细胞在1周时尚未发挥明显的神经保护作用,这可能与此阶段的移植细胞正在向损伤区域迁移,尚未参与损伤的重建和神经的保护作用,而转基因神经干细胞则在移植后1周时就可以发挥了神经保护作用,这可能与其分泌的hBDNF参与了神经保护作用有关。
神经细胞的存活和生长离不开多种神经营养因子的刺激,在病理情况下施加外源性的神经营养因子会明显地促进神经细胞存活和再生,改善宿主的神经功能障碍。因为继发性损伤将在较长的一段时间内存在,因此只有移植稳定表达神经营养因子的外源性细胞才能确实有效地产生保护作用[11]。BDNF在促进成熟中枢神经系统神经元存活和防止损伤后神经细胞退行性病变等方面具有重要的作用[12],然而在成熟中枢神经系统中其含量极微,尽管在损伤后有一过性的表达增加,但维持时间较短,并且血脑屏障阻碍了从循环途径应用的BDNF,因此极大地限制了BDNF在治疗中的应用[13]。为了解决上述问题,我们在前期工作中制备了可以稳定表达hBNDF的转基因神经干细胞。在本研究中,RT-PCR检测证实复苏的转基因神经干细胞,扩增后仍可以表达hBDNF,移植后,脑组织的RT-PCR和ELISA检测表明这些转基因神经干细胞在体内可以长期地表达hBDNF,将损伤局部的hBDNF维持在较高水平。TUNEL和NSS评分结果显示,在细胞移植1周后,与Ⅱ组大鼠相比,Ⅲ组大鼠损伤病灶周边的细胞凋亡数量明显下降,NSS评分也明显下降,说明转基因神经干细胞分泌的hBDNF对病灶周围的神经细胞产生了明确的保护作用,进而促进了大鼠神经功能障碍的恢复。
总之,我们的研究表明,hBDNF转基因神经干细胞可以在体内长期、存活及分化,分泌的hBDNF可以直接作用于神经细胞产生明确的保护作用,促进脑外伤大鼠神经功能的恢复。本研究的成功将为进一步利用转基因神经干细胞治疗中枢神经系统疾病/损伤奠定一定的理论和实践基础。

