尿源性干细胞的外泌体修复骨不连的作用研究
刘一飞 王宇辰 朱 昱 褚光宇 汪秋柯 陈云丰
骨折不愈合亦称“骨不连”,是指骨折或损伤9个月以上,在多种因素影响下,骨折端停止愈合至少3或6个月以上,且在影像学上没有继续愈合的倾向[1]。相比于传统的治疗方法(如植骨等),干细胞的使用和组织工程方法为治疗骨不连提供了新思路。尿源性干细胞(USC)是从人尿液中分离得到的一种成体干细胞,与间充质干细胞(MSC)相比,其具有来源无限、取材无创、可自体取材等优势。有研究[2-6]结果表明,USC不仅能修复肌肉和泌尿系统损伤,亦能修复缺血损伤、皮肤创面、骨缺损和神经组织损伤。与其他干细胞类似,USC同样具有致畸、致瘤、免疫反应等风险。外泌体(Exos)是由细胞内多泡体(MVB)分泌的一种细胞外囊泡,能被靶细胞识别、吞噬并调控靶细胞生物学功能,包括免疫调节,受损组织血管修复、细胞增殖[7-8]等。MSC来源的Exos(MSC-Exos)可促进骨、软骨、血管再生[9],Exos移植可发挥与干细胞移植类似的生物学功能,且可避免直接移植干细胞的诸多风险,临床转化应用前景广阔。骨不连的Exos治疗,目前尚无相关的研究成果且疗效不明确。本研究旨在探讨人USC-Exos能否通过促进骨不连周围血管再生来促进骨不连的愈合。
1 材料与方法
1.1 材料与主要试剂 DMEM/F12培养基(美国Corning公司),无血清培养基(美国StemRD公司),FBS(美国Gibco公司),0.22 μm灭菌过滤器(美国Millipore公司),Transwell细胞迁移装置(美国Corning公司),Matrigel基质胶(美国BD Biosciences公司),Microfil血管灌注试剂(美国Flowtech公司)。
1.2 USC-Exos的分离提纯 USC培养基配制、USC分离与培养的过程参照文献[6],该研究由上海交通大学附属第六人民医院伦理委员会批准。取P4至P6代达到80%融合的USC,弃培养液,以PBS洗2次,更换无血清培养基,置于细胞培养箱中培养48 h。收集无血清培养液,以300×g离心10 min。取上清液,于4 ℃以2 000×g离心10 min。收集上清液,经0.22 μm灭菌过滤器过滤,以彻底去除残留的细胞和细胞碎片。吸取过滤液加至超滤管(德国Millipore公司)的上层中,于4 ℃以3 220×g离心30 min,此时上层的滤网周围会保留浓缩后的Exos溶液,用移液枪吸取后转移至无菌EP管中,置于-80 ℃冰箱中保存。
1.3 检测USC-Exos的形态、粒径表征 应用透射电子显微镜检测USC-Exos的形态和粒径,应用QNano平台(英国Izon○RScience公司)及其自带软件Control Suite v2.2(英国Izon○RScience公司)检测USC-Exos的大小和密度。
1.4 体外实验
1.4.1 实验分组 人脐静脉内皮细胞(HuVECs)分离和培养方法参照文献[10]的方法。取新鲜分离的USC-Exos悬液,按照不同密度0、107、108个/mL分别配制新的含有USC-Exos的HuVECs完全培养基,对应分组为对照组、USC-Exos 107组、USC-Exos 108组。
1.4.2 CCK-8增殖实验 将100 μL HuVECs的细胞悬浮液按照5×103个/孔的细胞密度接种至96孔板中,每组5个孔,于37 ℃、体积分数为0.05的CO2培养箱中培养24 h。向每孔加入10 μL CCK-8测试液,将96孔板于37 ℃孵育3 h,应用酶标仪测定波长450 nm处的吸光度(A450)值,每组计算5孔的平均值。弃培养液,以PBS洗涤各孔,按照分组更换含有不同密度USC-Exos的HuVECs完全培养基继续培养。每组均连续测定6 d,统计分析并绘制折线图。
1.4.3 Transwell实验 将各组的HuVECs完全培养基加入至Transwell小室下层。在小室上层中以每孔1×105个细胞加入HuVECs细胞悬液200 μL,于37 ℃、体积分数为0.05的CO2培养箱中培养12 h。取出Transwell小室,以湿棉签擦去上室底部膜表面上的细胞,4%多聚甲醛固定后行1%结晶紫染色,置于倒置光学显微镜下观察滤网Transwell小室下层的细胞染色情况并拍照。计数相同倍数的视野内被染色的细胞数量,作为完成迁移的细胞数。实验过程重复3次,取平均值。
1.4.4 成管实验 预先用Matrigel胶充分包裹96孔板的板底。按照每孔1×104个细胞的数量将HuVECs接种至Matrigel胶预处理的96孔板中,对照组、USC-Exos 107组、USC-Exos 108组分别加入含有0、107、108个/mL的USC-Exos的HuVECs完全培养基100 μL,放回培养箱。在培养第6、12 h时取出96孔板,于倒置显微镜下观察并拍摄毛细血管样结构形成的图像,应用Image J软件分析小管样结构的长度和分支点的数量,进行统计学分析。实验过程重复3次。
1.5 体内实验
1.5.1 USC-Exos-光致亚胺交联凝胶(piGEL)复合体 借助已受国际认可的piGEL[11-12]完成USC-Exos的体内植入,该凝胶可通过紫外线照射由溶胶转换为凝胶。本研究中,在体外将USC-Exos悬液与溶胶预先混合,再将其注入体内后经紫外线照射成为凝胶,以达到通过piGEL搭载Exos植入骨不连断端周围的作用。
1.5.2 大鼠股骨骨不连造模 参考Nakamura等[13]的方法并进行改进,建造大鼠股骨骨不连模型。取8周龄雌性Sprague-Dawley(SD)大鼠30只,体重200~250 g,动物伦理由上海交通大学附属第六人民医院动物房批准。予大鼠腹腔内注射4%水合氯醛(0.6 mL/100 g)麻醉。取膝关节外侧切口,暴露股骨远端的关节面,于骨髓腔植入直径0.8 mm克氏针。取股骨前外侧切口,暴露股骨,用圆锯横向完全切断股骨干中段,牵拉股骨造成骨折处1 mm分离。用刀片将骨折断端周围5 mm处的骨膜尽可能刮除干净,以彻底破坏骨折端血供。
1.5.3 分组 将30只大鼠随机分为空白组(向骨不连周围注射500 μL PBS)、不含USC-Exos的纯piGEL组(piGEL组,向骨不连周围注射500 μL piGEL)、含有109/mL USC-Exos的USC-Exos-piGEL组(USC-Exos-piGEL组,向骨不连周围注射500 μL USC-Exos-piGEL复合体),每组10只,每只大鼠左右侧股骨均进行相同处理。注射完成后于注射部位照射紫外光5 min。逐层缝合切口,以确保凝胶不会漏出。
1.5.4 影像学和组织学评估 术后第4、8周,各组随机抽取2只大鼠,分别行X线和micro-CT检查,观察大鼠股骨骨不连修复情况,通过micro-CT测定骨不连处的骨体积分数,即骨体积(BV)/组织体积(TV)×100%。术后第8周,将股骨组织样本取下后于20%EDTA脱钙液中脱钙30 d,行常规切片,经H-E染色和Masson染色后置于光学显微镜下观察组织结构。
1.5.5 组织切片免疫荧光检查 术后第8周取脱钙后的组织切片,采用常规方法对血管内皮的标志性抗原CD31、CD34、Ki67进行免疫荧光染色,置于荧光显微镜下观察骨不连周围血管再生情况。

2 结 果
2.1 USC-Exos的形态、大小、密度 透射电子显微镜下见USC-Exos直径约80 nm,形态呈类球形,有完整的膜结构,内部含有少量内容物;QNano平台及其自带软件分析结果可见,收集得到的Exos悬液包含的USC-Exos约为1.97×1010个/mL,直径为90~160 nm。见图1。

A 光学显微镜下USC-Exos的形态(×10) B 透射电镜下USC-Exos形态呈类球形,有完整的膜包被图1 光学显微镜下USC-Exos的形态和透射电子显微镜下USC-Exos的形态
2.2 USC-Exos体外实验
2.2.1 CCK-8增殖实验 细胞培养第1、2、3天,USC-Exos 107组和USC-Exos 108组HuVECs的A450值分别较对照组同时间有升高趋势,但差异均无统计学意义(P值均>0.05)。细胞培养第4、5、6天,USC-Exos 107组和USC-Exos 108组HuVECs的A450值均显著高于对照组同时间 (P值均<0.05),USC-Exos 108组HuVECs的A450值显著高于USC-Exos 107组同时间(P值均<0.05)。见表1。
2.2.2 Transwell迁移实验 对照组、USC-Exos 107组、USC-Exos 108组完成迁移的细胞数分别为(4.0±1.2)、(19.2±1.9)、(48.6±2.4)个,USC-Exos 107组和USC-Exos 108组完成迁移的细胞数均显著多于对照组(P值均<0.05),USC-Exos 108组完成迁移的细胞数显著多于USC-Exos 107组(P<0.05)。见图2。

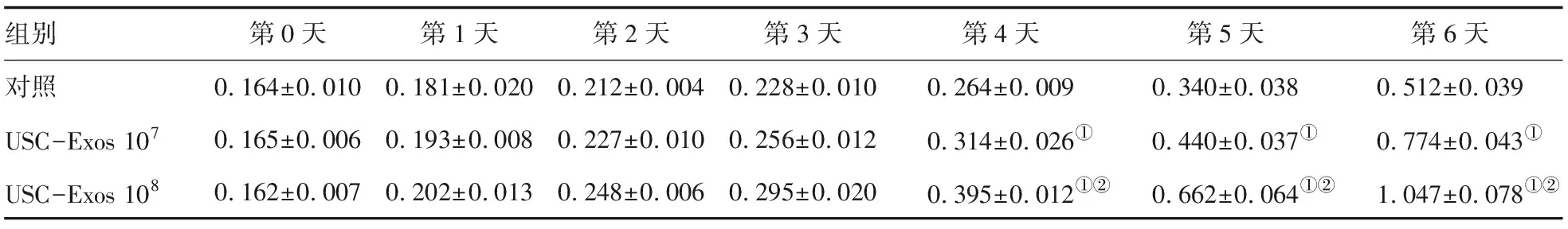
组别第0天第1天第2天第3天第4天第5天第6天对照0.164±0.0100.181±0.0200.212±0.0040.228±0.0100.264±0.0090.340±0.0380.512±0.039USC-Exos 1070.165±0.0060.193±0.0080.227±0.0100.256±0.0120.314±0.026①0.440±0.037①0.774±0.043①USC-Exos 1080.162±0.0070.202±0.0130.248±0.0060.295±0.0200.395±0.012①②0.662±0.064①②1.047±0.078①②
与对照组同时间比较:①P<0.05;与USC-Exos 107组同时间比较:②P<0.05

A 对照组 B USC-Exos 107组 C USC-Exos 108组图2 Transwell迁移实验结果(结晶紫染色,×4)
2.2.3 成管实验 对照组发出的分支与细胞之间未发生融合;USC-Exos 107组部分分支与细胞连接融合,形成分支点,围成闭合的小管样结构;USC-Exos 108组的分支点更多,围成更多闭合的小管样结构。见图3。USC-Exos 107组和USC-Exos 108组的分支点均显著多于对照组(P值均<0.05),小管长度均显著长于对照组(P值均<0.05);USC-Exos 108组的分支点显著多于USC-Exos 107组(P<0.05),小管长度显著长于USC-Exos 107组(P<0.05)。见表2。
2.3 体内实验
2.3.1 影像学检查结果 X线和micro-CT检查显示,空白组和piGEL组在术后第4、8周时骨不连均未修复,骨皮质不连续,骨折线存在,骨缺损未愈合;其中部分骨不连断端周围有骨痂形成,但未达到愈合标准。USC-Exos-piGEL组在术后第4周时,骨不连未修复,有骨痂形成,但仍有骨皮质不连续,骨缺损未完全愈合;第8周时,骨不连得到修复,骨皮质连续。见图4、5。


组别分支点数量(个)小管长度(mm)对照12.0±1.320.0±2.2USC-Exos 10753.3±2.2①46.0±4.3①USC-Exos 10878.0±4.3①②76.6±5.1①②
与对照组比较:①P<0.05;与USC-Exos 107组比较:②P<0.05
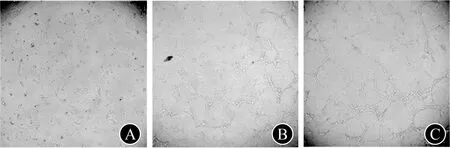
A 对照组 B USC-Exos 107组 C USC-Exos 108组图3 成管实验结果(×10)
USC-Exos-piGEL组在术后第4、8周时骨不连处的骨体积分数均显著大于空白组和piGEL组(P值均<0.05),空白组与piGEL组间骨体积分数的差异均无统计学意义(P值均>0.05)。见表3。
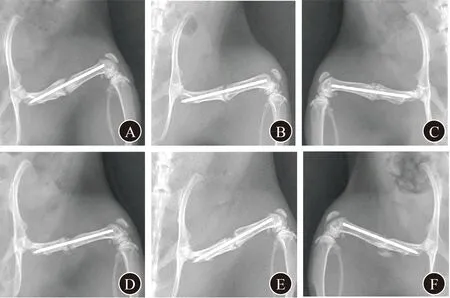
A 空白组术后第4周 B piGEL组术后第4周 C USC-Exos-piGEL组术后第4周 D 空白组术后第8周 E piGEL组术后第8周 F USC-Exos-piGEL组术后第8周图4 3组大鼠术后第4、8周股骨骨不连处X线片
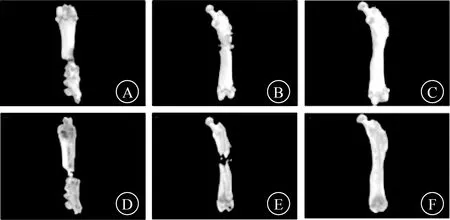
A 空白组术后第4周 B piGEL组术后第4周 C USC-Exos-piGEL组术后第4周 D 空白组术后第8周 E piGEL组术后第8周 F USC-Exos-piGEL组术后第8周图5 3组大鼠术后第4、8周股骨骨不连处micro-CT片


组别术后第4周术后第8周空白20.2±3.1①28.2±4.1①piGEL22.9±9.2①29.7±11.2①USC-Exos-piGEL61.2±3.483.4±4.2
与USC-Exos-piGEL组比较:①P<0.05
2.3.2 组织学检查结果 术后第8周H-E染色可见,空白组和piGEL组骨不连断端骨皮质不连续,以纤维愈合为主,断端间隙充满大量纤维组织,细胞以纤维细胞、炎性细胞、骨髓细胞为主,未见新生骨组织,符合骨不连的组织学特征;USC-Exos-piGEL组骨不连断端骨皮质连续,新生的骨组织细胞排列尚不整齐,与正常骨组织间有明显的分界,细胞以骨细胞为主,少见骨髓细胞。见图6。
2.3.3 组织切片免疫荧光检查结果 术后第8周组织切片的免疫组织荧光染色结果显示,有标志性抗原Ki67、CD31、CD34的血管内皮细胞呈红色。空白组和piGEL组的血管内皮细胞较少,荧光强度较弱,提示血管生成量较少;而USC-Exos-piGEL组的血管内皮细胞较多,分布较密,围成的闭合管样结构完整,提示血管生成量较多。见图7。

A、D 空白组 B、E piGEL组 C、F USC-Exos-piGEL组图6 3组术后第8周股骨样本的组织学检查结果(H-E染色)

A 空白组CD31 B piGEL组CD31 C USC-Exos-piGEL组CD31 D 空白组CD34 E piGEL组CD34 F USC-Exos-piGEL组CD34 G 空白组Ki67 H piGEL组Ki67 I USC-Exos-piGEL组Ki67图7 3组术后第8周免疫组织荧光检查显示骨不连周围血管再生情况(免疫荧光染色,×80)
3 讨 论
骨不连是创伤骨科领域较为常见且处理棘手的骨折后并发症之一。临床上针对骨不连的治疗有加强内固定、植骨、游离血管骨移植等[14-15],但仍有部分患者无法治愈。骨折后发生骨不连意味着损伤部位的成骨过程停止,骨不连周围的生物惰性环境是血管再生不足、促成骨因子不足和干细胞不足综合影响的结果[16-17]。
血管生成是骨折愈合的必要条件,血管生成的刺激可促进骨折愈合,也是软骨内成骨和膜内成骨最早发生的事件之一[18]。在术中,手术医师会注重保护患者骨损伤部位的骨膜和血供,以避免人为造成骨血供不良而影响愈合[16]。Lienau等[17]研究发现,绵羊骨不连模型在骨折愈合早期血管内皮生长因子mRNA表达水平下降,血管形成能力不佳。本研究也是基于骨不连周围血管再生不足的理论依据,提出Exos治疗骨不连的思路。本研究体外实验结果显示,细胞培养第4、5、6天,USC-Exos 107组和USC-Exos 108组HuVECs的A450值均显著高于对照组同时间,USC-Exos 108组HuVECs的A450值显著高于USC-Exos 107组同时间;USC-Exos 107组和USC-Exos 108组完成迁移的细胞数均显著多于对照组,USC-Exos 108组完成迁移的细胞数显著多于USC-Exos 107组;USC-Exos 107组和USC-Exos 108组的分支点均显著多于对照组,小管长度均显著长于对照组;USC-Exos 108组的分支点显著多于USC-Exos 107组,小管长度均显著长于USC-Exos 107组。表明USC-Exos能在体外促进HuVECs的增殖、迁移和成管能力,且其促进作用随USC-Exos密度增大而增强。本研究体外实验结果显示,USC-Exos-piGEL组术后第4周时骨不连未修复,有骨痂形成,但仍有骨皮质不连续,骨缺损未完全愈合,第8周时骨不连得到修复,骨皮质连续;USC-Exos-piGEL组骨不连断端骨皮质连续,新生的骨组织细胞排列尚不整齐,与正常骨组织间有明显的分界,细胞以骨细胞为主,少见骨髓细胞;USC-Exos-piGEL组的血管内皮细胞较多,分布较密,围成的闭合管样结构完整,提示血管生成量较多。表明USC-Exos在体内能促进骨不连愈合,且可增加骨不连周围的血管数量,骨不连愈合可能与其周围血管再生有关。
Exos自2013年因诺贝尔奖进入研究人员的视野以后,一直是研究的热点。参与细胞间通信的物质很多,其中细胞外囊泡是最为重要的物质之一,Exos和微泡为细胞外囊泡的主要类型[19]。Exos通过多泡体与质膜的融合而释放,直径为30~150 nm;微泡是从质膜脱落,直径为100~1 000 nm。细胞外囊泡通常被认为是细胞间通信的载体,且在细胞之间转移脂质、核酸(mRNA和微RNA)和蛋白质,从而在受体细胞中引发内容物的生物反应[20]。
已有研究证实Exos具有促血管生成作用。Arslan等[21]构建了小鼠心脏缺血-再灌注损伤模型,给予MSC-Exos治疗,结果表明,MSC-Exos可减少局部和全身炎性反应、氧化应激发生,改善心肌功能。Xin等[22]的研究团队构建了大鼠脑缺血梗死模型,静脉注射MSC-Exos可改善脑部功能(如促进供血、增加缺血区域轴突密度)恢复,增加神经突触重塑、神经发生和血管生成。Exos的功能因不同来源的干细胞而异,Exos移植可发挥与干细胞移植相类似的生物学功能。上述研究结果表明,USC-Exos具有促血管生成作用,进一步提示Exos治疗在组织工程中具有广阔的应用前景。
有研究[23]结果表明,Exos中发挥促血管生成作用的物质是微RNA。如微RNA-21激活蛋白激酶B(AKT)/细胞外调节蛋白激酶(ERK)途径,从而导致血管内皮生长因子(VEGF)过量产生;微RNA-1246通过抑制PML(SMAD 1/5/8途径的抑制剂)的表达参与血管生成;微RNA-23a家族与血管生成增加密切相关。本研究中USC-Exos是否也是通过其内含的微RNA来完成促进血管生成的作用,这些微RNA影响了哪些关键调节分子和通路,均需要更进一步的生物信息学研究。
综上所述,本研究采用超滤结合超速离心法获得USC-Exos,其形态呈类球形,有完整的膜结构,直径为90~160 nm,Exos悬液密度约为1.97×1010个/mL。USC-Exos能有效促进HuVECs细胞的增殖、迁移和成管能力,且其促进作用随USC-Exos密度增大而增强;USC-Exos能够促进大鼠股骨骨不连的愈合,其修复作用可能与促进骨不连周围血管再生有关,可为临床治疗骨不连提供新思路。

