羟基酪醇对脓毒症诱导的急性心肺损伤的保护作用及机制①
石恩朋 彭美玉
(德州市市立医院检验科,德州 253012)
脓毒症是由感染、大面积烧伤、外科大手术、严重创伤等因素引起的一种常见的并发症,是临床重症科室主要死亡因素之一[1]。脓毒症早期主要表现为系统性炎性反应,通过释放大量的炎症介质,进而诱发脓毒症休克和多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS),其中心血管和肺组织是最容易发生损伤的器官。
在脓毒症诱发MODS中肺组织是最先也是最容易被牵连的器官,进而诱发急性肺损伤(Acute lung injury,ALI)和急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)。与直接感染造成的ALI/ARDS相比,脓毒症造成的ALI/ARDS的恢复性更差,住院时间更长,死亡率更高[2]。脓毒症诱导的ALI/ARDS的主要特征表现为肺组织中性粒细胞的浸润增加、肺毛细血管通透性增加、肺泡上皮细胞被严重破坏、肺表面张力显著增加和肺泡塌陷等。脓毒症可导致肺组织分泌大量炎症因子[3]。参与肺组织炎症信号活化的通路的较多,脓毒症可以激活NF-κB和MAPK 3个亚家族(ERK、JNK和p38)信号通路促进炎症因子的分泌,导致ALI/ARDS[4]。在LPS诱导的小鼠脓毒症模型中,白藜芦醇可以激活沉默信息调节因子1(Silent information regulator 1,SIRT1),降低炎症因子的分泌,减轻ALI[5]。因此上调SIRT1的表达,抑制NF-κB信号通路的过度活化,从而降低肺泡灌洗液中TNF-α、 IL-1β 和IL-6等炎症因子的分泌,是改善脓毒症诱导的ALI有效方法。
临床大约50%以上的脓毒症患者伴有脓毒症心肌病,并且心脏功能受损可以使脓毒症患者的死亡率增加70%[6]。脓毒症诱导的心功能障碍主要表现在心脏收缩功能受损,如左室射血分数(Ejection fractions,EF)和短轴缩短率(Fractional shortening,FS)下降,左室收缩峰压/左室舒张末期压(Left ventricular systolic peak pressure/left ventric-ular end-diastolic pressure,LVPP/LVEDP)下降及左心室舒张末期容积(Left ventricular end-diastolic volume,LVEDV)增加等。同时研究表明脓毒症心肌细胞中TNF-α、 IL-1β和IL-6等炎症因子的分泌明显增加[7],最新研究表明,通过降低炎症因子的分泌,可以降低脓毒症诱导的心肌损伤,并延长脓毒症小鼠的生存时间[8]。
SIRT1基因敲除的小鼠,脓毒症诱导的心肌损伤明显加重[9]。因此激活SIRT1,抑制NF-κB信号通路的过度活化,从而降低心肌细胞中TNF-α、 IL-1β和IL-6等炎症因子的分泌,可能是改善脓毒症诱导的心肌功能障碍的有效方法。
羟基酪醇(Hydroxytyrosol,HYD)是橄榄油中的主要活性成分之一,研究表明,HYD具有广泛的抗动脉硬化、抗血栓、抗炎和抗氧化活性[10]。HYD可以降低LPS刺激巨噬细胞ROS、TNF-α 和IL-6的产生,抑制血管内皮细胞NF-κB 信号通路的活化[11,12],同时HYD可保护心脏缺血再灌注损伤[13]。最新研究表明HYD可以激活SIRT1,降低氧化应激引发的线粒体功能障碍,同时可以上调SIRT1表达,降低LPS诱导的肺组织炎性反应[14,15]。但是HYD是否可以通过调节SIRT1的表达降低脓毒症及脓毒症诱导的多器官损伤尚无相关报道。
本研究将利用盲肠结扎穿孔术(Cecal ligation and puncture,CLP)构建小鼠脓毒症模型,并探讨HYD对脓毒症小鼠心肌功能、肺组织损伤及小鼠生存率的影响,同时研究HYD对脓毒症小鼠心、肺组织中SIRT1的表达和NF-κB活化的影响,从而更加深入阐明HYD改善脓毒症心肌损伤和保护脓毒症急性肺损伤可能的分子生物学机制,为更多HYD的临床研究提供实验基础。
1 材料与方法
1.1材料
1.1.1试剂 Hydroxytyrosol(阿拉丁生化科技股份有限公司,上海);Trisol reagent(Invitrogen,美国);RT-PCR试剂盒(全式金生物技术有限公司,北京);Primers(生工生物技术有限公司,上海);BCA Protein Assay Kit(索莱宝,北京); Anti-phosphate-NF-κB、Anti-NF-κB、Anti-mouse IgG和Anti-rabbit IgG(Cell signaling,美国);Anti-SIRT1和Anti-GADPH(Abcam,美国);TNF-α、IL-1β、IL-6 ELISA 试剂盒(R&D,美国);MPO 检测试剂盒(建成生物工程研究所,南京)。
1.1.2实验动物 C57BL/6小鼠,雄性,20~25 g,6~8周龄大,SPF级,购于北京华阜康生物科技股份有限公司,饲养于医学院实验动物中心。
1.2方法
1.2.1实验分组 小鼠饲养1周后,按照随机分组原则分为3组,每组10只,即假手术组(Sham)、模型组(CLP)和治疗组(HYD+CLP)。禁食12 h后实施手术。
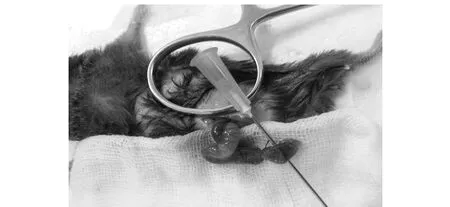
图1 CLP手术过程Fig.1 Surgical procedure of cecal ligation and puncture
1.2.2脓毒症模型的建立 根据有关脓毒症模型的文献报道[16-18],采用非常接近于临床的CLP建立脓毒症动物模型。小鼠腹腔注射10%水合氯醛,给药剂量为0.004 ml/g 麻醉小鼠,腹部脱毛,消毒,沿腹中线开2~4 cm的小口,分离盲肠,在距离盲肠末端大约0.5 cm处用外科4.0带针缝合线进行结扎,在结扎的中间位置使用21G注射器针头全层对穿肠管(为确保穿刺效果来回抽动2次),以轻挤可见少许粪便于穿刺处流出为标准以保证穿孔,将穿刺好的盲肠放回腹腔,关腹(如图1所示)。手术过程中保证:①手术全程要在5 min之内完成;②手术全程都要注意无菌操作,采用一次性耗材,避免因为操作原因的感染造成各组模型的差异;③手术分两个步骤结扎盲肠和穿孔,这两项应由同一人完成,从而尽量保证所有动物的一致性。Sham组小鼠,只是单纯的打开腹腔,将盲肠按照以上相同的方法取出,不对盲肠根部进行任何的结扎及穿刺,在空气中暴露与脓毒症小鼠手术相同的时间后,将肠管尽量保持原有的功能位置放回腹腔,然后用真丝编织线逐层缝合腹壁,最后消毒缝合切口。HYD+CLP组于造模后10 min灌胃给药1次(20 mg/kg)。Sham组和CLP组给予等量的生理盐水,各组均在造模后24 h测定大鼠的心脏功能,并取心脏和肺组织,于液氮中保存;另外,按如上操作重新建立三组CLP小鼠模型,24 h后进行肺泡灌洗,灌洗液-20℃保存。
1.2.3左心室心脏功能测定 各组造模24 h后,对小鼠进行超声心动检测,观察并记录各组左心室功能的变化情况。首先在小鼠心脏区域及周边约2 cm 范围内备皮。按照Visualsonic Vevo 2100超声系统的操作规范进行心功能检测。设置探头频率为25 MHz,探测深度为15~20 mm。探头置于小鼠的左胸,获取满意的左心室二维图像,在短轴水平取得二维图像后,在乳头肌水平将M型取样线垂直于室间隔与左心室后壁获得M型超声心动图,通过M型超声测定室后壁运动幅度和LVEF。连续采集8个心动周期的动态图像。储存图像后用VisualsonicSVevo770R专业软件进行分析,测量和计算后得出左心室EF和FS。
1.2.4肺组织病理学检查及评分 各组于造模24 h 后取材,麻醉小鼠,取右肺中叶,固定、包埋、切片,苏木精-伊红(HE)染色,观察各组小鼠肺组织病理学变化情况,并对每张片子随机选择10个视野进行拍照记录,然后依据美国胸科协会肺损伤的评分标准(表1),对每一个小鼠肺组织进行病理学评分。
1.2.5MPO活性测定 采用测定MPO活性的方式判定中性粒细胞聚集程度。按照MPO 检测试剂盒说明书操作。
1.2.6酶联免疫吸附法(ELISA)检测肺泡灌洗中炎症因子的分泌 各组小鼠造模24 h后,麻醉小鼠,消毒,分离小鼠颈部支气管,将20G的静脉留置针置入气管中固定。经静脉留置针将预冷的PBS轻轻注入肺中,每次灌洗0.8 ml,吸出后再次注入,反复2次后,抽出PBS置于无菌的EP管中,再灌洗1次,保证每次的回收率大于80%认定为合格,即注射0.8 ml的PBS可以回收0.7 ml。离心去除肺泡灌洗中的炎症细胞,离心转速为2 000 r/min,共离心 10 min,收集上清液并分装后冻存于-80℃冰箱中保存。按照ELISA试剂盒说明书操作检测TNF-α、IL-6 和IL-1β浓度。
表1 肺损伤病理评分标准
Tab.1 Lung injury pathology score criteria

ParameterGrade0 score1 score2 scoresNumber of neutrophils in the alveolar space(A)01-5>5Number of neutrophils in the interstitium of the lung(B)01-5>5Hyaline membranes(C)01>1Protein residue in the alveolar space(D)01>1Alveolar septum thickening(E)<2x2x-4x>4x
Note:Lung injury score=[(20×A)+(14×B)+(7×C)+(7×D)+(2×E)]/(Visual field number×100).
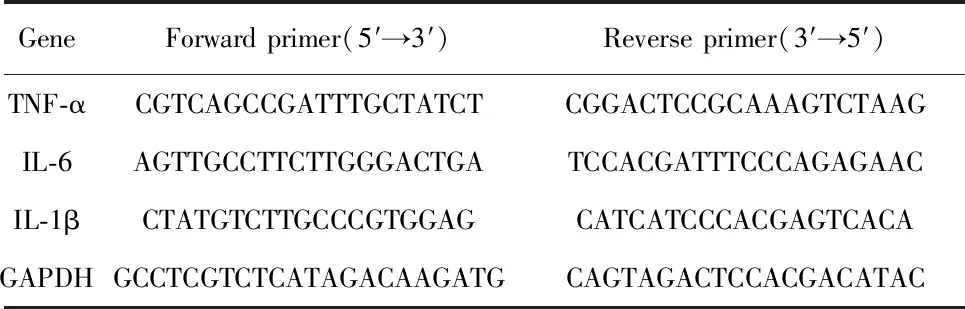
1.2.7Real-time RCR检测心脏组织炎症因子的表达 提取心脏组织RNA,反转录为cDNA。引物序列(表2)由上海生工生物工程有限公司合成。运用SYBR Green 荧光染料法,数据分析根据公式2-ΔΔCT法计算各组与假手术组之间目的基因相对表达含量的变化;GAPDH作为内参,每个样品3个复孔。
1.2.8Western blot检测 取约30 mg心脏和肺组织,加入0.5 ml的RIPA裂解液,用组织研磨器研磨均匀,将研磨液转移到1.5 ml的无菌的EP管中冰上静止30 min,中间用振荡器每隔5 min振荡1次,每次30 s,然后4℃、12 000 g离心15 min,吸取上清,将其转移到新的1.5 ml EP管中;按照说明书进行蛋白定量。Western blot检测分别加入一抗Anti-phosphate-NF-κB、Anti-NF-κB、Anti-SIRT1和Anti-GADPH,二抗Anti-mouse IgG和Anti-rabbit IgG。
1.2.9小鼠生存率观察 假手术组(Sham)、模型组(CLP)和治疗组(HYD+CLP)各10只小鼠,所有小鼠术后自由进食及饮水,每天观察记录小鼠活动情况和精神状态,观察7 d内各组小鼠的生存情况,统计分析各组小鼠的生存率差异,绘制死亡率百分率(%)表和生存曲线。
1.3统计学处理 实验结果采用SPSS17.0统计软件分析,组间的差异用单因素方差分析,多组间比较采用 One-Way ANOVA 完全随机设计资料的方差分析。应用生存分析中的小样本 Kaplan-Meier 方法(log-rank 检验)分析各小组间死亡率以及各组间平均生存时间差异,并绘制生存曲线,平均生存时间组间比较采用秩和检验,P<0.05表示差异有统计学意义。
表2 Real-time PCR引物序列
Tab.2 Real-time PCR primer sequence
GeneForward primer(5′→3′)Reverse primer(3′→5′)TNF-αCGTCAGCCGATTTGCTATCTCGGACTCCGCAAAGTCTAAGIL-6AGTTGCCTTCTTGGGACTGATCCACGATTTCCCAGAGAACIL-1βCTATGTCTTGCCCGTGGAGCATCATCCCACGAGTCACAGAPDHGCCTCGTCTCATAGACAAGATGCAGTAGACTCCACGACATAC
2 结果
2.1羟基酪醇对脓毒症诱导的小鼠心脏功能的影响 首先取得胸骨旁左心室短轴 M 型超声心动图(图 2A),与Sham组相比,CLP组LVEDV显著增加,HYD+CLP组LVEDV较CLP组明显降低。然后应用专业数据软件进行处理和分析计算EF和FS值;每组数据取连续3个心动周期的平均值。如图2B和2C所示,造模24 h后,CLP组小鼠的EF与FS值较Sham组显著降低(P<0.01),而HYD+CLP组EF和FS的值较CLP组明显升高(P<0.05)。
2.2羟基酪醇对脓毒症诱导的小鼠心脏炎症因子表达的影响 造模24 h后,取心脏组织,提取RNA,Real-time PCR法检测IL-6、IL-1β和TNF-α的各组的表达差异,如图3所示,造模24 h后,与Sham组相比,CLP组小鼠心脏炎症因子(TNF-α:1.00±0.01 vs 3.50±0.04;IL-6:1.00±0.09 vs 4.69±0.21;IL-1β:1.00±0.11 vs 3.16±0.22)的表达显著升高,P<0.01;而HYD治疗后,与CLP组相比,HYD+CLP组炎症因子的表达明显下降(TNF-α:3.50±0.04 vs 2.81±0.06; IL-6:4.69±0.21 vs 3.19±0.19;IL-1β:3.16±0.22 vs 2.01±0.15),P<0.01。
2.3羟基酪醇对脓毒症诱导的小鼠肺组织病理学改变的影响 造模24 h后,取肺组织,HE染色,光镜下观察肺组织病理学改变,如图4A所示,Sham组小鼠肺组织较完好,肺间隔无增宽,无水肿液,肺泡腔中偶见少量的巨噬细胞,未见中性粒细胞浸润。
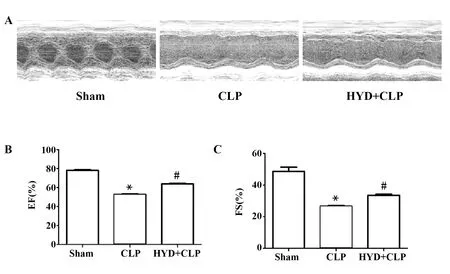
图2 羟基酪醇对脓毒症诱导的小鼠心脏功能的影响Fig.2 Effect of hydroxytyrosol to sepsis-induced cardi-ovascular dysfunction on mouseNote: HYD+CLP vs Sham group,*.P<0.01;HYD+CLP vs CLP group,#.P<0.01.
CLP组,小鼠肺组织结构破坏明显,肺间质和肺泡腔中有大量的中性粒细胞浸润,肺间隔明显增宽,偶见少量的蛋白质残留物。HYD+CLP组,小鼠肺组织结构破坏减轻,肺间隔无明显增宽,肺泡腔和肺间质内中性粒细胞渗出减少,同时对肺组织病理损伤进行评分,如图4B所示,CLP组与Sham组相比,评分显著升高(2.50±0.51 vs 9.50±0.94),P<0.01,而HYD治疗后,与CLP组相比,HYD+CLP组病理评分明显降低(9.50±0.94 vs 4.33±0.47),P<0.01。
2.4羟基酪醇对脓毒症诱导的小鼠肺泡灌洗液炎症因子及肺组织中性粒细胞浸润的影响 研究表明失控的炎性反应也是诱导急性肺损伤的主要原因之一,检查肺泡灌洗液中炎症因子的分泌,如图5A~C所示:与Sham组相比,CLP组肺泡灌洗液中炎症因子[TNF-α:(12.02±2.46)pg/ml vs (57.53±14.78) pg/ml;IL-6:(9.65±1.09)pg/ml vs (36.88±1.80) pg/ml;IL-1β:(33.07±2.99)pg/ml vs (63.16±4.2)pg/ml,P<0.01]分泌明显增加;而HYD治疗后,与CLP组相比,HYD+CLP组炎症因子的分泌明显降低[TNF-α:(57.53±14.78)pg/ml vs (32.91±6.85) pg/ml; IL-6:(36.88±1.80)pg/ml vs (17.75±2.32) pg/ml;IL-1β:(63.16±4.20)pg/ml vs (40.16±2.62) pg/ml,P<0.01]。中性粒细胞大量浸润是造成肺组织损伤的另一主要原因,MPO是中性粒细胞的特异性标志物,检测肺组织MPO活性间接反应中性粒细胞的反映情况,如图5D所示,CLP组MPO活性[(0.22±0.06)U/g vs (0.58±0.04)U/g,P<0.01]显著升高。而HYD治疗后,与CLP组相比,HYD+CLP组MPO活性[(0.58±0.04)U/g vs (0.32±0.01)U/g,P<0.01]显著降低。
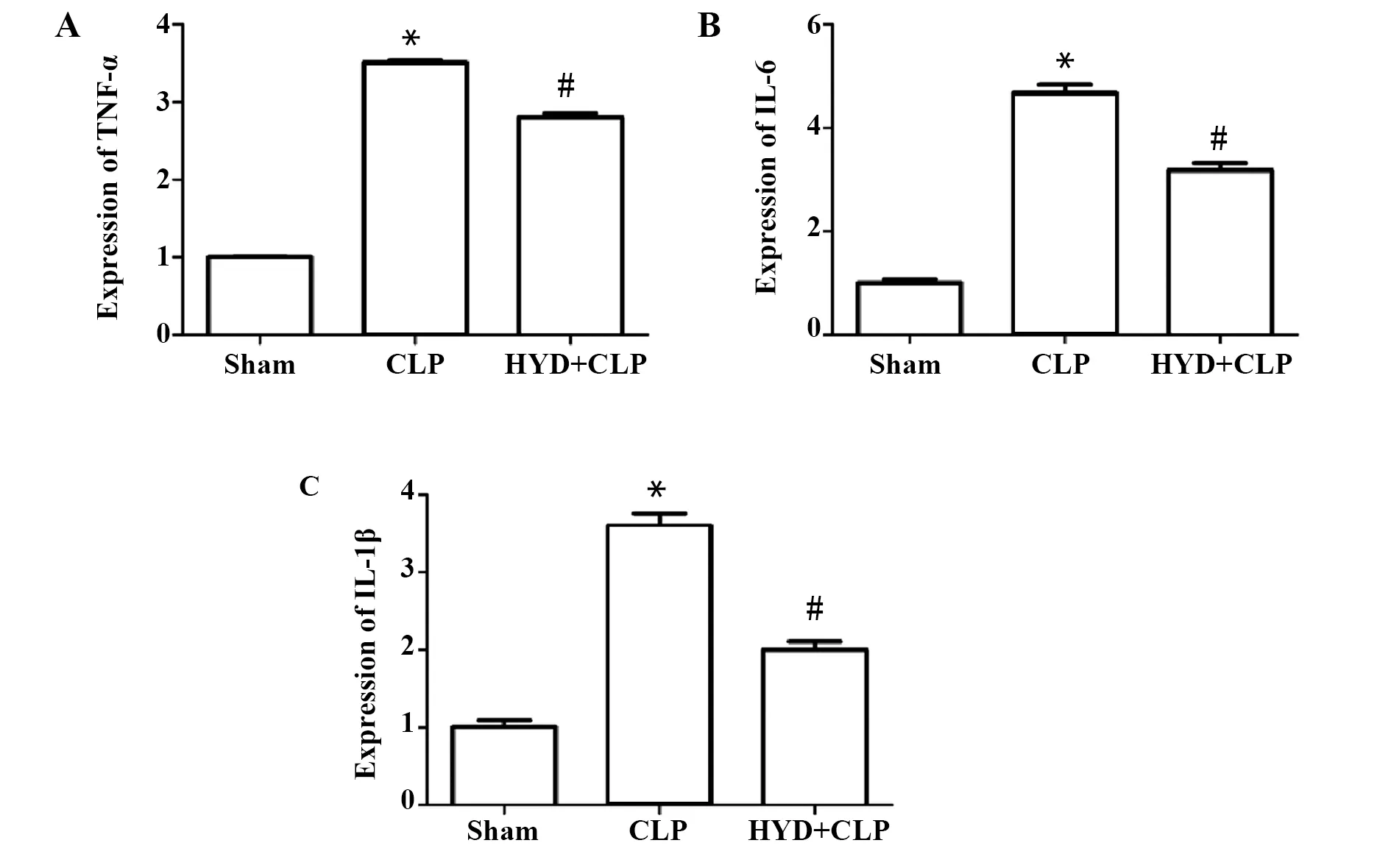
图3 羟基酪醇对脓毒症诱导的小鼠心脏炎症因子表达的影响Fig.3 Effect of hydroxytyrosol to levels of inflammatory cytokine in sepsis-induced mouse myocardium tissueNote: HYD+CLP vs Sham group,*.P<0.01;HYD+CLP vs CLP group,#.P<0.01.
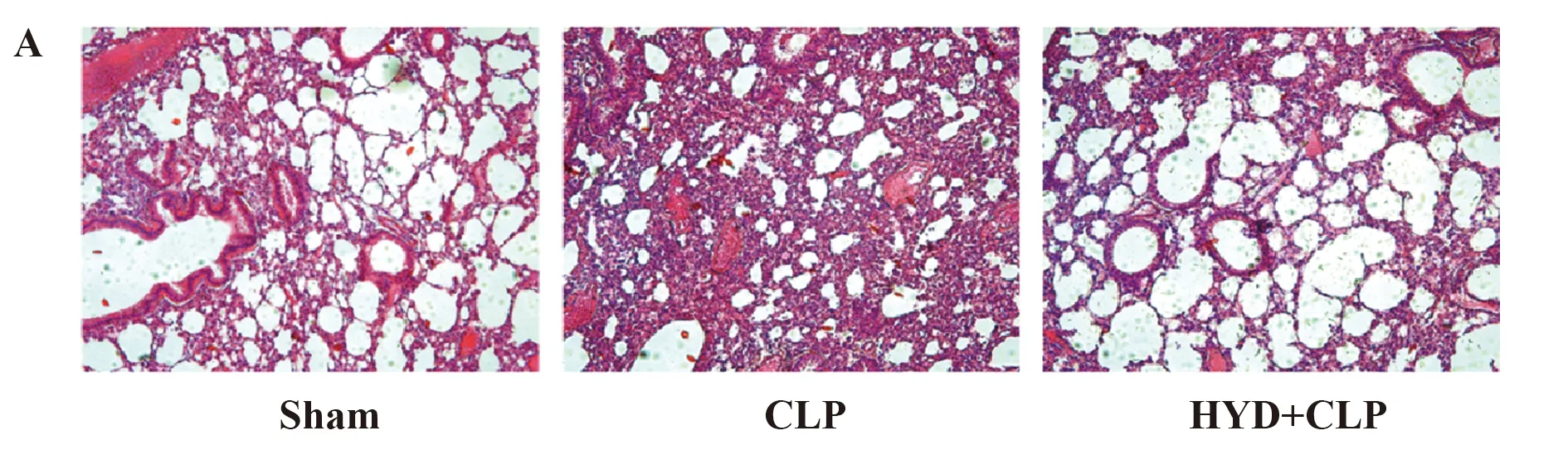
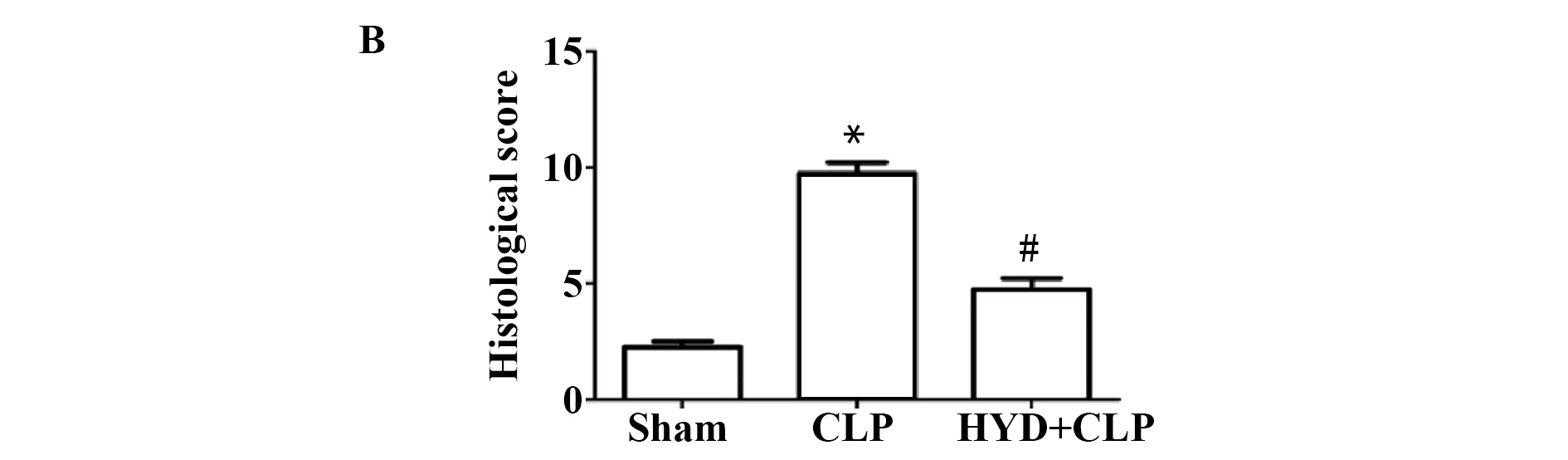
图4 羟基酪醇对脓毒症诱导的小鼠肺组织病理学改变的影响
Fig.4 Effect of hydroxytyrosol to pulmonary histopatho-logical changes in sepsis-induced mouse myocar-dium tissue
Note: HYD+CLP vs Sham group,*.P<0.01;HYD+CLP vs CLP group,#.P<0.01.
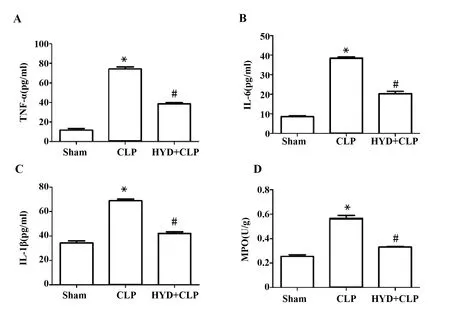
图5 羟基酪醇对脓毒症诱导的小鼠肺泡灌洗液炎症因子及肺组织中性粒细胞浸润的影响Fig.5 Effect of hydroxytyrosol to levels of inflammatory cytokine in bronchoalveolar lavage fluid and neutrophil/leukocyte infiltration in sepsis-induced mouse myocardium tissueNote: HYD+CLP vs Sham group,*.P<0.01;HYD+CLP vs CLP group,#.P<0.01.
2.5羟基酪醇对心脏和肺组织炎症信号通路的活化的影响 应用Western blot技术检测羟基酪醇对心脏组织和肺组织中SIRT1的表达和NF-κB活性的影响。与Sham组相比,CLP小鼠SIRT1表达在心脏(图6A~C),和肺组织(图6D~F)都显著降低,而p65磷酸化水平显著增强,而HYD治疗可以上调SIRT1的表达,抑制p65磷酸化。
2.6羟基酪醇对脓毒症小鼠生存率的影响 CLP脓毒症模型可以造成小鼠死亡,能否延长小鼠的生存时间是检测药物疗效的重要指标,因此我们观察HYD对脓毒症小鼠7 d生存率的影响。各组实验小鼠 CLP 术后麻醉全部苏醒,12 h各组小鼠活动、进食等情况无明显差异,24 h后,部分小鼠出现竖毛、活动减少和饮食减少等行为改变。CLP组48 h后开始有部分小鼠出现严重的全身重症感染迹象导致死亡。记录各组每天的死亡情况并绘制生存曲线,如图7所示,CLP组7 d的生存率只有20%,而HYD+CLP组7 d生存率在50%以上(P<0.01)。
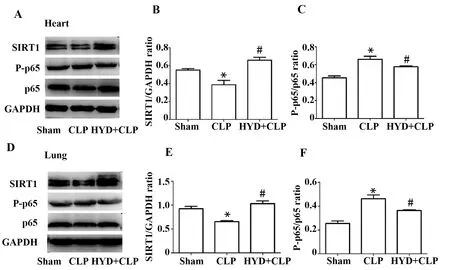
图6 羟基酪醇对心脏和肺组织炎症信号通路活化的影响Fig.6 Effect of hydroxytyrosol to activation of inflammatory signaling pathway in myocardium and pulmonary tissueNote: HYD+CLP vs Sham group,*.P<0.01;HYD+CLP vs CLP group,#.P<0.01.
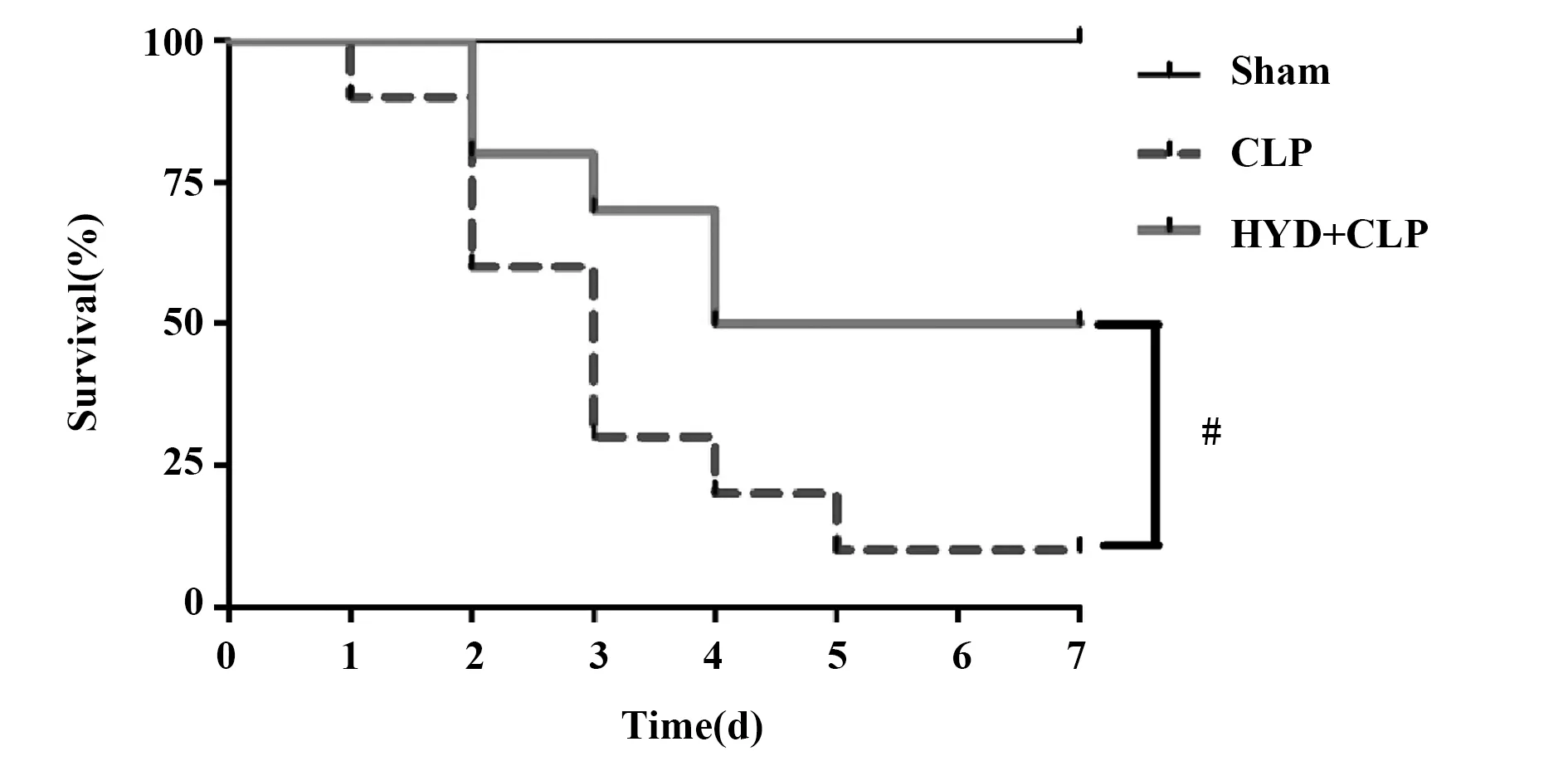
图7 小鼠7 d生存曲线图Fig.7 7-days survival rate curve of mouseNote: HYD+CLP vs CLP group,#.P<0.01.
3 讨论
失控的炎性反应是脓毒症的本质特征,脓毒症患者多伴有可疑感染或感染,适度调控早期炎性反应成为脓毒症防治的有效措施。据有关报道称大约40%的因为脓毒症而导致休克的患者存在心脏功能改变,主要体现在心室收缩功能障碍。尤其是在休克发生2~3 d后,其存在心脏功能障碍的患者可增至60%。并且,心脏功能障碍也是评估脓毒症患者预后不良的重要指标之一[6]。本研究发现HYD明显抑制脓毒症诱导的LVEDV的增加和EF与FS值的降低,提示HYD可减轻脓毒症诱导的心脏功能障碍。目前,脓毒症诱导的心脏功能障碍的机制尚不明确,过度的炎性反应是其主要原因之一。体外TNF-α、IL-6 和IL-1β可导致心肌细胞收缩力明显下降[19]。脓毒症患者应用TNF-α 中和抗体治疗可以显著改善左心室心功能[20]。本研究结果显示HYD可显著降低心脏组织中炎症因子的表达,这可能是其改善左心室心脏功能的原因之一。SIRT1分子是调控脓毒症炎性反应的关键信号分子,在脓毒症早期SIRT1分子表达量降低,导致过度炎性反应,脓毒症后期,SIRT1分子表达显著升高,从而导致免疫抑制[21]。SIRT1分子调节NF-κB的活化,激活SIRT1可抑制NF-κB的活化[22],我们研究发现HYD可以显著上调心肌组织中SIRT1的表达,同时抑制NF-κB的活化。因此本研究结果可表明HYD可通过上调心肌组织中SIRT1的表达和抑制NF-κB的活化而降低炎症因子的产生,从而改善左心室心脏功能。
与脓毒症诱导的心肌功能障碍相比,脓毒症诱导的ALI发病率更高。引起ALI的原因多样,其中脓毒症被认为是造成ALI进展的最主要高风险因素[23]。在脓毒症患者中,急性肺损伤、急性呼吸窘迫综合征等都是常见的并发症。而脓毒症造成肺损伤的主要原因就是感染所致的炎症,中性粒细胞、肺泡巨噬细胞、肺泡上皮细胞、淋巴细胞等均会参与到炎症的发展中去,尤其是中性粒细胞和巨噬细胞。研究报道,HYD可以上调SIRT1表达减轻LPS引起的ALI[24],我们的结果显示HYD治疗后,脓毒症小鼠肺组织损伤程度显著减轻,同时中性粒细胞肺组织浸润减少。脓毒症可激活肺组织中NF-κB信号通路而促进炎症因子TNF-α、IL-6 和IL-1β等的分泌,这是造成急性肺损伤的主要原因[25]。我们的结果显示,HYD可显著降低炎症因子TNF-α、IL-6 和IL-1β的分泌,同时HYD可上调肺组织SIRT1表达和抑制NF-κB的活化。因此我们的结果可表明HYD通过上调肺组织中SIRT1的表达和抑制NF-κB的活化而减少 TNF-α、IL-6 和IL-1β的分泌,从而保护脓毒症诱导的急性肺损伤。
CLP脓毒症模型可以造成小鼠死亡,能否延长小鼠的生存时间是检测药物疗效的重要指标,我们的结果表明HYD治疗可显著降低CLP小鼠的死亡率。
总之,我们的研究发现HYD可通过上调SIRT1的表达和抑制NF-κB炎症信号通路的活化而抑制炎症因子的表达和分泌,从而减轻脓毒症诱导的急性心肌损伤和肺损伤,并降低小鼠的死亡率。但是其更加深入的作用机制尚需进一步的研究和探索。HYD作为天然的抗炎药物在防止或减轻过度炎性反应造成的机体机能紊乱和器官功能损伤方面效果显著,应用前景广阔。

