长链非编码RNA CCAT1通过促进上皮间充质转化对口腔鳞状细胞癌细胞侵袭和迁移能力的影响①
陈 敏 张 楠 周 政
(石河子大学医学院第一附属医院口腔科,石河子 832008)
口腔鳞状细胞癌(Oral squamous cell carcinoma,OSCC)是发生于口腔鳞状上皮细胞覆盖及其毗邻部位的一种恶性肿瘤[1]。它是口腔癌的主要类型,约占口腔癌总发病率的90%,也是在印度发病率最高的癌症[2,3]。调查表明,烟草、酒精、槟榔和人乳头瘤病毒等是引起OSCC的重要因素[4]。早期OSCC患者多进行手术切除治疗预后良好,晚期OSCC患者经手术、放疗化疗综合治疗后仍预后不良,5年生存率约为50%[5]。近年来OSCC的发病率逐年上升[1],成为医学研究的热点。了解OSCC的发病机理是寻找其有效治疗方法的重要前提。大量研究表明,非编码RNA异常表达是癌症发生发展的潜在标志[6-8]。据报道,长链非编码RNA结肠癌相关转录因子1(Colon cancer associated transcript 1,CCAT1)在OSCC组织中过度表达并预示预后不良[3]。CCAT1是一种促癌因子,在多种癌症中过度表达[9-13]。同时,CCAT1可通过诱导肺腺癌细胞上皮间充质转化促进肺腺癌的转移[13]。在OSCC中,上皮间充质转化机制被过度激活[14],但目前关于CCAT1对OSCC细胞上皮间充质转化及细胞侵袭、迁移的影响还没有被进一步研究。本文通过检测CCAT1在癌旁组织、癌组织及各OSCC细胞系的表达,进而通过沉默CCAT1,探究其对上皮间充质转化及细胞侵袭、迁移的影响,进一步明确CCAT1在OSCC的作用机理,为寻找治疗OSCC的有效方法提供新的思路。
1 材料与方法
1.1材料
1.1.1实验试剂 Trizol、总RNA抽提试剂盒购自美国Invitrogen公司。反转录试剂盒、实时定量PCR试剂盒、脂质体2000转染试剂盒来自美国ThermoFisher公司。所用引物及RNA购自北京六合华大基因公司。RPMI1640培养液及胎牛血清(FBS)购自美国Gibco公司。青霉素-链霉素溶液(×100)、CCK8试剂盒、Hoechst染色试剂盒、RIPA裂解液、BCA试剂盒购自上海碧云天生物技术研究所。增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)、基质金属蛋白酶-2(Matrix metalloproteinase-2,MMP-2)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)和T细胞因子4(T cell factor 4,TCF-4)抗体购自美国Santa Cruz公司。钙依赖性黏附蛋白E(Calcium-dependent adhesion protein E,E-cadherin)和钙依赖性黏附蛋白N(N-cadherin)抗体购自美国R&D Systems公司。Snail、β-连环素(β-catenin)和细胞周期蛋白D1(Cyclin-D1)抗体购自美国Abcam公司。3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体及所有二抗购自北京中杉金桥生物技术有限公司。
1.1.2组织及细胞 正常口腔黏膜组织由天津医科大学口腔医院提供,OSCC组织由天津医科大学肿瘤医院检测确认并提供。OSCC细胞系SCC-4、SCC-9、SCC-25和Tca83购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。
1.2方法
1.2.1细胞培养 条件为37℃、5% CO2,细胞培养液为含有1%青霉素-链霉素溶液和10%胎牛血清的RPMI1640培养液。细胞传代条件为细胞融合率≥85%,传代浓度为1×104个/ml。
1.2.2分组及转染 将细胞分为空白对照(Control)、shRNA 对照(sh-scramble)和sh-CCAT1组。细胞以0.1×106个/ml的浓度接种于6孔板中。24 h后,转染细胞。转染步骤参考转染试剂盒说明书,转染6 h后换液并继续培养,用于后续实验检测。
1.2.3RT-PCR检测CCAT1的mRNA水平 于通风橱中抽提各检测样品总RNA,抽提步骤参考总RNA提取试剂盒说明书。将抽提所得的各样品总RNA定量分析后,取等量RNA反转录为cDNA,反转录步骤参考反转录试剂盒说明书。PCR仪将cDNA扩增后,利用SYBR green实时定量PCR试剂盒对各样品进行定量分析。CCAT1上游引物序列:5′-AGGGAGTGTC-TAGTTGCAGG-3′,下游引物序列:5′-CACCAGGGAC-CAGTTTTGTG-3′。
1.2.4CCK8检测SCC9细胞增殖情况 首先将1.2.2中各组细胞培养0、1、2、3、4 d,然后根据CCK8试剂盒说明书,每孔分别加入10 μl CCK8溶液,37℃孵育3 h。于450 nm处检测各组细胞吸光度,计算细胞增殖生长倍数。
1.2.5Hoechst染色检测SCC9细胞凋亡情况 首先将1.2.2中各组细胞进行固定,然后利用Hoechst染色试剂盒进行染色,最后利用荧光显微镜进行检测。在激发波长350 nm,发射波长460 nm的条件下,可检测到呈蓝色的细胞核,染色步骤参考Hoechst染色试剂盒说明书。
1.2.6划痕实验检测SCC9细胞迁移能力 实验之前先将6孔细胞培养板背面画横线,每孔至少有5条横线且穿过板孔,各横线间隔0.8 cm左右,横线需均匀而笔直。然后在板中培养SCC9细胞,并按1.2.2中分组方法转染细胞。待细胞铺满板孔后,用100 μl中号枪头尽量垂直于其背面横线进行划痕。划痕后用PBS洗涤板孔,加入无血清培养基进行培养。取0和24 h拍照,计算划痕闭合率。划痕闭合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.7Transwell实验检测SCC9细胞侵袭能力 实验之前先将Matrigel放于4℃融化,融化后取少量Matrigel到Transwell小室中进行预包被。将1.2.2中各组细胞接种于上室并用无血清细胞培养液进行培养,24 h后,用棉签拭去滤膜上层未转移细胞,HE染色液对下层转移细胞进行染色并计数。
1.2.8免疫印迹检测蛋白表达 首先用RIPA裂解1.2.2中各组细胞提取细胞蛋白,然后用BCA试剂盒对蛋白浓度定量并调平蛋白浓度。取30 μg蛋白进行实验,用10% SDS-PAGE将蛋白分离,半干转膜法将蛋白转移到PVDF膜上,5%的脱脂奶粉室温封闭2 h,一抗4℃孵育过夜,二抗37℃孵育1 h,最后曝光显色并以β-actin为内参。
1.3统计学分析 实验数据用SPSS17.0统计软件进行分析,首先对数据进行正态分布分析和方差齐性分析,符合正态分布且方差齐的数据用单因素方差分析或t检验,不符合条件的数据用秩和检验。
2 结果
2.1CCAT1在正常口腔黏膜组织和口腔鳞状细胞癌组织中的mRNA水平 与正常口腔黏膜组织比较,口腔鳞状细胞癌组织中CCAT1的mRNA水平显著升高(P<0.001,图1)。提示CCAT1上调可能与口腔鳞状细胞癌有关。
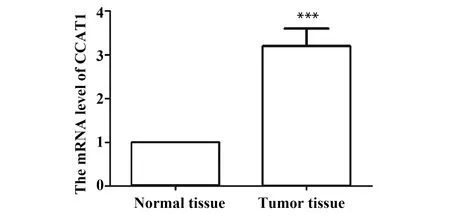
图1 RT-PCR检测正常口腔黏膜组织与口腔鳞状细胞癌组织中CCAT1的mRNA水平Fig.1 mRNA level of CCAT1 in normal tissue and oral squamous cell carcinoma tissue were evaluated by RT-PCRNote: n=20,***.P<0.001 vs normal tissue.
2.2CCAT1在口腔角质细胞系和口腔鳞状上皮细胞癌细胞系中的mRNA水平 与正常口腔角质细胞系hNOK比较,口腔鳞状上皮细胞癌细胞系SCC-4、SCC-9、SCC-25和Tca83中CCAT1的mRNA水平显著升高(P<0.001,图2),本文中选用SCC-9进行后续实验。实验结果提示CCAT1上调可能与口腔鳞状细胞癌有关。
2.3sh-CCAT1降低SCC-9细胞中CCAT1的mRNA水平 与Control组比较,sh-scramble组细胞中CCAT1的mRNA水平无显著差异,sh-CCAT1组中CCAT1的mRNA水平显著降低(P<0.001,图3)。实验结果表明,sh-CCAT1可显著下调CCAT1。
2.4sh-CCAT1降低SCC-9细胞增殖速率 与Control组比较,sh-scramble组细胞增殖速率无显著差异,sh-CCAT1组细胞增殖速率显著下降(P<0.001,图4)。此外,与Control组比较,sh-scramble组中细胞增殖相关蛋白PCNA的表达无显著差异,sh-CCAT1组中PCNA的表达显著下降(P<0.001,图5)。实验结果表明,sh-CCAT1可阻碍SCC-9细胞的增殖。提示CCAT1有利于SCC-9细胞的增殖。

图2 RT-PCR检测hNOK、SCC-4、SCC-9、SCC-25和Tca83细胞系中CCAT1的mRNA水平Fig.2 mRNA level of CCAT1 in hNOK,SCC-4,SCC-9,SCC-25 and Tca83 cell lines were evaluated by RT-PCRNote: n=6,***.P<0.001 vs hNOK cell line.
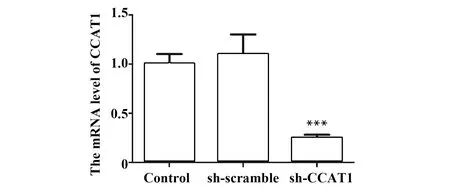
图3 RT-PCR检测sh-CCAT1对CCAT1 mRNA水平的影响Fig.3 Effect of sh-CCAT1 on mRNA level of CCAT1 were evaluated by RT-PCRNote: n=6,***.P<0.001 vs control group.
2.5sh-CCAT1提高SCC-9凋亡细胞百分比 与Control组比较,sh-scramble组的凋亡细胞百分比无
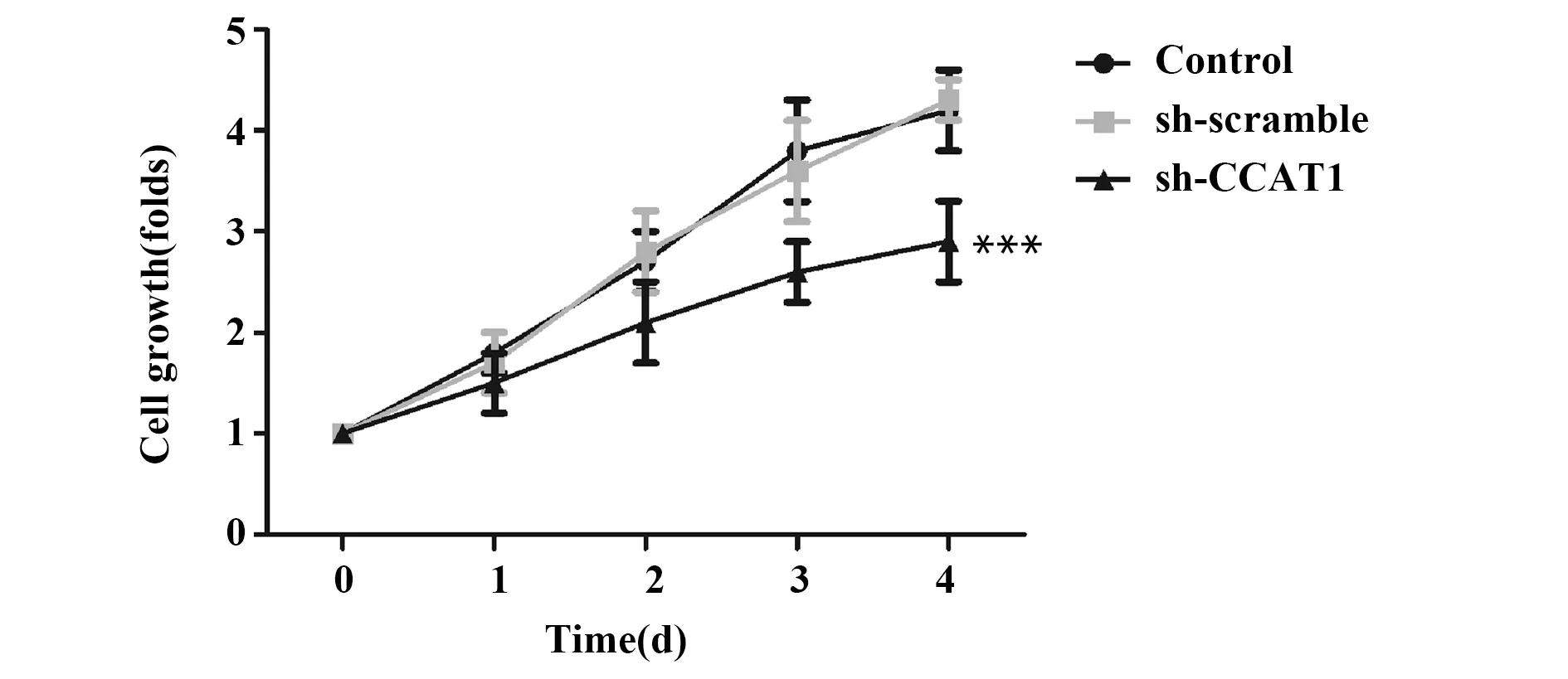
图4 CCK8试剂盒检测sh-CCAT1对SCC-9细胞增殖的影响Fig.4 Effect of sh-CCAT1 on proliferation in SCC-9 cells were evaluated by CCK8Note: n=6,***.P<0.001 vs control group.

图5 免疫印迹检测sh-CCAT1对SCC-9细胞表达PCNA、MMP-2和VEGF的影响Fig.5 Effect of sh-CCAT1 on expressions of PCNA,MMP-2 and VEGF in SCC-9 cells were evaluated by immunoblottingNote: n=6,***.P<0.001 vs control group.
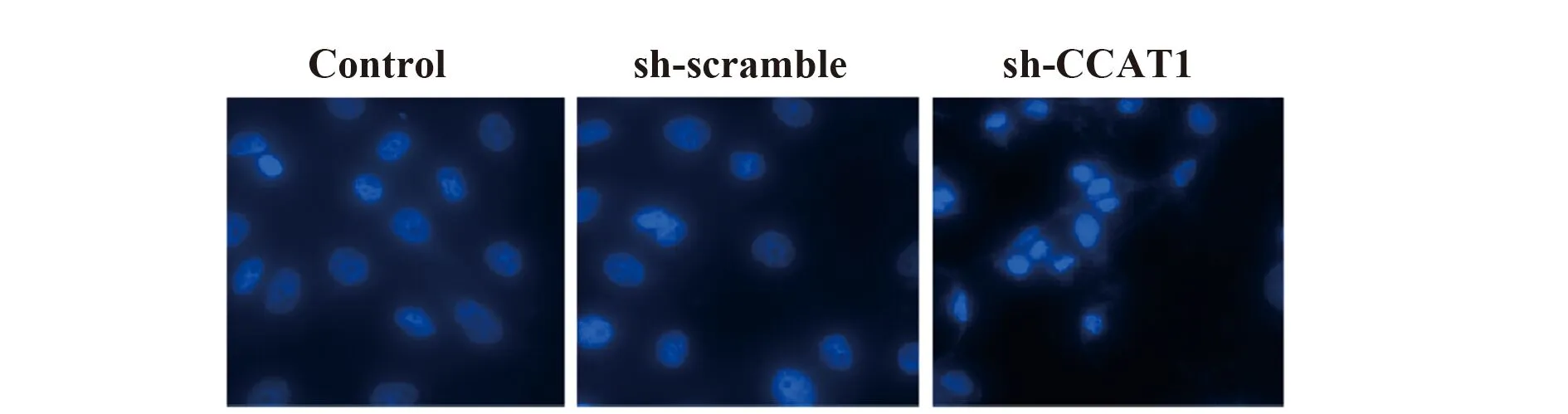
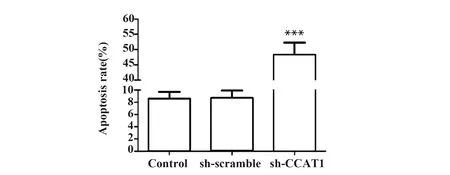
图6 Hoechst染色法检测sh-CCAT1对SCC-9细胞凋亡的影响(×400)
Fig.6 Effect of sh-CCAT1 on apoptosis in SCC-9 cells were evaluated by Hoechst staining(×400)
Note:n=6,***.P<0.001 vs control group.
显著差异,sh-CCAT1组的凋亡细胞百分比显著提高(P<0.001,图6)。实验结果表明,sh-CCAT1可促进SCC-9细胞凋亡。提示CCAT1可抑制SCC-9细胞凋亡。
2.6sh-CCAT1降低SCC-9细胞划痕闭合率 与Control组比较,sh-scramble组的细胞划痕闭合率无显著差异,sh-CCAT1组的细胞划痕闭合率显著下降(P<0.001,图7)。实验结果表明,sh-CCAT1可降低SCC-9细胞的迁移能力。提示CCAT1可提高SCC-9细胞的迁移能力。
2.7sh-CCAT1减少SCC-9侵袭细胞数 与Control组比较,sh-scramble组侵袭细胞数无显著差异,sh-CCAT1组侵袭细胞数显著减少(P<0.001,图8)。此外,与Control组比较,sh-scramble组中侵袭迁移相关蛋白MMP-2和VEGF[19,20]的表达无显著差异,sh-CCAT1组中MMP-2和VEGF的表达显著下降(P<0.001,图5)。实验结果表明,sh-CCAT1可降低SCC-9细胞的侵袭能力。提示CCAT1可提高SCC-9细胞的侵袭能力。
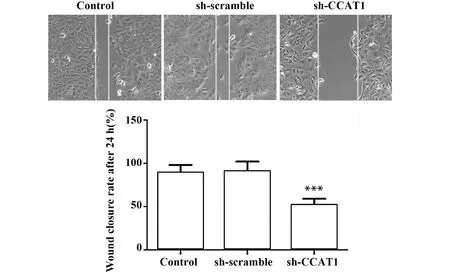
图7 划痕实验检测sh-CCAT1对SCC-9细胞迁移的影响(×200)Fig.7 Effect of sh-CCAT1 on migration in SCC-9 cells were evaluated by wound healing assay(×200)Note: n=6,***.P<0.001 vs control group.
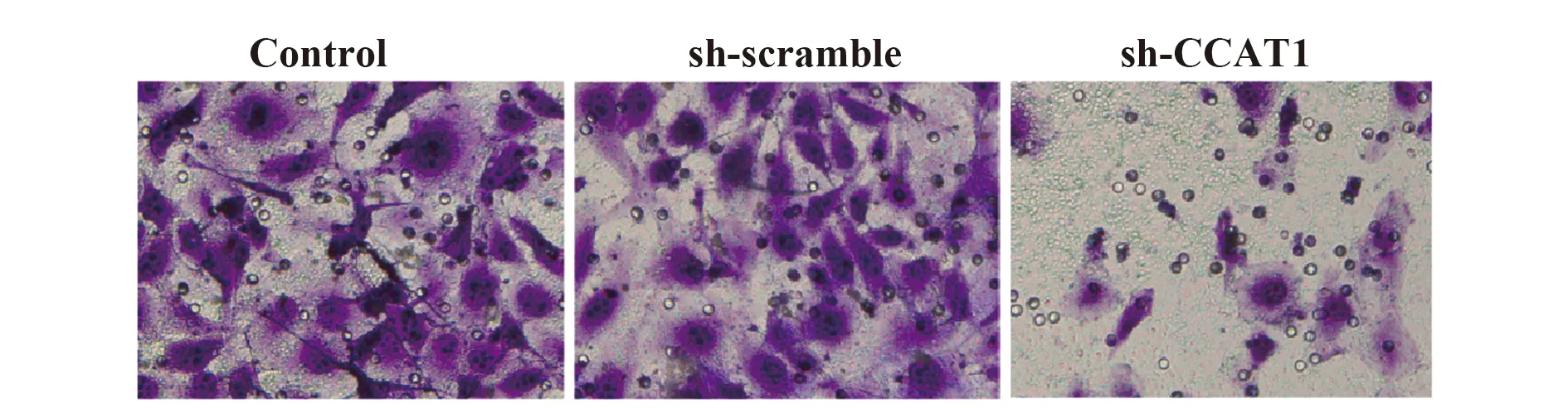
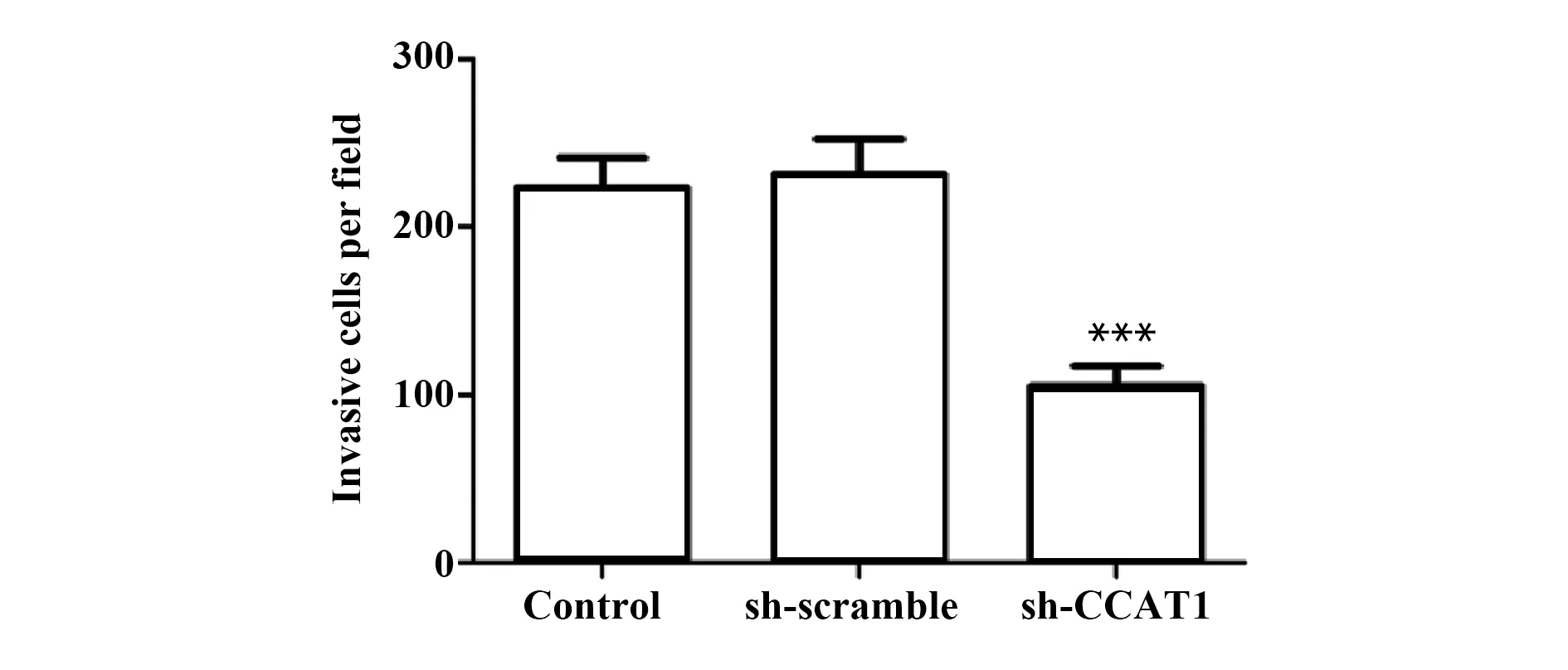
图8 侵袭实验检测sh-CCAT1对SCC-9细胞侵袭的影响(×400)
Fig.8 Effect of sh-CCAT1 on invasion in SCC-9 cells were evaluated by Transwell assay(×400)
Note:n=6,***.P<0.001 vs control group.
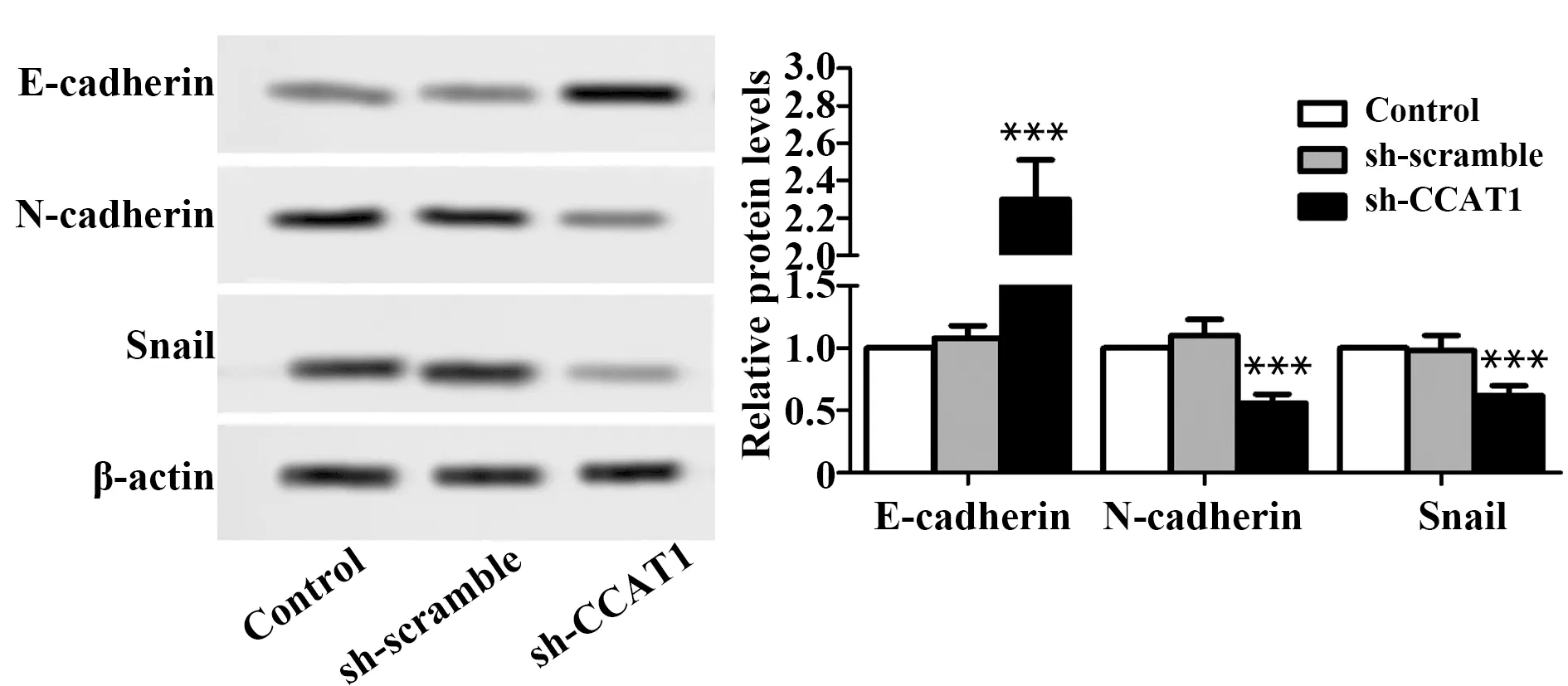
图9 免疫印迹检测sh-CCAT1对SCC-9细胞表达E-cadherin、N-cadherin和Snail的影响Fig.9 Effect of sh-CCAT1 on expressions of E-cadherin,N-cadherin and Snail in SCC-9 cells were evaluated by immunoblottingNote: n=6,***.P<0.001 vs control group.
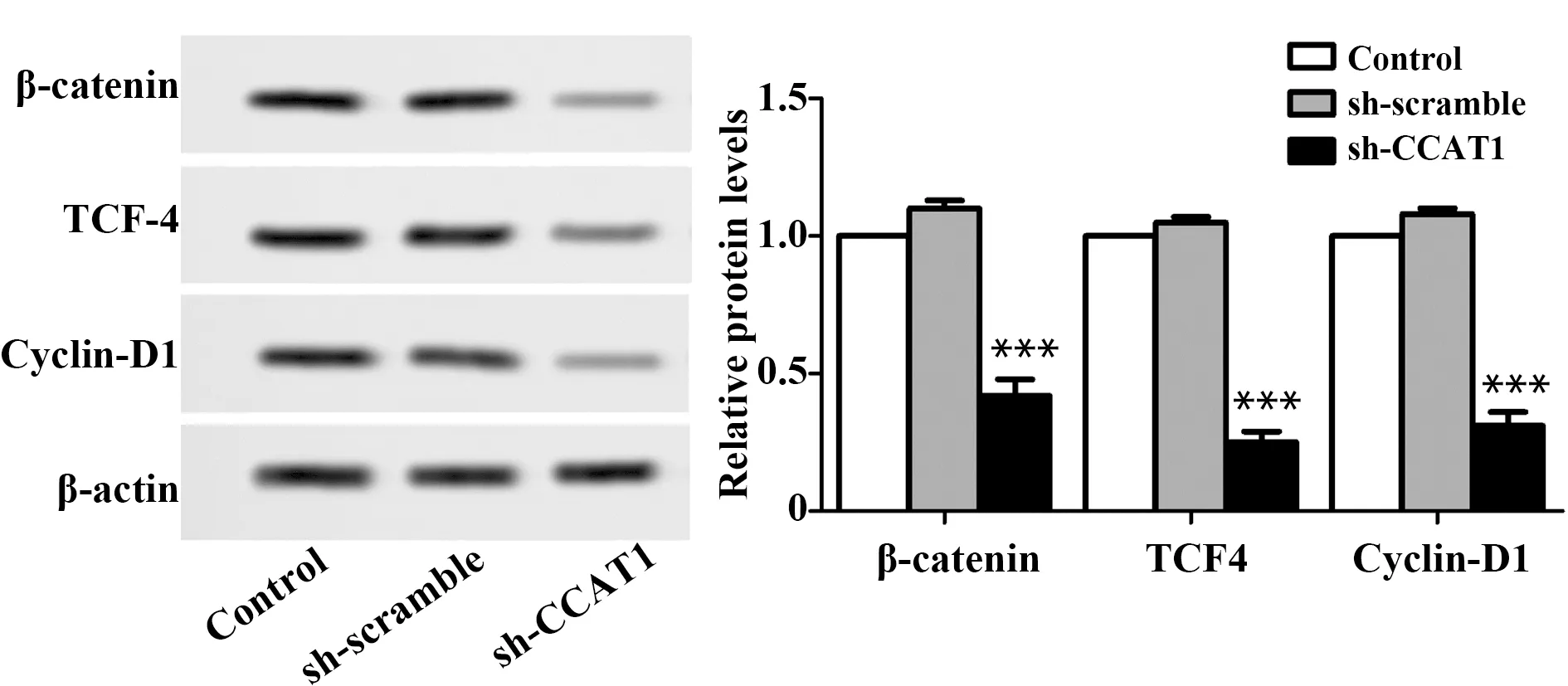
图10 免疫印迹检测sh-CCAT1对SCC-9细胞表达β-catenin、TCF4和Cyclin-D1的影响Fig.10 Effect of sh-CCAT1 on expressions of β-catenin,TCF4 and Cyclin-D1 in SCC-9 cells were evaluated by immunoblottingNote: n=6,***.P<0.001 vs control group.
2.8sh-CCAT1抑制SCC-9细胞上皮间充质转化 与Control组比较,sh-scramble组中E-cadherin(上皮标记物)、N-cadherin(间质标记物)和Snail(E-cadherin抑制因子)[21-24]的表达无显著差异, sh-CCAT1组中E-cadherin的表达显著增加,N-cadherin和Snail的表达显著减少(P<0.001,图9)。实验结果说明,sh-CCAT1对SCC-9细胞上皮间充质转化有抑制作用。提示CCAT1对SCC-9细胞上皮间充质转化有促进作用。
2.9sh-CCAT1抑制SCC-9细胞Wnt/β-catenin通路激活 与Control组比较,sh-scramble组中β-catenin、TCF4和Cyclin-D1的表达无显著差异,sh-CCAT1组中β-catenin、TCF-4和Cyclin-D1的表达显著减少(P<0.001,图10)。实验结果说明,sh-CCAT1抑制SCC-9细胞中Wnt/β-catenin通路的激活。提示CCAT1可促进SCC-9细胞中Wnt/β-catenin通路的激活。
3 讨论
LncRNA是指长度大于200个氨基酸的非编码RNA,在细胞中多发挥调节作用,如调节细胞增殖、细胞周期进程、细胞凋亡及存活等过程。近来大量研究表明,LncRNA的异常表达与癌症的发生发展密切相关[6-8]。CCAT1是一种与癌症有关的LncRNA,在结肠癌、胃癌、胆囊癌、肝癌、肺腺癌等多种癌症中均高度表达[9-13]。同时,CCAT1也在OSCC组织中高度表达,并预示OSCC患者预后不良[3]。而目前关于CCAT1在OSCC中作用机制及其影响还有待进一步研究。为进一步探索CCAT1对OSCC的作用机制及影响,本文首先对CCAT1在OSCC组织及细胞中的表达情况进行检测,并观察到CCAT1在OSCC组织及细胞株SCC-4、SCC-9、SCC-25 和Tca83中的mRNA水平显著升高,且其在SCC-9中的mRNA水平高于其他细胞株,故选用SCC-9进行后续实验。
作为促癌因子,CCAT1可促进多种癌细胞增殖并抑制其凋亡。据报道,在胰腺癌细胞中,CCAT1被c-Myc靶向激活并高度表达,沉默CCAT1表达显著抑制细胞增殖,促进细胞凋亡[15]。也有研究表明,在胃癌细胞中,CCAT1通过靶向下调microRNA-219-1提高癌细胞增殖能力,沉默CCAT1表达可减少癌细胞增殖并提高细胞凋亡水平。在本文中,sh-CCAT1可显著下调SCC-9细胞中CCAT1 mRNA水平,降低SCC-9细胞增殖速率及相关蛋白PCNA的表达,并提高SCC-9凋亡细胞百分比。PCNA是增殖细胞核抗原,在DNA复制和修复、细胞周期调控及蛋白质降解过程中发挥重要作用,被视为评价细胞增殖能力的经典指标[16]。实验结果说明,沉默CCAT1可显著抑制SCC-9细胞增殖并促进细胞凋亡。提示CCAT1可促进OSCC细胞SCC-9增殖并抑制细胞凋亡。
侵袭和迁移能力是癌细胞具有的基本特征,癌细胞侵袭和迁移是癌症转移的关键因素。研究表明,CCAT1可提高多种癌细胞的侵袭和迁移能力,并且促进癌症的转移。如在甲状腺癌中,CCAT1通过靶向下调microRNA-143提高癌细胞侵袭和迁移能力并发挥促癌症转移功能,抑制CCAT1表达后,microRNA-143显著上调且细胞侵袭和迁移能力显著降低[17]。同时在喉鳞状细胞癌中,过度表达的CCAT1可显著促进癌细胞的迁移和侵袭[18]。本文利用sh-CCAT1沉默CCAT1后发现,与Control组比较,sh-CCAT1组中SCC-9细胞划痕闭合率显著降低,侵袭细胞数及MMP-2和VEGF的表达显著减少。VEGF可刺激血管内皮细胞生长,有利于癌细胞侵袭和迁移,是侵袭和迁移过程中的关键蛋白[19]。MMP-2是基质金属蛋白酶家族的一员,可促进癌细胞侵袭和血管生成,有利于癌组织浸润转移[20]。实验结果说明,沉默CCAT1可显著降低SCC-9细胞侵袭和迁移能力。提示CCAT1可提高OSCC细胞SCC-9侵袭和迁移能力。
研究发现通过上皮间充质转化,癌细胞可获得较高的侵袭和迁移能力[21,22]。上皮间充质转化是指细胞由上皮形态转变为间充质形态的现象,其分子水平上主要变化为E-cadherin减少、N-cadherin及Snail增多。其中E-cadherin作为上皮细胞标记物,N-cadherin作为间质标记物,Snail是上皮间充质转化的转录诱导因子,可抑制E-cadherin表达、促进N-cadherin表达[23,24]。据报道,在喉鳞状细胞癌、肺腺癌和肝内胆管细胞癌等癌症中,CCAT1可显著促进癌细胞的上皮间充质转化[13,18,25]。同时研究表明,在OSCC中,CCAT1高度表达且上皮间充质转化过度激活[3,26],于是本文在沉默CCAT1后,对上皮间充质转化相关蛋白进行检测。发现与Control组比较,sh-CCAT1组SCC-9细胞中E-cadherin的表达显著提高,N-cadherin和Snail的表达显著降低,说明沉默CCAT1对SCC-9细胞上皮间充质转化有抑制作用。提示CCAT1可促进SCC-9细胞上皮间充质转化。
研究表明,Wnt/β-catenin信号通路与上皮间充质转化的发生存在密切联系,活化的Wnt/β-catenin信号通路可诱导癌细胞上皮间充质转化的发生,并在转移过程中介导癌细胞的侵袭和迁移[27,28]。此外,有报道表明,CCAT1可提高胰腺癌细胞中Cyclin-D1的表达[15]。细胞周期素Cyclin-D1诱导细胞由G1期过渡至S期,是Wnt/β-catenin的靶基因之一,它的过度表达可引起细胞癌变[29]。本文研究发现,sh-CCAT1可显著降低SCC-9细胞中β-catenin、TCF4和Cyclin-D1的表达。β-catenin是Wnt通路的调节中心,可与TCF形成复合体,从而调控靶基因的表达。TCF4是TCF的一种,可与β-catenin相互结合,参与Wnt/β-catenin信号传导途径[30]。实验结果说明,沉默CCAT1可抑制Wnt/β-catenin信号通路中β-catenin、TCF4和Cyclin-D1的表达,从而阻碍Wnt/β-catenin信号通路的激活。提示CCAT1可促进Wnt/β-catenin信号通路的激活。这一机制可能参与诱导OSCC细胞SCC-9上皮间充质转化的发生。
综上所述,CCAT1在癌组织及OSCC各细胞系中高表达,而沉默CCAT1则可显著抑制SCC-9细胞增殖,促进细胞凋亡。同时,与Control组SCC-9细胞比较,sh-CCAT1组中SCC-9细胞侵袭、迁移能力降低且上皮间充质转化受到抑制。此外,沉默CCAT1阻碍Wnt/β-catenin信号通路的激活。提示CCAT1可促进SCC-9细胞增殖,抑制细胞凋亡,且其可能通过激活Wnt/β-catenin信号通路诱导SCC-9细胞上皮间充质转化,从而提高SCC-9细胞侵袭、迁移能力,本研究进一步丰富对OSCC发病机理的了解,为靶向治疗OSCC提供理论基础。

