金匮肾气丸联合玉屏风散补肾益气对慢阻肺大鼠IL-8、TNF-α、MMP-9、P-P65和IKB-α的影响①
叶 玲 林小妹
(福建中医药大学附属人民医院,福州 350003)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种常见的慢性气道炎症性疾病,长期暴露于烟草烟雾导致氧化应激,启动炎症,IL-8、TNF-α等炎症因子释放,黏液过量分泌,黏膜纤毛清除受损,肺结构损坏,出现肺气肿[1]。研究发现,NF-κB作为转录因子,参与宿主的炎症反应,尤其在COPD患者体内处于高激活状态,可诱导大量炎症介质释放[2]。给予糖皮质激素是治疗慢性炎症疾病的主要手段,其抗炎机制是通过抑制NF-κB信号通路,调控基因表达而发挥抗炎作用,因此被作为COPD的首选药物。然而长期使用糖皮质激素会使COPD人群对药物敏感性降低,抑制NF-κB的炎症表达减弱或消失[3]。因此寻找一种有效且副作用小的糖皮质激素替代治疗显得尤其重要。大量临床研究表明,中药治疗慢阻肺具有一定疗效,且副作用少[4]。本实验通过研究金匮肾气丸联合玉屏风散对烟雾所致慢阻肺大鼠的IL-8、TNF-α、MMP-9、P-P65和IKB-α的变化,探讨其可能机制。
1 材料与方法
1.1材料
1.1.1实验用中药 金匮肾气丸联合玉屏风散由生地、山药、山萸肉、泽泻、茯苓、丹皮、桂枝、附子、黄芪、白术、防风等组成。购于福建中医药大学附属人民医院中药房,药剂科提供。将中药饮片置煎煮容器内,加冷水浸泡1~2 h,煮沸30 min,过滤。药渣加水继续煎煮,煮沸20 min,过滤。合并两次滤液,于水浴上浓缩成每毫升相当于原生药材0.5 g的药液,冷却装入灭菌药瓶,置冰箱保存。
1.1.2试剂 黄果树牌香烟(贵州中烟工业有限责任公司),烟熏箱(自制),戊巴比妥钠、一次性无菌注射器(江西洪达医疗器械集团有限公司),ELISA试剂盒、PBS(南京生兴生物),PVDF膜(Millipore),ECL发光液(Thermo),BCA蛋白浓度测定试剂盒(增强型,南京化学试剂厂),甲醇和HCl(分析纯,南京化学试剂厂),丙烯酰胺、亚甲丙烯酰胺、Tris-base、过硫酸铵、TEMED、甘氨酸、SDS[阿拉丁试剂(上海)有限公司]。PBS溶液(南京生兴生物),EDTA修复液(迈新,货号:MVS-0099),H2O2(西亚试剂,货号:7722-84-1),苏木染色液(珠海贝索,货号:BA-4097),Antibody Diluent with Backgro-und Reducing Components(Dako货号:S3022),蛋白封闭液(Dako,货号:X0909),EnVision+System-HRP Labelled Polymer Anti-mouse(Dako,货号:K4001),EnVision+System-HRP Labelled Polymer Anti-Rabbit(Dako货号:K4003),DAB+SUBSTRATE BUFFER、 DAB+CHROMOGEN(Dako,货号:K3468)。
1.1.3仪器 全自动组织脱水机(普瑞斯星医疗器械有限公司,型号:PQT-A),组织包埋机(普瑞斯星医疗器械有限公司,型号:PBM-A),病理组织漂烘仪(普瑞斯星医疗器械有限公司,型号:PHY-Ⅲ),切片机(上海徕卡仪器有限公司,型号:RM2235),微波炉(格兰仕微波炉电器有限公司,型号:P70D20P-TF),SDS-PAGE电泳仪(Bio-Rad),湿法转膜仪(Bio-Rad),脱色摇床(TY-80R,金坛市医疗仪器厂),Tanon5200化学发光检测系统(Tanon)。
1.2方法
1.2.1造模与标本采集 雄性、清洁级SD大鼠由南京医科大学SCXK提供,随机将大鼠分为正常对照组、COPD组、COPD+补肾益气组、COPD+地塞米松组,每组10只,将大鼠置于前后各有一个通气孔的有机玻璃箱(70 cm×70 cm×50 cm)内,同时点燃5只香烟,15 min后打开顶盖,散去烟雾5 min,重复上述步骤两次,每次熏10只,每周6 d,共计90 d。在连续熏烟8 d后,第9天开始,在熏烟前1 h,补肾益气金匮肾气丸联合玉屏风散或者地塞米松灌胃(灌胃前无麻醉),补肾益气组以及地塞米松组,用含2%DMSO的无菌水溶解(10 ml/kg),对照组用相同体积的DMSO无菌水灌胃。3个月后大鼠予以4%戊巴比妥钠溶液(1 ml/kg)腹腔注射麻醉,取腹主动脉血,室温下2 h内离心,3 000 r/min,离心5 min,取血清作血生化检测。取完血后,打开胸腔,然后结扎右侧肺门。分离出颈部气管后,在气管下段作一小“T”形切口,采用外径为1.8 mm的静脉导管作为经手术置管的气管插管,并将插管沿切口处缓缓插入,直至左主支气管下端分叉处完毕。用注射器吸取预热的生理盐水(37℃)2.5 ml,通过导管以较小的压力将盐水缓慢注入肺内,见大鼠左肺逐渐变得膨隆、苍白,立即缓慢回抽灌洗液,再将所得液体缓缓注回肺内,如此反复抽注10次,最后一次边回抽边将插管缓缓外拔约3.5 cm至气管隆突处,然后将回抽液盛入15 ml的塑料离心管(置于冰浴中)。最后将左肺固定在10%福尔马林溶液中,用于病理检测;右肺置于液氮迅速冷冻,储存于-80℃冰箱保存,用于分子检测。
1.2.2指标检测
1.2.2.1大鼠肺组织形态 取新鲜肺组织,进行脱水、包埋、切片等处理后,分别予维多利亚蓝染色和HE染色,显微镜镜检,采集图像。
1.2.2.2WB检测相关蛋白表达 取肺组织约15 mg,放入匀浆器内,加入100 μl RIPA裂解液,研磨组织,至裂解液无沉淀,冰上裂解30 min后,移至离心管中,以12 000 r/min离心5 min,取出上清液,-20℃保存,采用蛋白免疫印迹法检测。
1.2.2.3ELISA检测IL-8、MMP-9和TNF-α 取血液和肺泡灌洗液,血液在室温下自然凝固10~20 min,将血液和肺泡灌洗液离心20 min左右(2 000~3 000 r/min),仔细收集两者上清用于ELISA检测,室温下放置。根据试剂盒说明书操作。
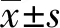
2 结果
2.1病理结果
2.1.1模型组大鼠支气管黏膜上皮细胞变性、坏死,纤毛倒伏,部分脱落,有大量炎性细胞浸润,部分管腔内有黏液栓形成及炎性细胞渗出,平滑肌增厚,气道狭窄。肺泡结构紊乱,肺泡壁变薄或断裂,肺泡弹性减弱,呈囊状扩张,肺泡腔扩大,部分融合成肺大泡。地塞米松和补肾益气组略有改善。见图1。
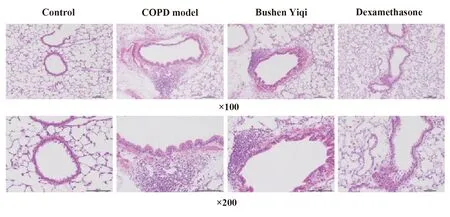
图1 大鼠肺组织HE染色(×100,×200)Fig.1 HE staining of rat lung tissue(×100,×200)Note: In model group,the epithelial cells of bronchial mucosa degenerated and necrotized,the cilia lodged,some of them fell off,and a large number of inflammatory cells infiltrated. Some of them had mucus embolus formation and inflammatory cell exudation,smooth muscle thickening and airway stenosis. Alveolar structure disorder,alveolar wall thinning or rupture,alveolar elasticity weakened,cystic dilatation,alveolar cavity expansion,part of the fusion into alveoli. Dexamethasone and Bushen Yiqi group improved slightly.
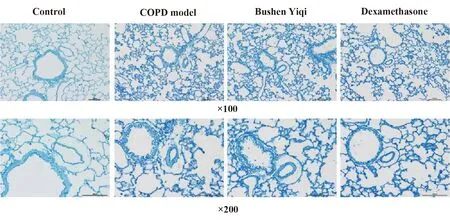
图2 大鼠的肺组织维多利亚染色(×100,×200)Fig.2 Victorian staining of lung tissue in rats(×100,×200)Note: The pulmonary vessels in the model group were obviously thickened and narrowed,and the pulmonary vessels in the dexamethasone group and the Bushen Yiqi group were improved.
2.1.2模型组肺血管有明显的血管壁增厚和管腔变窄,地塞米松组和补肾益气组有所改善。见图2。
2.1.3COPD模型组纤毛柱状细胞肿胀,纤毛(黄色箭头)减少,脱落,Ⅱ型肺泡上皮细胞变性,板层小体(红色箭头)减少,线粒体(蓝色箭头)肿胀,空泡化,嵴破坏,甚至消失,血管内皮细胞可见空泡样变性(绿色箭头)。见图3。
2.2P-P65及IKB-α表达变化 模型组IKB-α表达明显降低,补肾益气组和地塞米松组表达较模型组升高(P<0.05)。模型组P-P65表达明显升高,补肾益气组和地塞米松组较之下降(P<0.05)。见图4、5。
图3 大鼠的肺组织电镜下检测Fig.3 Electron microscopic detection of lung tissues in ratsNote: In COPD model group,cilia columnar cells were swollen,cilia (yellow arrow) were reduced and shed,type Ⅱ alveolar epithelial cells degenerated,lamellar corpuscles(red arrow) were reduced,mitochondria (blue arrow) were swollen,vacuolated,cristae was destroyed or even disappeared. Vascular endothelial cells showed vacuolar degeneration (green arrow).
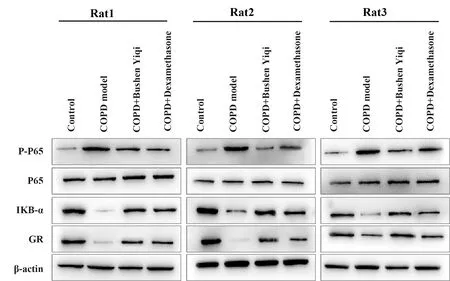
图4 各组大鼠肺组织IKB-α、P-P65的灰度分析Fig.4 Gray level analysis of IKB-α and P-P65 in lung tissues of rats in each groupNote: The expression of IKB-α in the model group was significantly lower than that in the dexamethasone group and the Bushen Yiqi group (P<0.05).The expression of P-P65 in model group was significantly higher than that in Bushen Yiqi group and dexamethasone group (P<0.05).
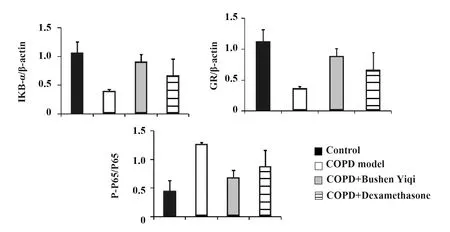
图5 各组大鼠的肺组织IKB-α、P-P65蛋白表达量Fig.5 Protein expression of IKB-α and P-P65 in lung tissue of rats in each groupNote: The expression of IKB-α in the model group was significantly lower than that in the Bushen Yiqi group and dexamethasone group(P<0.05). The expression of P-P65 in model group was significantly higher than that in Bushen Yiqi group and dexamethasone group (P<0.05).
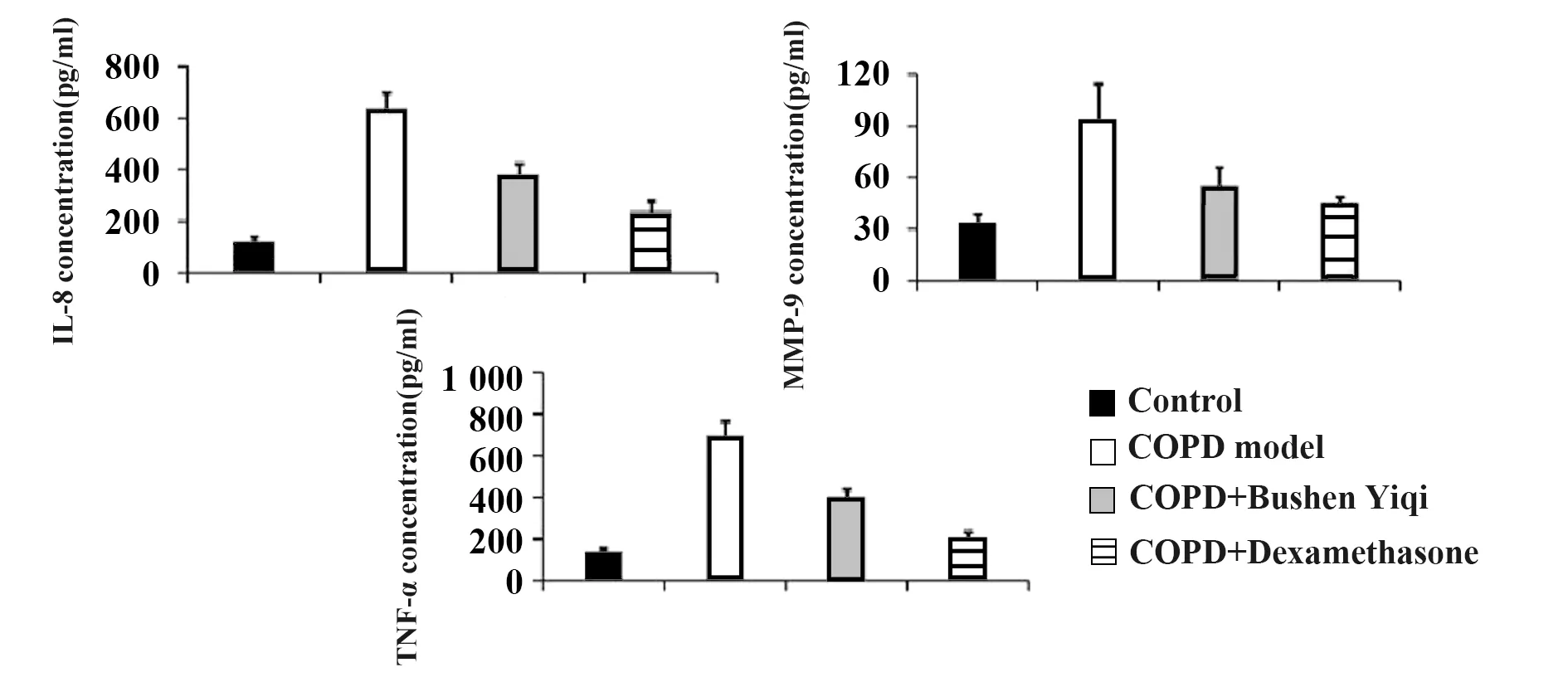
图6 各组大鼠血清中IL-8、MMP-9、TNF-α水平Fig.6 Serum levels of IL-8,MMP-9 and TNF-α in rats of each groupNote: IL-8,MMP-9 and TNF-α in the model group increased significantly (P<0.05),while the expression of IL-8,MMP-9 and TNF-α in the Bushen Yiqi group and dexamethasone group decreased (P<0.05).

图7 各组大鼠肺泡灌洗液中IL-8、MMP-9、TNF-α水平Fig.7 Levels of IL-8,MMP-9 and TNF-α in alveolar lavage fluid of rats in each groupNote: IL-8,MMP-9 and TNF-α in the model group increased significantly (P<0.05),while the expression of IL-8,MMP-9 and TNF-α in the Bushen Yiqi group and dexamethasone group decreased (P<0.05).
2.3IL-8、MMP-9和TNF-α的变化 模型组IL-8、MMP-9和TNF-α明显升高(P<0.05),补肾益气组和地塞米松组大鼠表达有所下降(P<0.05)。见图6、7。
3 讨论
COPD气道炎症主要累及了全部气道、肺泡壁、肺实质和肺部血管,涉及的细胞主要有巨噬细胞、中性粒细胞、上皮细胞、淋巴细胞等,激活的炎症细胞释放多种炎症介质和细胞因子,包括IL-8、IL-1、IL-6、TNF-α、GM-CSF、MMP-9 等[5-7]。多种炎症细胞、细胞因子和炎症介质相互作用共同参与炎症过程,导致气道壁的受损和肺气肿的发生。NF-κB是由P50和DNA结合蛋白P65构成的异源二聚体,与抑制蛋白IKB结合以无活性形式几乎存在于所有细胞的细胞浆中。香烟烟雾刺激可活化细胞[8,9],导致IKB的磷酸化及降解从而激活NF-κB[10-12],NF-κB与IKB分离同时移动到细胞核内,激活多种炎症基因的转录[13,14],包括多种细胞因子如IL-6、IL-8、TNF-α、趋化因子、黏附分子、炎症相关的酶类等[15,16]。这些转录产物又可进一步活化NF-κB,不断扩大炎症反应。
糖皮质激素是拮抗炎症反应的有效药物[17],2011版GOLD指南推荐长期吸入糖皮质激素用于严重和非常严重的COPD患者,以及经常发生急性加重且长效支气管扩张剂不能良好控制症状的患者。然而,在临床治疗中,与吸入糖皮质激素对哮喘的高效相比,糖皮质激素对COPD的治疗作用有限,即使大剂量吸入糖皮质激素甚至口服糖皮质激素也不能减缓COPD患者呈进行性进展的气流阻塞或降低各种炎性细胞、细胞因子或蛋白酶的表达,仅10%的COPD患者对吸入型糖皮质激素有效[18,19],2017版GOLD指南不推荐长期单一口服糖皮质激素治疗,不推荐长期单一吸入糖皮质激素治疗,除非与长效支气管扩张剂联合应用,认为单一吸入糖皮质激素治疗效果较差。可见部分COPD患者存在糖皮质激素抵抗,因此有必要寻找有效地新型抗炎药治疗COPD的慢性炎症反应。
COPD属于祖国医学的“咳嗽”、“喘证”、“肺胀”等范畴,肺胀之因,内有郁结,先伤肺气,复感外邪,肺脏虚弱,气阴耗伤,肺气不得发泄,则成肺胀。《内经·灵枢》曰“肺胀者,虚满而喘咳”。肺胀是一个由肺气虚-脾阳虚-肾阳虚阴阳两虚的转变过程,多属本虚标实之患。本虚以肺脾肾气虚为主。许多学者通过遵循古代医家的经验方药并结合现代医学的临床研究,发现补肾益气方药能够治疗哮喘、COPD等慢性呼吸系统炎症性疾病,其初步机理是补肾益气药作用于下丘脑-垂体-肾上腺皮质轴(Hypothalamus-Pituitary-Adrenal,HPA)和炎性反应网络中心疗效靶位群,其中补肾药主要作用于HPA轴靶位群,而益气药主要作用于炎性反应靶位群,并能调节HPA轴功能和炎症反应之间的关系,且补肾益气药有协同作用。
金匮肾气丸出自《金匮要略》具有补肺纳肾,降气平喘之功,是补肾之代表方之一。现代药理研究表明,金匮肾气丸具有使肾上腺皮质分泌糖皮质激素的作用,它的主要生理基础是下丘脑-腺垂体-肾上腺轴,通过调节血中17-羟、促肾上腺皮质激素(ACTH)水平,从而达到抗炎抗过敏的应激作用[20];玉屏风散出自《丹溪心法》具有益气固表之功,是益气的代表方之一。现代药理研究表明,玉屏风散可以显著降低哮喘大鼠BALF中IL-5、GM-CSF、TNF-α和sIL-2R含量,改善气道炎症状况[21]。卫娜等[22]用玉屏风散加减干预COPD模型大鼠,实验发现肺组织的病理形态得到改善,SIgA、SC因子表达升高,TNF-α、IL-8表达降低,提示该方可缓解COPD气道炎症,与本研究结果相同。
本实验证实用金匮肾气丸联合玉屏风散干预慢阻肺大鼠,改善肺组织病理形态,IKB-α增多,P65表达量降低,炎症介质IL-8、MMP-9及TNF-α减少。治疗效果与地塞米松组无统计学差异。临床上,对于需要长期使用激素治疗,或存在糖皮质激素抵抗,且中医辨证属于脾肾气虚患者可考虑使用补肾益气中药治疗,具体疗效有待临床进一步观察、研究。

