Hippo信号通路调控免疫细胞稳态维持的研究进展①
李俊宏 令狐月月 陈兰芬
(厦门大学生命科学学院,厦门 361102)
免疫系统是机体为了抵抗外界病原入侵所构建的复杂防御网络,其主要功能是识别和排除异己。在典型的脊椎动物中,免疫系统一方面来源于从古老祖先继承而来的固有防御机制,另一方面机体在其整个生命进程中,不断地应对外在侵染以及其内在发生的变化,从而更新发展了已有的防御机制以针对特定的异己物质,因而可划分为先天性免疫系统和适应性免疫系统。免疫系统的紊乱会导致多种疾病的发生,例如,免疫缺陷使得机体对抗病原和识别自身突变细胞的能力下降,进而导致多种病原体的感染或肿瘤的发生;而免疫过度活化则会导致免疫系统对机体自身进行攻击,引发自身免疫性疾病。因此,维持免疫系统的稳态平衡对于机体的健康至关重要。Hippo信号通路,最初被认为是经典的肿瘤抑制通路,在组织器官发育稳态中发挥着重要的调控作用,随着对Hippo信号通路研究的深入,越来越多的研究发现该通路在维持免疫系统稳态中也起着至关重要的作用。本文将主要介绍Hippo成员蛋白在先天性免疫和适应性免疫的功能及其调节机制的相关研究,特别是近几年来报道的非经典Hippo信号通路在控制抗感染、氧化还原稳态、免疫细胞代谢调控和自身免疫疾病过程中的功能和作用机制。
1 经典与非经典Hippo信号通路
Hippo信号通路是最早在果蝇中发现的一条调控器官大小和维持组织稳态的信号通路,在调控细胞接触抑制、细胞增殖、凋亡和肿瘤发生发展中都起着重要的作用[1-5]。1995年,两个研究团队发现在果蝇中敲除Warts(wts)后会导致多个组织的过度增殖[6,7]。随后几年陆续有研究发现Salvador(sav)[8,9]、Hippo (hpo)[1-5]以及Mob(mats)[10]等缺失也会产生类似Warts缺失的组织增生现象。除了在遗传学上有类似的组织增生表型以外,这些蛋白在分子和生化水平上还能够相互作用并通过磷酸化的形式传递信号,因此这些相关蛋白被认为是一个以Hippo激酶为核心的系统调控单元,被命名为Hippo信号通路。随着研究的深入,Warts激酶的底物,Hippo信号通路的效应分子转录共激活因子Yorkie也被发现报道[11]。Yorkie在细胞核内直接与转录因子Scalloped(Sd)结合,调控下游一系列靶基因表达来促进细胞的增殖和存活,抑制细胞死亡[12-15]。Hippo信号通路在进化上高度保守,哺乳动物中经典Hippo通路的核心成员包括激酶Mst1/2[16](Mammalian Ste20-like kinases 1/2,与果蝇Hippo同源) 及其构架蛋白WW45 (Sav family WW domain containing protein 1,与果蝇Salvador同源),Lats1/2[17](Large tumor suppressor 1/2,与果蝇Warts同源)及其构架蛋白Mob1A/B (Mps one binder 1A and B,与果蝇Mob同源),以及两个Yorkie同源蛋白,Yap[18](Yes-associated protein)和Taz[19](Tran-scriptional co-activator with PDZ-binding motif)。
经典Hippo信号通路主要是通过Mst1/2-WW45复合体磷酸化并激活Lats1/2-Mob1A/B复合体,而活化的Lats1/2激酶进而磷酸化下游的Yap/Taz使其与14-3-3蛋白结合而滞留在细胞浆中,从而抑制Yap/Taz入核与TEAD家族转录因子TEAD1-4(与果蝇Sd同源)结合,最终抑制细胞增殖和促进细胞的凋亡[20,21](图1A)。在小鼠中,全身敲除Mst1/2基因导致胚胎死亡[22],在小鼠的肝脏、小肠、心脏以及胰腺中特异敲除Mst1/2会导致不同程度的器官增大和/或肿瘤的发生发展[22-27],其中Yap活化是造成这一现象的关键原因,因此,如果在Mst1/2或者其他上游基因的条件性敲除小鼠中进一步敲除一个Yap等位基因,则可以缓解或完全解救由Hippo通路上游基因失活而造成的器官增生和肿瘤发生[23,28,29]。近年来,一系列的Hippo信号通路家族成员逐渐增多,例如,Rasff5 (Ras association domain family member 5,也叫RAPL或者Nore1B)[30],Ndr1/2(Nuclear Dbf2-related 1/2,也叫STK38/STK38L)[31,32]以及MAP4Ks(Mitogen-activated protein kinase kinase kinase kinases)[33,34]等都被认为是组成Hippo信号通路的成员。
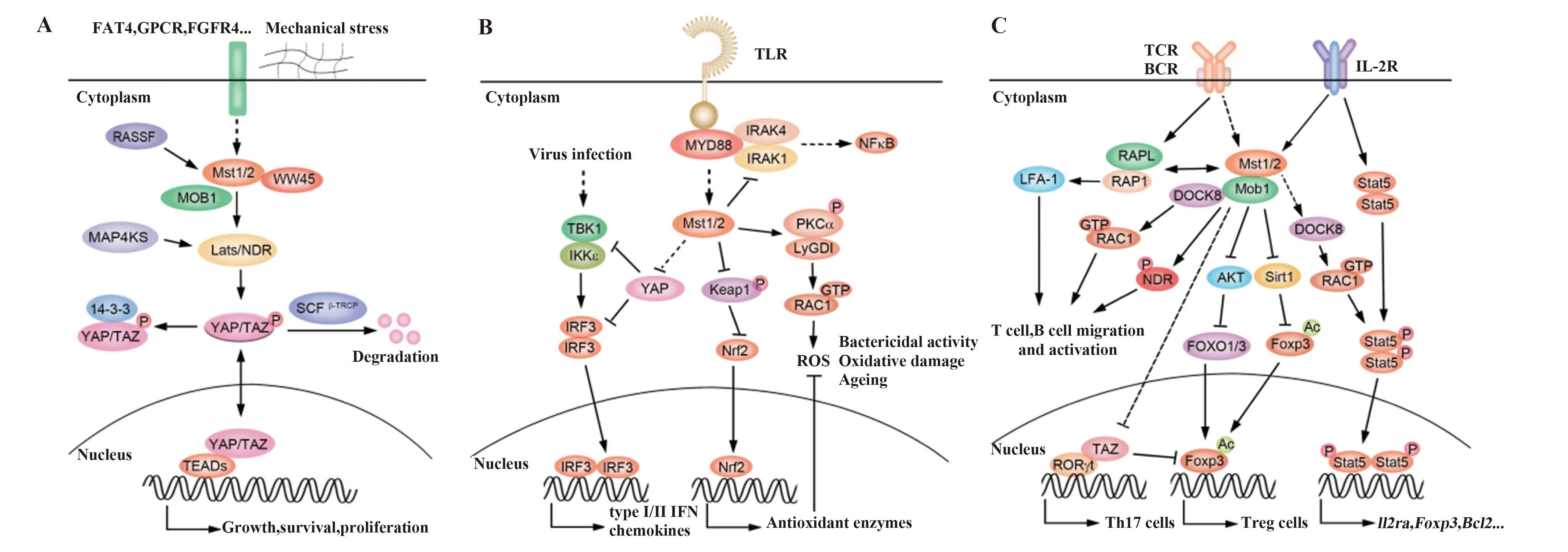
图1 经典与非经典Hippo信号通路Fig.1 Canonical and Non-canonical Hippo signaling pathwaysNote: A.Canonical Hippo signaling regulates cell proliferation,survival and growth;B.Non-canonical Hippo signaling regulates anti-infection,inflammation and redox homeostasis in innate immune cells;C.Non-canonical Hippo signaling regulates migration,activation and differentiation of T/B cells.
Hippo通路发现以来,对其功能的研究主要集中在组织器官发育、细胞增殖和肿瘤形成调控过程中的经典Yap依赖型的信号通路机制研究。最近,大量的研究也表明Hippo信号通路的主要成员可以通过磷酸化非Hippo通路分子或与其他信号通路互作调控来实现多种非经典的生物学调控功能(图1B 和C)。例如,Mst1/2激酶可以通过磷酸化Foxo1/3,促进Foxo1/3入核来影响细胞存活和胞内氧化还原稳态[35-37]。Mst1/2激酶也可通过调控小G蛋白Rho和Rac的活性进而调控细胞骨架,在免疫细胞的迁移、吞噬和杀菌方面起重要作用[38,39]。2008年,Zhou等[30]报道了Mst1/2和Nore1B等Hippo通路关键分子在小鼠免疫组织中高表达;Mst1基因全身敲除的小鼠有着严重的免疫功能缺陷,易发生多种病原感染和自发产生一些如干燥综合征、大肠炎等自身免疫性疾病。2012年,德国的Klein教授和法国的Basile教授课题组通过家族遗传疾病的谱系分析和基因测序,在同一期的Blood杂志上报道了MST1基因失活突变会导致患者发生严重的免疫缺陷综合征[40,41]。与Mst1单基因敲除小鼠的表型非常相似,这些Mst1功能缺失的患者经常发生细菌、病毒或真菌感染,易得肺炎、皮肤黏膜念珠菌病及皮肤疣等疾病,部分患者还有自身反应性抗体增多等自身免疫性疾病。此后,多种Hippo通路成员在免疫系统中特异敲除的小鼠模型被建立,大部分研究表明非经典Hippo通路在先天性免疫系统和适应性免疫系统的稳态调节中起着非常重要的作用。
2 Hippo信号通路调控天然免疫细胞
抗感染免疫应答:最近研究发现,天然免疫细胞如巨噬细胞和中性粒细胞中,Mst1/2激酶通过激活小G蛋白Rac1调控细胞骨架重塑来调控其对病原微生物的吞噬和杀伤作用。吞噬细胞在吞噬病原体之后,主要是通过呼吸爆发激活细胞膜上的NADPH氧化酶复合物以及招募线粒体靠近吞噬体产生大量超氧阴离子、过氧化氢、单态氧等活性氧簇(ROS)组成杀菌系统,直接毒杀和清除病原微生物。研究表明Toll样受体4(Toll-like receptor 4,TLR4)通过MyD88依赖的信号通路激活Mst1/2激酶,活化的Mst1/2激酶能够进一步激活小G蛋白Rac1来促进TRAF6-ECSIT复合体的组装,而该复合体是吞噬小体招募线粒体所必需的,因此Mst1/2通过其下游信号促进线粒体被招募到含有细菌的吞噬小体周边,并释放大量的ROS杀灭细菌。另一方面,由于Rac1是NADPH氧化酶复合物的重要组成成分,因此Mst1/2介导的Rac1活化同时也促进NADPH氧化酶复合物活化产生ROS,最终在合适的时空条件下实现吞噬型细胞的高效杀菌功能[39]。
在抗病毒反应中,干扰素调节因子3(IRF3)能够快速感应胞浆中的DNA/RNA而引发下游抗病毒效应。最近研究表明Hippo信号通路下游的Yap通过阻断IRF3的二聚化和入核转运来负性调控细胞的抗病毒免疫应答。因此敲除Yap可以增强固有免疫应答和减少病毒的载量。有意思的是,由病毒引发的天然免疫应答信号并通过非经典的Mst1/2和Lats1/2 激酶来调控Yap的活化,而是通过活化IKKε来磷酸化Yap的403位丝氨酸,从而促进由溶酶体介导的Yap蛋白降解以增强细胞的抗病毒反应[42]。另一课题组也报道了Yap/Taz可以直接与TBK1相互作用,抑制了TBK1的63位泛素化及其与底物的结合,从而阻断TBK1功能来抑制细胞的抗病毒反应,因而在Yap/Taz缺失或上游Lats1/2激酶介导的Yap/Taz失活的条件下,TBK1可重获功能以加强抗病毒免疫应答[43]。在Hippo信号通路中,Mst1/2激酶抑制转录共激活因子Yap的活性。然而与上述抑制Yap活性可增强细胞的抗病毒反应不同,Meng等[44]却报道了Mst1激酶通过直接磷酸化IRF3的75位和253位丝氨酸位点,减少IRF3二聚体的产生及降低其DNA结合能力,同时Mst1抑制TBK1激酶活化从而进一步减弱IRF3的激活等方面来抑制细胞的抗病毒反应。该结果也与Mst1功能缺失患者易发病毒感染的临床症状不一致,当然在这些患者同样存在着获得性免疫功能的缺陷,可能导致了对多种病原的易感性,总之,Hippo通路关键分子在抗病毒免疫中的作用还有待进一步深入研究。
病原体造成的肝脏慢性炎症是肝癌的重要诱因之一,Li等[45]发现在细菌感染条件下,肝脏浸润巨噬细胞中, Mst1抑制了TLR4/9诱导的促炎细胞因子分泌,而同时Mst1激酶通过结合并磷酸化IL-1受体相关激酶1(IRAK1)导致其降解,从而增强了TLR3/4触发的IFN-β生成,减少了肝脏慢性炎症的发生和抑制肝癌的发生。而在肝癌患者体内分离的巨噬细胞中Mst1的表达显著降低,并且伴随着IRAK1和IL-6的上升。类似的,在炎症引发的结直肠癌中,外周血浆的Mst1也有下调的现象,这些研究都表明Mst1可能应用于炎症引发肿瘤的诊断标志物[46]。此外,也有研究指出在结核杆菌(M.tuberculosis)感染过程中,TLR2受体可通过IRAK1/4信号通路激活Mst1/2激酶来调控下游趋化因子的表达。其中激活的IRAK1/4激酶能够直接和Mst1/2相互作用,以不依赖于Lats1/2激酶的活性方式,通过IRF3来调控下游趋化因子CXCL1和CXCL2的表达[47]。最近研究还发现Hippo通路在果蝇的抗感染免疫中也发挥着重要作用,Hippo缺失的果蝇免疫器官脂肪体中,下游Yki蛋白的活化导致大量的Cactus (IκB同源蛋白)转录水平上升,最终减弱了抵抗革兰氏阳性菌感染的能力[48]。这些结果都表明了Mst1可通过调控独特的非经典下游效应蛋白,参与各种抗病原微生物的免疫应答过程中。
3 巨噬细胞的氧化还原稳态与衰老
在机体抗感染过程中,巨噬细胞中产生大量ROS来杀灭和清除吞噬小体中的病原体[49]。由于活性氧ROS会对细胞造成损伤,最终导致细胞的衰老和死亡,因此巨噬细胞在清除病原体的过程中,如何维持ROS产生和消除之间的平衡以防止大量ROS损伤宿主细胞,就显得至关重要[50-53]。最新的研究发现Mst1/2激酶在巨噬细胞氧化还原稳态维持和抗衰老中发挥重要作用。与野生型巨噬细胞相比,Mst1/2敲除的巨噬细胞的基础ROS水平升高,存在更多的DNA损伤和细胞凋亡现象,而抗氧化剂N-乙酰半胱氨酸(NAC)处理可以显著缓解由Mst1/2敲除导致的巨噬细胞氧化应激表型;此外,Mst1/2敲除的老年小鼠体内的巨噬细胞胞内脂褐素的积累更为显著,端粒长度更短,指示了早衰现象,并且伴随着更早出现免疫应答功能以及抗感染能力下降的表型[54]。
目前报道较多的与氧化应激相关的几个转录因子有Foxo1、Foxo3和Nrf2等,研究发现Nrf2在巨噬细胞中高表达,Foxo1/3则在T细胞或B细胞中高表达,而在巨噬细胞中表达量很低。在Mst1/2敲除的巨噬细胞中,与氧化应激水平升高相一致的是,该细胞中多个Nrf2下游靶基因表达显著降低。研究发现Mst1/2激酶可以感应ROS,从而被募集到ROS的产生部位,如吞噬体和线粒体,同时被它们所释放的ROS激活。活化的Mst1/2调节抗氧化转录因子Nrf2来维持胞内氧化还原稳态,以在病原体清除期间保护细胞免受大量杀伤性ROS诱导的氧化损伤。Nrf2受到负性调节蛋白Keap1的精确调控,多聚化的Keap1能通过C端Kelch结构域锚定Nrf2并促使其走向蛋白酶体依赖性降解,从而抑制其转录活性。Keap1也能够响应大肠杆菌侵染与Mst1/2在大肠杆菌侵染部位形成三者共定位,而这一现象在使用NAC预处理后明显减少。研究还发现Mst1/2激酶可直接结合Keap1,并对Keap1的四个位点(T51、S53、T55和T80)进行磷酸化修饰,Mst1/2介导的Keap1磷酸化阻止了Keap1分子的多聚化,从而阻断了Nrf2的泛素化和蛋白降解。而当Keap1分子中的四个位点突变(T51A、S53A、T55A和T80A)为Mst1/2激酶持续失活形态的Keap14A时,更易形成多聚化Keap1,增加了Nrf2的泛素化水平和蛋白不稳定性,从而造成细胞氧化损伤。因此,在巨噬细胞抗感染过程中,Mst1/2激酶通过调控抗氧化因子Nrf2蛋白水平促进其下游的抗氧化酶靶基因表达来降低胞内ROS水平,维持巨噬细胞的氧化应激稳态。Yuan等[37]之前报道了,在应激条件下,Hippo激酶Mst1可以直接磷酸化和活化Foxo蛋白,从而激活细胞凋亡通路促进神经元细胞的死亡,在免疫系统中,Mst1缺失的外周T细胞中,Foxo1/3的表达水平和功能也存在缺陷,暗示了Mst1-Foxo信号通路在维持T细胞的氧化还原稳态中可能也发挥着一定的作用。
4 树突状细胞活化和代谢稳态调控
树突状细胞(DC)是一类具有抗原呈递功能的天然免疫细胞,在天然免疫和适应性免疫之间起重要的桥梁作用,近年的研究表明Mst1在DC细胞中也扮演着重要的角色。趋化因子受体CCR7对于成熟DC细胞进入淋巴结中启动免疫反应至关重要,研究发现刺激人mDC细胞的CCR7受体可以激活Gαi受体依赖的Mst1活化,因此在人的DC细胞中敲低Mst1激酶会抑制依赖于CCR7信号的RhoA下游靶蛋白的磷酸化,从而影响了DC细胞骨架重塑和迁移[55]。小鼠DC细胞缺失Mst1激酶会增强依赖于MAPK p38调控的IL-6表达量,活化T细胞中IL-6R/p-STAT3通路,促进Th17细胞分化,导致了该小鼠在肝脏和大肠等处发生严重炎症从而增加小鼠死亡率[56]。最新的研究则揭示了Mst1/2激酶在CD8α+DC细胞的发育和活化中的重要作用[57]。DC细胞按照其在体内的谱系分化可划分为浆细胞样树突状细胞(plasmacytoid DC,pDC) 和常规树突状细胞(conventional DC,cDC),而cDC又可被划分为CD8+DC和CD8-CD11b+DC[58]。在病毒或细菌感染以及肿瘤发生发展的过程中,CD8+T淋巴细胞需要CD8α+DC细胞呈递抗原而活化,进而发挥其细胞杀伤作用。迟洪波教授课题组通过NetBID的系统生物学分析方法研究发现,相比于CD8α-DC细胞,CD8α+DC细胞中Hippo信号通路激酶的表达量及其活性都显著提高。在DC细胞中特异性敲除Mst1/2,会扰乱CD8+T细胞的稳态及其肿瘤杀伤功能,而敲除经典Hippo信号通路中的其他关键分子,如Lats1/2或者Yap/Taz,则对CD8+T细胞的功能无显著的影响[57]。其中最主要的是Mst1/2缺失削弱了CD8α+DC细胞向CD8+T细胞呈递胞外蛋白以及自身多肽的功能,而对于CD8α-DC细胞的相应功能没有显著影响。进一步机制研究发现,相较于CD8-DC细胞而言,CD8α+DC细胞具有更强的氧化代谢水平,暗示了Mst1/2激酶可能通过维持线粒体动态和能量代谢稳态,来保证CD8+DC细胞对T细胞的诱导活化功能。此外,他们还发现在Mst1/2缺失的CD8α+DC细胞中,非经典NF-κB信号通路被抑制,导致了IL-12表达量显著下降,也影响其对T细胞的活化作用。因此,Mst1/2激酶可以通过整合代谢活性和相关免疫功能信号通路的活化,来促进CD8α+DC细胞的抗原呈递功能,也暗示了Hippo信号通路在DC细胞中可介导免疫相关信号通路和代谢重编程之间的互作来发挥其独特功能。
5 Hippo信号调控获得性免疫功能
Hippo信号通路在免疫系统中的功能早期研究多集中于Mst1激酶在T细胞迁移、归巢和活化过程中的调控作用。在Mst1全身性敲除小鼠中,胸腺单阳性T细胞的比例和数量增加,次级淋巴组织中CD62LhiCD44lo的初始T细胞明显降低,而在肝脏或肺中的CD62LloCD44hi效应/记忆T细胞数量升高[30],而在Mst1和Mst2造血系统条件性双敲除小鼠中,这种T细胞迁移缺陷和过度活化的情况更为严重。多项研究都表明Mst1可能通过影响细胞黏附因子来调节T细胞的迁移能力,在Mst1缺失或者阻断细胞黏附分子LFA-1和ICAM-1的小鼠骨髓中,CD4+单阳性胸腺细胞的迁移能力下降以及抗原识别效率明显降低[59]。此外,Mst1/2激酶还可以通过响应磷酸鞘氨醇1(S1P)和CCL21的刺激,磷酸化Mob1来促进Rac1和RhoA的活化,调控T细胞骨架重塑和细胞迁移[38]。Hippo通路中,与Lats1/2同一激酶家族的NDR激酶也能够调控T细胞迁移,也有研究指出NDR激酶可抑制T细胞淋巴瘤的发生发展并起着调控T细胞内稳态的作用[60]。相关免疫细胞的条件性Ndr1/2双敲除小鼠与Mst1/2双敲除小鼠具有类似的T细胞表型,即次级淋巴器官中初始T细胞显著减少,而单阳性胸腺细胞在胸腺中累积,暗示了NDR激酶可能是Mst1在调节免疫系统功能的重要下游效应蛋白[31]。Hippo通路相关分子在T细胞的迁移和归巢中的重要作用,已有多篇综述予以总结,本文将主要介绍Hippo通路如何调控T细胞的分化,特别是Treg和Th17的发育分化以及其在B细胞功能中的一些作用。
6 Treg和Th17的发育分化
辅助性CD4+T淋巴细胞17(Th17)和CD4+调节性T淋巴细胞(Treg)的数目和功能失衡与一些自身免疫疾病的发生密切相关。Th17细胞是导致一些自身免疫性疾病,如胶原诱导性关节炎(Collagen induced arthritis,CIA)、炎症性肠病(Inflammatory bowel disease,IBD)、人多发性硬化症(Multiple sclerosis,MS)及实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)等的关键效应细胞;反之,Treg细胞则是机体对自身成分的免疫耐受,是机体保持免疫稳态所必需的。目前,多个课题组的研究结果都表明了激活Hippo信号通路一方面可以促进和增强Treg细胞的分化和免疫调节功能,另一方面则抑制了Th17细胞的发育分化,因此Hippo信号通路对于机体免疫耐受和抑制炎症发生的稳态维持至关重要。
Mst1缺失或Mst1/2在造血细胞系中敲除的小鼠更容易发生自身免疫疾病,如炎症性肠病、眼周和口唇腺体病变干燥综合征(Sjögren syndrome,SS)等[30,61]。这些小鼠中,调节性Treg细胞的分化和功能受损,而Th17细胞相关的细胞因子在炎症组织中的表达量增高。在Rag1敲除背景的小鼠中移植Mst1敲除的骨髓同样会造成干燥综合征和肠炎,而回补野生型Treg细胞可以抑制这类自身免疫疾病的发生发展。Mst1缺失使得Treg细胞的核心转录因子Foxp3的表达下降,同时抑制了TGF-β诱导naïve T细胞体外分化为Treg细胞的能力。过去的研究表明Foxo1/3这两个转录因子正向调控Foxp3的表达,而持续激活Akt可以抑制Foxp3的表达以及Treg的发育。Mst1一方面通过直接磷酸化Foxo1(S212)和Foxo3(S207)增强其稳定性,另一方面Mst1抑制了TCR激活引发的Akt活化,从而抑制了Akt对Foxo1的T42位磷酸化,进一步增强了Foxo1/3的稳定性[61]。通过上述两个途径,Mst1稳定Foxo1/3进而促进Treg的发育。相比于其他的T细胞,Treg只需要少量的IL-2即可保持其活性[62],这也是机体控制自身免疫疾病的重要方式。最近的研究还发现,胞外IL-2刺激会激活Treg细胞中的Mst1激酶,而Mst1可以增强Treg细胞的功能,因此在小鼠的Treg细胞中特异性敲除Mst1和Mst2,将导致严重的自身免疫疾病,小鼠无法存活。相关的分子机制研究表明,在Treg细胞中,Mst1/2介导了IL-2诱导的STAT5的激活,进而在Treg细胞的存活和增殖中起到了重要的促进作用。其次,Mst1/2还可以通过稳定IL-2诱导Foxp3表达,进而增强其相应的Treg细胞谱系的稳定性。Mst1/2在促进Treg细胞接受IL-2信号活化的过程中是不依赖于经典Hippo信号通路的下游蛋白,如Taz和Yap,而主要是通过激活小G蛋白Rac和DOCK8分子来促进IL-2-STAT5信号通路的活化而增强其生物学功能[63]。
本课题组最近的研究发现,在Rag1-/-敲除小鼠中过继转移缺失Mst1的初始(naïve)T 细胞,与转移野生型初始T细胞的小鼠相比,发生更为严重的大肠炎,而如果过继转移的是同时敲除Mst1和其下游的Taz分子的初始T细胞则会减轻这种疾病的发生发展[64]。因此,Hippo通路中Mst1/2激酶可能是通过其下游转录共激活因子Taz来调控效应T细胞功能而影响疾病的发生发展。进一步研究发现Taz与Th17细胞所介导的一些自身免疫疾病的发生发展密切相关。在一些自身免疫性疾病(如风湿性关节炎和干燥综合征)患者的外周血T细胞中Taz的表达量与Th17细胞的核心转录因子RORγt的表达量呈正相关;而在小鼠T细胞中特异敲除Taz后可缓解EAE和IBD的发展[64]。研究发现Taz是通过促进了Th17的发育分化和抑制Treg的分化和功能来影响这些疾病的进程。在Th17细胞体外诱导分化条件下,即初始T细胞同时受到T细胞受体(TCR)、TGF-β和IL-6的刺激下,活化的转录因子Smad3和STAT3可以协同促进Taz的大量表达。高表达的转录共激活因子Taz与Th17核心转录因子RORγt结合,促进了RORγ的转录活性;同时,Taz通过竞争结合Tip60,来抑制Treg核心转录因子Foxp3的乙酰化,促进Foxp3的泛素化和降解,解除Foxp3对RORγt的抑制作用,因此促进Th17细胞分化和抑制Treg细胞分化。研究还发现,在Treg细胞体外诱导分化条件下,即初始T细胞在TCR信号和TGF-β的共同刺激下,Taz的转录水平也有一定程度的升高,而同时Hippo信号通路下游的转录因子TEAD1的表达量也增加。由于TEAD1与TAZ的结合能力更强,因此竞争性阻止了Taz与上述几个相关分子的相互作用,解除了Taz对于Foxp3分子稳定性和功能的影响,初始T细胞进一步发育分化为Treg细胞。该研究同时也检测了Hippo信号通路下游的另一转录共激活因子Yap1在多种T细胞亚型中的表达情况,发现与Taz基因不同,Yap基因在这些T细胞亚型(Th1、Th2、Th17和Treg)中表达量都很低[64]。然而,最近也有研究报道,Yap可能在特定条件下对Treg细胞的发育和分化也发挥着一定作用。Ni等[65]发现,在体外诱导的Treg细胞中,激活TCR信号通路可以上调Yap表达量,而Yap通过上调TGFβ/SMAD和Activin信号通路相关基因的表达来促进Treg细胞的分化;在小鼠的Treg细胞中敲除Yap,导致Treg细胞功能缺陷无法行使其抑制抗肿瘤免疫或促进肿瘤生长的能力,因此与野生型小鼠相比较,黑色素瘤细胞不易在Treg细胞条件性敲除Yap的小鼠中成瘤。
7 B 细胞
从最初Mst1敲除小鼠中发现的外周B细胞数目减少、脾边缘区B细胞的缺失[30,66],以及Mst1功能缺失突变的一些患者体内的自身抗体水平升高[40,41],都表明Hippo信号通路在B细胞的发育和功能中也发挥着作用。研究发现,Mst1缺失小鼠易发高丙种球蛋白血症(Hypergammaglobulinemia)并伴随着IgG、IgA和IgE水平升高,一种可能的机制是该小鼠Treg细胞减少,由此导致的免疫耐受崩溃会造成Th2细胞的过度活化,导致CD4+T细胞产生大量的IL-4而促使小鼠体内抗体水平升高[67]。Mst1和Mst2激酶在T细胞的迁移和归巢中发挥重要的作用,然而,Mst1缺失只是轻微影响了B细胞归巢到淋巴结,在造血系统中敲除Mst1和Mst2并不影响B细胞在骨髓中的发育及成熟B细胞迁移到脾脏的能力。Mst1/2双敲除的滤泡B细胞虽然可以在脾脏内的白髓中成熟却无法重新回流到淋巴结或骨髓中,而且这些B细胞也无法有效地迁移到脾脏内的红髓中,这可能是Mst1/2敲除导致脾边缘区B细胞缺失的原因之一[68]。也有研究表明,在Mst1缺失小鼠中,B细胞受体(BCR)在刺激性脂双分子层上的聚集和分散都有明显缺陷,导致了BCR信号减弱。Mst1通过调控CD19的转录水平来正向调控BCR信号通路。CD19介导的Btk信号通路缺陷也可能是导致脾边缘区B细胞缺失和滤泡B细胞功能缺陷的原因之一[69]。最新的研究则发现,在Mst1缺陷的年轻成年鼠中,虽然有B细胞亲和力成熟受损的迹象,但是早期T细胞依赖性的IgG1反应在很大程度上是完整的。该研究中还发现,在Mst1缺失小鼠中,由于抗原特异性的浆细胞的快速丢失,使得已建立的抗原特异性IgG1的水平下降很快。但是,尽管抗原特异性抗体的亲和力和存在时长有缺陷,Mst1缺失小鼠的浆细胞表面成熟受体标记正常,也具有正常的迁移和分泌能力。进一步研究发现,在免疫后,Mst1缺失的滤泡辅助T细胞(Tfh)活性更高,也表达更高水平的IL-21、IL-4和表面CD40L,最终可能导致了生发中心B细胞活化过快,丧失了部分严格的亲和成熟过程,直接进入浆细胞谱系。因此,在Mst1缺失小鼠中,失调生发中心产生大量低亲和力的浆细胞可能是体液免疫缺陷的基础[70]。这些结果也暗示了,对于Mst1功能缺陷的病人而言,即使在幼年时期接种疫苗可能也无法建立长期的高亲和力体液免疫。
8 结语与展望
目前关于Hippo信号通路在免疫系统中的研究主要是以该通路的核心激酶Mst1/2为主,且多数情况下以不依赖下游激酶Lats1/2和经典的转录共激活因子Yap的非经典Hippo通路调控方式进行,例如,Mst1/2激酶可能通过Ndr1/2,而非Lats1/2激酶,以不依赖于Yap活性的方式来调控成熟胸腺细胞迁出胸腺以及初始T细胞的循环迁移和活化。经典Hippo信号通路下游效应分子,Yap和Taz在免疫细胞中表达量很低,但有研究表明两者都可以在特定条件下被诱导表达,例如:TGFβ可以诱导Taz在T细胞中表达,从而调控Th17和Treg细胞的分化和功能。小G蛋白如Rac和Rho等的活化是Mst1/2激酶调控免疫细胞功能中的一个重要环节,在多种类型的免疫细胞中,Mst1/2激酶都可以通过调控特定小G蛋白的活性重塑细胞骨架,调节相关细胞的迁移、归巢和吞噬作用,也可通过活化小G蛋白介导的Hippo信号与其他信号通路的互作来调控吞噬性细胞对细菌的杀伤或淋巴细胞的活化。最近Hippo信号通路在肿瘤免疫调控方面也有一些报道,例如,在肿瘤细胞中,Lats1/2可通过抑制肿瘤分泌外泌体进而减少Ⅰ型干扰素的分泌,从而抑制T细胞的肿瘤杀伤能力[71];在肿瘤细胞中异常的Hippo信号通路可以通过影响其微环境而影响免疫细胞的浸润和活化,从而影响机体抗肿瘤免疫应答[72],因此以改变Hippo信号通路活性为靶向治疗肿瘤的同时还要考虑其对机体免疫系统的影响。总之,由经典Hippo通路延伸和扩展的非经典Hippo通路在免疫系统中的功能还有待于进一步深入探究,深入了解经典Hippo信号通路在组织器官发育稳态中的重要调控作用和非经典Hippo信号通路在免疫系统稳态维持的重要作用,将为机体在感染、自身免疫性疾病、衰老和肿瘤的诊治提供药物靶标和治疗策略。

