过表达中期因子增强SMMC 7721细胞对5-Fu耐药及可能机制研究
慎华平 徐杰伟 朱霄峰 邱建 魏云海 张国雷 黄惠莲 严强
[摘要] 目的 探讨过表达中期因子(MK)增强SMMC 7721细胞对5-氟尿嘧啶(5-Fu)耐药及其可能的机制。 方法 将SMMC 7721细胞转染pIRES2-EGFP-MK重组质粒过表达,采用实时荧光定量PCR(qPCR)和蛋白质印迹法(WB)检测MK mRNA和蛋白的表达。5-Fu处理后,采用MTT法检测SMMC 7721细胞对5-Fu的耐药。采用WB法检测磷酸化磷脂酰肌醇3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-Akt)和NF-κB及Bcl-2、survivin、caspase-3的表达。 结果 将SMMC 7721细胞转染pIRES2-EGFP-MK重组质粒过表达后,MK mRNA和蛋白的表达增加,Con-C组细胞对5-Fu的IC50显著高于Con-A组、Con-B组[(27.36±4.31)mg/L vs (4.57±0.34)mg/L,(4.96±0.46)mg/L],差异具有统计学意义(P<0.05)。此外,与Con-A组、Con-B组比较,Con-C组细胞p-PI3K(0.66±0.04 vs 0.35±0.03,0.57±0.03)、p-Akt(0.31±0.02 vs 0.17±0.02、0.25±0.02)、NF-κB(0.63±0.05 vs 0.27±0.02,0.53±0.04)、Bcl-2(0.42±0.04 vs 0.13±0.01, 0.38±0.04)、survivin(0.58±0.04 vs 0.18±0.02,0.51±0.04)呈現高表达,caspase-3(0.41±0.04 vs 0.88±0.06,0.43±0.03)呈现低表达(P<0.05)。 结论 过表达MK可增强SMMC 7721细胞对5-Fu耐药,其机制可能与激活PI3K/AKT信号通路有关。
[关键词] 肝癌;SMMC 7721细胞;中期因子;5-氟尿嘧啶;磷脂酰肌醇3-激酶;蛋白激酶B
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-9701(2019)18-0041-05
[Abstract] Objective To investigate the effect of overexpression of midkine(MK) on the resistance of SMMC 7721 cells to 5-fluorouracil(5-Fu) and its possible mechanism. Methods SMMC 7721 cells were transfected into pIRES2-EGFP-MK recombinant plasmid for overexpression. Real-time quantitative PCR(qPCR) and Western blot(WB) were used to detect the expression of MK mRNA and protein. After 5-Fu treatment, the resistance of SMMC 7721 cells to 5-Fu was detected by MTT assay. The expression of phosphorylated phosphatidylinositol 3-kinase(p-PI3K), phosphorylated protein kinase B(p-Akt) and NF-κB, and Bcl-2, survivin and caspase-3 were detected by WB assay. Results After overexpression of SMMC 7721 cells transfected with pIRES2-EGFP-MK recombinant plasmid, the expression of MK mRNA and protein increased, and the IC50 of 5-Fu in Con-C group increased significantly than that in the Con-A group and Con-B group[(27.36±4.31) mg/L vs 4.57±0.34] mg/L,(4.96±0.46) mg/L], and the difference was statistically significant(P<0.05). In addition, compared with the Con-A group and Con-B group, p-PI3K(0.66±0.04 vs 0.35±0.03, 0.57±0.03), p-Akt(0.31±0.02 vs 0.17±0.02, 0.25±0.02), NF-κB(0.63±0.05 vs 0.27±0.02, 0.53±0.04), Bcl-2(0.42±0.04 vs 0.13±0.01, 0.38±0.04), survivin(0.58±0.04 vs 0.18±0.02, 0.51±0.04) showed high expression, caspase-3(0.41±0.04 vs 0.88±0.06, 0.43±0.03) showed low expression in the Con-C group(P<0.05). Conclusion Overexpression of MK can enhance the resistance of SMMC 7721 cells to 5-Fu, and its mechanism may be related to the activation of PI3K/AKT signaling pathway.
[Key words] Liver cancer; SMMC 7721 cells; Midkine; 5-fluorouracil; Phosphatidylinositol 3-kinase; Protein kinase B
原发性肝癌(hepatocellular carcinoma,HCC)是我国目前临床上最常见的消化系恶性肿瘤,尽管手术切除肿瘤具有显著的治疗效果,但对于难以手术切除的中、晚期HCC,化疗是其治疗首选[1-3]。然而,HCC是一种对于化疗不甚敏感的恶性肿瘤,其对化疗药物耐药是影响化疗治疗效果的关键[4]。探讨HCC化疗耐药机制,有针对性地对相关关键基因进行调控,是有效改善HCC患者化疗效果的重要手段。最新研究结果证实,中期因子(midkine,MK)在肿瘤的恶性生物学特性中发挥着重要的作用[5]。动物实验结果表明,上调肝癌细胞MK表达水平可促进肝癌细胞增殖、侵袭和转移[6]。前期研究结果也证实,沉默MK基因可增强肝癌Bel/Fu细胞对化疗药物敏感性[7]。但MK基因是否与耐药有关及其可能机制报道尚少。众多研究证实,磷脂酰肌醇3-激酶(phosphoinositide3-kinase,PI3K)/蛋白激酶B(protein kinaseB,Akt)信号通路及其相关因子NF-κB、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、凋亡抑制基因survivin、细胞凋亡终末剪切酶caspase-3在HCC发生发展中具有极其重要的作用[8-10]。但其与MK关系却鲜见报道。本研究采用细胞转染技术构建过表达MK肝癌SMMC 7721细胞系,观察其对5-氟尿嘧啶(5-Fluorouracil,5-Fu)耐药情况,同时检测上述蛋白的表达水平。
1 材料与方法
1.1 细胞株
SMMC 7721细胞株购自中科院上海细胞库。
1.2 试剂与仪器
pIRES2-EGFP-MK重组质粒(南京钟鼎生物科技有限公司);5-Fu(武汉易泰科技有限公司上海分公司);RPMI 1640培养液(美国Sigma公司);胎牛血清(美国Sigma公司);实时荧光定量PCR试剂盒(TIANGEN Biotech CO,LTD.);蛋白质印迹法检测试剂(美国Thermo公司);兔抗人p-PI3K、p-Akt、Bcl-2多克隆抗体(北京博奥森生物技术有限公司);兔抗人survivin、caspase 3、NF-κB、MK多克隆抗体(英国Abcam公司);鼠抗人β-actin单克隆抗体(英国Abcam公司);辣根过氧化物酶标记IgG(英国Abcam公司);PCR引物由Sangon Biotech CO,LTD.合成。
1.3 观察指标
包括MK mRNA表达、SMMC 7721细胞对5-Fu的IC50、p-PI3K、p-Akt、NF-κB、Bcl-2、survivin、caspase-3蛋白表达。
1.4 方法
1.4.1 细胞培养 SMMC 7721细胞在含有10%胎牛血清的RPMI 1640培养液中,于37℃、5% CO2下培养至细胞融合度>80%时,进行转染。
1.4.2 分组与转染 根据实验设计,将SMMC 7721细胞分为空白对照组(Con-A);空载对照组(Con-B):单用pIRES2-EGFP空载质粒处理;转染组(Con-C):pIRES2-EGFP-MK重组质粒,采用脂質体2000转染。转染:吸去SMMC 7721细胞培养基,PBS清洗2次,加入基础培养基700 μL;向已加入基础培养基300 μL的1.5 mL EP管中加入2.5 μg质粒,轻轻混匀;向另一EP管中加入基础培养基和5 μL脂质体,使总体积同前一EP管,轻轻混匀;静置5 min后,将两管液体混合,静置20 min,随后转移到细胞培养皿中,放置于细胞培养箱中培养360 min后,更换含有血清、抗生素的培养基,继续放置于细胞培养箱中培养48 h,进行后续实验。
1.4.3 qPCR检测MK mRNA表达 将各组处理后的细胞培养48 h后,进行收集。按照试剂盒说明,抽提细胞总RNA,经过逆转录反应获得cDNA,然后按下述条件进行PCR反应。反应条件为:95℃下反应3 min进行预变性,随后按94℃ 15 s、60℃ 15 s、72℃ 30 s条件进行30个循环。
引物设计如下:MK:5-CCCCAGCAGCCAGCAG-3,5-CGAGGAGGGTGAGGAGGAG-3,127 bp;β-actin:5-GATGAGATTGGCATGGCTTT-3,5-GTCACCTTC-ACCGTTCCAGT-3,123 bp。
利用相对定量法和微软EXCLE软件进行分析,计算公式为RQ=2-△CT,利用Graphpad prism 5软件进行作图。
1.4.4 WB检测相关蛋白表达 向提取好的细胞总蛋白中加入缓冲液进行变性,时间为10 min,随后取5 μL产物上样在100 V恒压条件下进行SDS-Page电泳,冰浴120 min电转至PVDF膜,加入50 g/L浓度脱脂牛奶常温下封闭60 min,随后加入适当浓度一抗,4℃摇床孵育过夜,次日用TBST漂洗5 min×5次,加入HRP标记的二抗,室温孵育1 h,TBST漂洗5 min×5次,ECL发光液反应5 min后,吸去多余发光液,压片5 min,显影15 s,水洗净进行定影、显影及曝光。以β-actin作为内参照。白灰度分析使用的软件是Image J,表达公式:目的蛋白/内参。
1.4.5 MTT法检测细胞对5-Fu敏感性 按5000个/100 μL浓度,将细胞种植在96孔板上,加入0.08、0.40、2.00、10.00、50.00 μg/mL的5-Fu,并设置空白对照和未加药对照。所有细胞培养72 h 后,将浓度为5 μg/L的MTT加入孔中,使每孔最终体积为20 μL。将96孔板放置于37℃温箱中进行孵育,时间为4 h。孵育结束后,向孔中加入DMSO,体积为150 μL。震荡后,利用酶联免疫检测仪检测每孔在490 nm 波长处的吸光度(D)值。以公式细胞抑制率(%)=(未加药物孔D 值-加药物孔D 值)/(未加药物孔D 值-空白孔D值)×100%。计算细胞增殖抑制率。利用Biss 法计算IC50值。
1.5 统计学方法
采用SPSS 22.0软件进行统计分析,mRNA相对表达量、IC50、相关蛋白表达量以(x±s)表示,采用独立样本t检验进行比较,P<0.05为差异有统计学意义。
2 结果
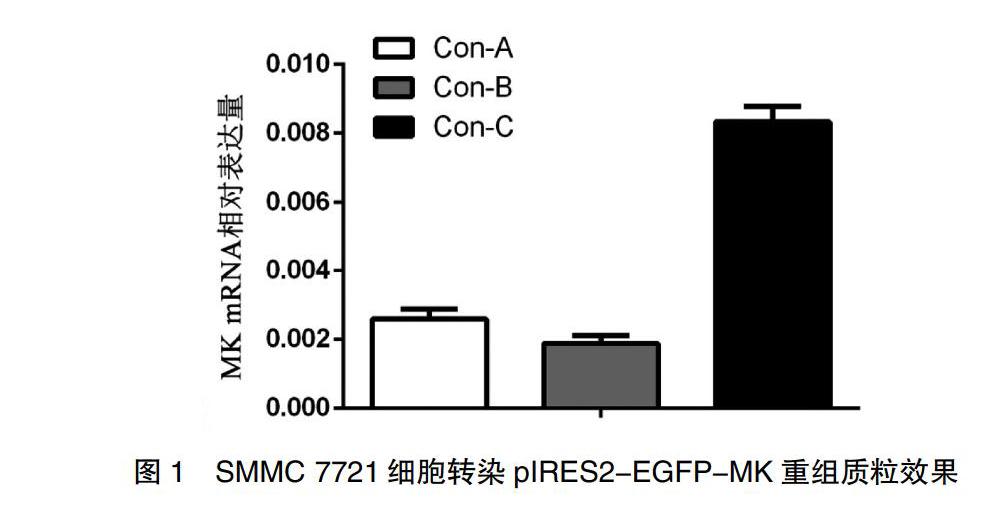
2.1 SMMC 7721细胞转染pIRES2-EGFP-MK重组质粒效果
qPCR检测MK mRNA表达结果显示,Con-C组(0.0071±0.0023)细胞MK mRNA表达水平高于Con-A组(0.0026±0.0004)和Con-B组(0.0019±0.0003)(图1),提示SMMC 7721细胞转染pIRES2-EGFP-MK重组质粒效果显著,MK mRNA表达增高,可以进行后续实验。
2.2 MK过表达SMMC 7721细胞对5-Fu的IC50
三组细胞分别处理后,Con-C组细胞对5-Fu的IC50[(27.36±4.31)mg/L]显著高于Con-A组[(4.57±0.34)mg/L](t=11.787,P=0.000)和Con-B组[(4.96±0.46)mg/L](t=11.556,P=0.000),差异具有统计学意义。提示过表达MK基因可显著增强SMMC 7721细胞对5-Fu的耐药。
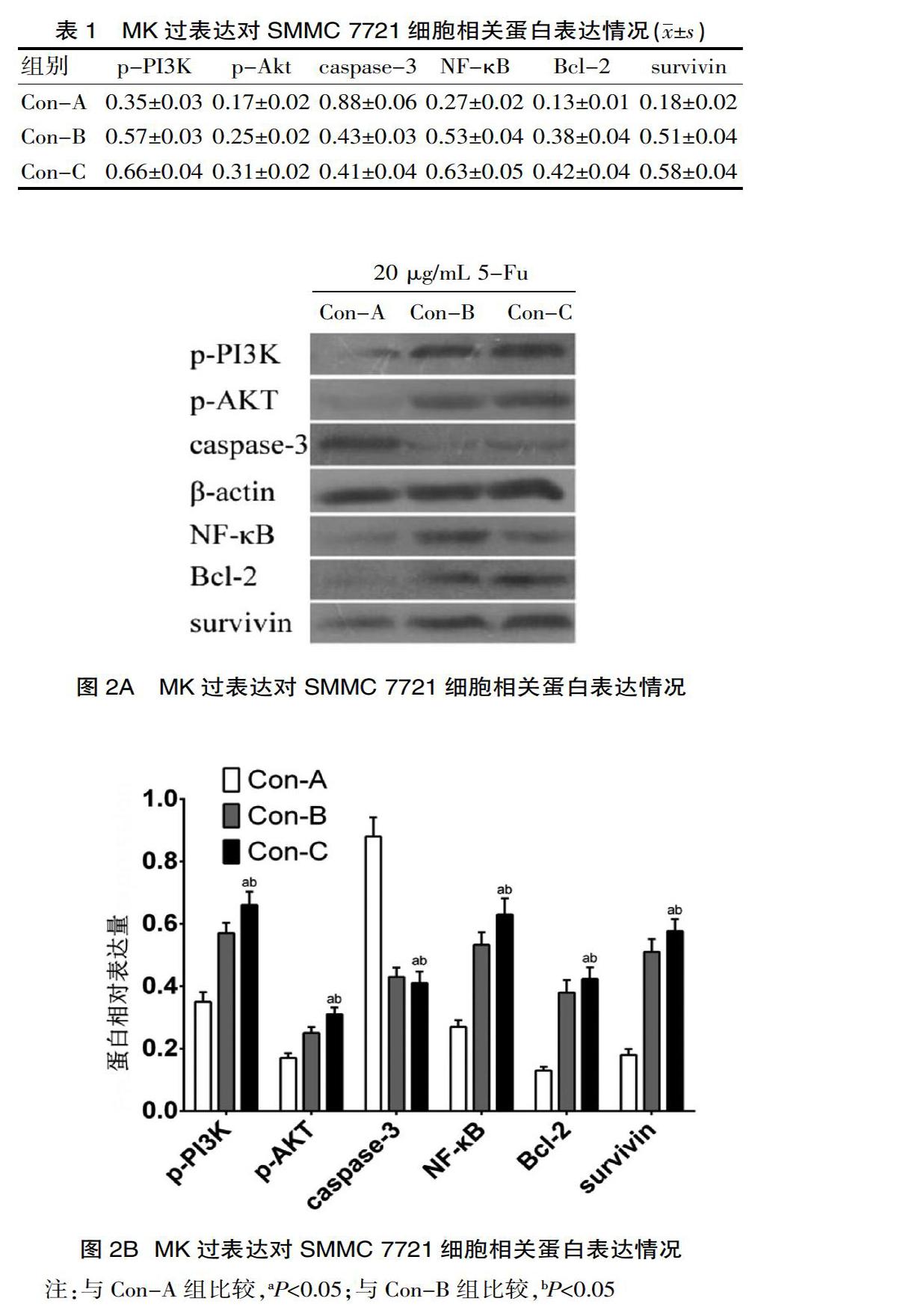
2.3 MK过表达对SMMC 7721细胞相关蛋白的影响
向三组细胞中加入20 μg/mL 5-Fu培养24 h,利用WB检测SMMC 7721细胞相关蛋白的表达水平。结果显示,与Con-A组和Con-B组比较,Con-C组细胞p-PI3K、p-Akt、NF-κB、Bcl-2、survivin呈现高表达,caspase-3呈现低表达,差异具有统计学意义(P<0.05)。见表1、图2A、图2B。
3 讨论
HCC是我国常见危害严重的恶性肿瘤,其病理过程及发病机制尚未完全明确。由于HCC早期症状不明显,确诊时往往已发展为中晚期,化疗成了HCC治疗不可或缺的重要手段。然而HCC化疗药物耐药是导致化疗失败的重要原因。
MK是一种具有多种功能的分泌型生长因子,随着胚胎发育,从广泛而高表达状态,逐渐降低表达并局限在肾脏[11]。既往研究证实,MK在神经元细胞生长、分化及其受损修复等方面发挥着重要的作用[12]。近年来,随着对MK基因研究的深入,学者们发现MK基因在肿瘤恶性生物学特征中也具有重要的作用。在乳腺癌[13]、肺癌[14]、胃癌[15]、结直肠癌[16]等众多恶性肿瘤中,表现为促癌基因的特性。此外,在肿瘤化疗药物耐药方面,MK基因表现出耐药基因的特性,其可能是一种新的肿瘤化疗药物耐药相关蛋白[15-16]。前期研究结果显示,沉默MK基因可增强肝癌Bel/Fu细胞对化疗药物的敏感性[7];而过表达MK可增强肝癌细胞对不同化疗药物的耐药性[17]。而关于MK基因耐药机制的研究尚处在起步阶段。PI3K/Akt信号通路是肿瘤发生发展的关键通路。目前,已有研究显示,PI3K/Akt信号通路参与了肝癌细胞耐药[18-20]。为进一步探索MK基因、肝癌细胞耐药和PI3K/Akt信号通路及相关蛋白之间的关系,本研究通过构建过表达MK肝癌细胞系,观察对5-Fu耐药及相关蛋白的影响。
本研究结果显示,SMMC 7721细胞转染pIRES2-EGFP-MK重组质粒后,其MK mRNA表达水平高于其他两组。提示SMMC 7721细胞转染pIRES2-EGFP-MK重组质粒效果显著,MK mRNA表达增高,可以进行后续实验。隨后,本研究利用MTT法检测细胞对5-Fu敏感性,结果显示,三组细胞分别处理后,转染pIRES2-EGFP-MK重组质粒组细胞对5-Fu的IC50显著高于其他两组。提示过表达MK基因可显著增强SMMC 7721细胞对5-Fu的耐药。为了进一步探讨其耐药机制,本研究观察了MK过表达对SMMC 7721细胞相关蛋白的影响,结果显示,与其他两组比较,转染pIRES2-EGFP-MK重组质粒组细胞的p-PI3K、p-Akt、NF-κB、Bcl-2、survivin表达水平呈现高表达,caspase-3表达水平呈现低表达。PI3K/Akt信号通路是一条经典的促进细胞增殖和抑制细胞凋亡的信号通路,在恶性肿瘤发生发展中发挥着重要的作用。该信号通路过度活化后,可引起多种恶性肿瘤的化疗药物耐药。NF-κB、Bcl-2、survivin及caspase-3是PI3K/Akt信号通路中相关的重要蛋白,受PI3K/Akt信号通路调控,其改变可能与MK过表达引起PI3K/Akt信号通路活化有关。
综上所述,初步推测过表达MK可增强SMMC 7721细胞对5-Fu耐药,其机制可能与激活PI3K/AKT信号通路有关。但由于上述基因之间存在复杂的Crosstalk,对于MK在肝癌化疗药物耐药中的机制研究仍任重道远。
[参考文献]
[1] De Martel C,Maucort-Boulch D,Plummer M,et al. World-wide relative contribution of hepatitis B and C viruses in hepatocellular carcinoma[J]. Hepatology,2015,62(4):1190-1200.
[2] Deng GL,Zeng S,Shen H. Chemotherapy and target therapy for hepatocellular carcinoma:New advances and challenges[J]. World Journal of Hepatology,2015,7(5):787.
[3] Kudo M,Ueshima K,Yokosuka O,et al. Sorafenib plus low-dose cisplatin and fluorouracil hepatic arterial infusion chemotherapy versus sorafenib alone in patients with advanced hepatocellular carcinoma(SILIUS):a randomised,open label,phase 3 trial[J]. The Lancet Gastroenterology & Hepatology,2018,3(6):424-432.
[4] Lohitesh K,Chowdhury R,Mukherjee S. Resistance a major hindrance to chemotherapy in hepatocellular carcinoma:An insight[J]. Cancer Cell International,2018,18(1):44.
[5] Zhang L,Song X,Shao Y,et al. Prognostic value of Midkine expression in patients with solid tumors:A systematic review and meta-analysis[J]. Oncotarget,2018,9(37):24821.
[6] Huang H,Li J,Lu Y,et al. Role of midkine-progranulin interaction during angiogenesis of hepatocellular carcinoma[J]. International Journal of Clinical and Experimental Pathology,2015,8(8):8809.
[7] 徐杰伟,慎华平,邱建,等. 沉默 MK 基因增强肝癌 Bel/Fu 细胞对 5-氟尿嘧啶的敏感性及可能的机制[J]. 肿瘤,2017,37(12): 1260-1267.
[8] Taniguchi K,Karin M. NF-κB,inflammation,immunity and cancer: Coming of age[J]. Nature Reviews Immunology,2018,18(5):309-324.
[9] Sui Y,Zheng X,Zhao D. Rab31 promoted hepatocellular carcinoma (HCC)progression via inhibition of cell apoptosis induced by PI3K/AKT/Bcl-2/BAX pathway[J]. Tumor Biology,2015,36(11): 8661-8670.
[10] Su C. Survivin in survival of hepatocellular carcinoma[J]. Cancer Letters,2016,379(2):184-190.
[11] Sun B,Hu C,Yang Z,et al. Midkine promotes hepatocellular carcinoma metastasis by elevating anoikis resistance of circulating tumor cells[J]. Oncotarget,2017,8(20):32523.
[12] Xing Y,Yang SD,Wang MM,et al. Electroacupuncture Alleviated Neuronal Apoptosis Following Ischemic Stroke in Rats via Midkine and ERK/JNK/p38 Signaling Pathway[J]. Journal of Molecular Neuroscience,2018,66(1):26-36.
[13] Giamanco NM,Jee YH,Wellstein A,et al. Midkine and pleiotrophin concentrations in needle biopsies of breast and lung masses[J]. Cancer Biomarkers,2017,20(3):299-307.
[14] Zhang F,Wang J,Zheng X,et al. Clinical value of jointly detection pleural fluid Midkine,pleural fluid adenosine deaminase,and pleural fluid carbohydrate antigen 125 in the identification of nonsmall cell lung cancer-associated malignant pleural effusion[J]. Journal of Clinical Laboratory Analysis,2018,32(8):e22576.
[15] Tian W,Shen J,Chen W. Suppression of midkine gene promotes the antitumoral effect of cisplatin on human gastric cancer cell line AGS in vitro and in vivo via the modulation of Notch signaling pathway[J]. Oncology Reports,2017,38(2):745-754.
[16] Krzystek-Korpacka M,Gorska S,Diakowska D,et al. Midkine is up-regulated in both cancerous and inflamed bowel,reflecting lymph node metastasis in colorectal cancer and clinical activity of ulcerative colitis[J]. Cytokine,2017,89(1):68-75.
[17] 慎華平,周轼瑜,徐杰伟,等. 中期因子过表达对肝癌细胞多药耐药的影响[J]. 中华普通外科杂志,2017,32(11):962-965.
[18] 杨颖,张瑞丽,杨志芳,等. GP73调控PI3K/Akt通路介导肝癌细胞索拉非尼耐药机制的实验研究[J]. 中华全科医学,2019,17(1):6-9,90.
[19] Sun Y,Cao FL,Qu LL,et al. MEG3 promotes liver cancer by activating PI3K/AKT pathway through regulating AP1G1[J]. European Review for Medical and Pharmacological Sciences,2019,23(4):1459-1467.
[20] Yang C,Hou A,Yu C,et al. Kanglaite reverses multidrug resistance of HCC by inducing apoptosis and cell cycle arrest via PI3K/AKT pathway[J]. Oncotargets and Therapy,2018,11(2):983-996.
(收稿日期:2019-03-12)

