ABT-737逆转EGFR T790M突变肺腺癌细胞EGFR-TKIs耐药的机制研究
应希旺 李亚清 冷报浪


[摘要] 目的 通過细胞和在体研究探讨ABT-737联合吉非替尼对EGFR T790M突变肺腺癌细胞EGFR-TKIs耐药的逆转机制。 方法 利用MTT和FCM 法检测ABT-737联合吉非替尼对RPC-9细胞的增殖和凋亡的影响,以RT-PCR检测细胞内Bim、Bak、Caspase-3 mRNA表达水平。以皮下异位移植法建立EGFR T790M突变肺腺癌裸鼠模型,对各组瘤体组织进行组织病理学检查、基因测序法检测、Real-time PCR和免疫组织化学法分析Bim、Bak、Caspase-3 mRNA及蛋白表达水平。 结果 ABT-737联合吉非替尼对RPC-9细胞有生长抑制作用和凋亡作用,且在ABT-737浓度4 μmol/L范围内呈浓度依赖性,最大抑制率为(54.113±2.986)%,最大凋亡率为(55.042±3.151)%,差异均有统计学意义(P<0.05);Bim、Bak及Caspase-3 mRNA表达水平随着ABT-737浓度的升高而增加(P<0.05)。各组瘤体组织病理均为腺癌;ABT-737联合吉非替尼灌胃组裸鼠瘤体体积较其他组小(P<0.05),Bim、Bak、Caspase-3 mRNA和蛋白表达水平较其他组显著增高(P<0.05)。 结论 ABT-737能增强吉非替尼促细胞凋亡作用,使耐药细胞重新发生凋亡。
[关键词] 肺腺癌;ABT-737;T790M突变;吉非替尼耐药逆转;裸鼠模型
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-9701(2019)18-0009-06
[Abstract] Objective To investigate the reversal mechanism of ABT-737 combined with gefitinib in reversing EGFR-TKIs resistance of EGFR T790M mutant lung adenocarcinoma cells by cell and in vivo studies. Methods The effect of ABT-737 combined with gefitinib on proliferation and apoptosis of RPC-9 cells were detected by MTT and FCM. The expression levels of Bim, Bak and Caspase-3 mRNA were detected by RT-PCR. The nude mouse model of EGFR T790M mutant lung adenocarcinoma was established by subcutaneous ectopic transplantation. The expression levels of Bim, Bak and Caspase- 3 mRNA and protein were analyzed by histopathological examination, gene sequencing detection, Real-time PCR and immunohistochemical analysis. Results ABT-737 combined with gefitinib had growth inhibition and apoptosis effects on RPC-9 cells, and was concentration-dependent in the range of 4 μmol/L of ABT-737. The maximum inhibition rate was(54.113±2.986)%. The maximum apoptotic rate was(55.042±3.151)%, and the difference was statistically significant(P<0.05). The expression levels of Bim, Bak and Caspase-3 mRNA increased with the increase of ABT-737 concentration(P<0.05). The histopathology of each group was adenocarcinoma. The volume of tumor in nude mice of ABT-737 combined with gefitinib intragastrical administration group was smaller than that of other groups(P<0.05), and the expression levels of Bim, Bak and Caspase-3 mRNA and protein in this group were significantly higher than those of the other groups(P<0.05). Conclusion ABT-737 can enhance the apoptosis of gefitinib and make the resistant cells re-apoptosis.
[Key words] Lung adenocarcinoma; ABT-737; T790M mutation; Gefitinib resistance reversal; Nude mouse model
肺癌是全球死亡率最高的恶性肿瘤[1],其中约80%是非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。癌症早期患者主要通过手术治疗,但是仍然存在很高的复发率[3]。靶向药物的出现明显延长晚期NSCLC患者的生存时间[4],但又面临广泛的耐药问题。EGFR酪氨酸激酶抑制剂(epidermal growth factorreceptor tyrosine kinase inhibitor,EGFR-TKIs)可阻断EGFR分子内酪氨酸的自磷酸化及酪氨酸激酶活化,抑制EGFR激活,因此抑制肿瘤增殖和转移[4,5]。EGFR-TKIs耐药机制主要有T790M基因突变、Bim多态性缺失、C-Met基因扩增等,而EGFR基因20外显子T790M 的二次突变,约占50%[6]。吉非替尼是第一代EGFR-TKIs,取得良好的治疗效果的同时也面临严重的耐药问题。Bim属于Bcl-2家族促生存成员的死亡配体,主要通过线粒体途径激活Bax/Bak诱导细胞凋亡[7]。有报道显示,EGFR突变NSCLC患者在吉非替尼等靶向药物治疗时,Bim表达缺失与耐药性相关[8-10]。ABT-737是Bim高效模拟物,本研究将通过细胞和在体研究ABT-737和EGFR T790M突变在人肺腺癌EGFR-TKI耐药机制中的作用,为解决肺腺癌EGFR-TKI耐药问题提供新的策略。
1 资料与方法
1.1 ABT-737逆转EGFR T790M突变所致EGFR-TKIs耐药的细胞研究
1.1.1 细胞来源 对吉非替尼敏感的人肺腺癌细胞株PC-9从美国ATCC公司购买获得。参考Ogino A等[11]报道方法并改进,对PC-9细胞应用大剂量吉非替尼冲击结合逐步递增浓度体外诱导法建立对吉非替尼耐药的EGFR T790M突变细胞株RPC-9(实验时间为2016年2月20日~12月25日)。
1.1.2 MTT法 将RPC-9细胞加入96孔板中,置于培养箱24 h后换液,Ⅰ组加入相应浓度的ABT-737,Ⅱ组加入ABT-737和吉非替尼,ABT-737浓度(0、0.5、1、2、4、8、16 μmol/L)依次递增,吉非替尼终浓度为10 μmol/L;每组设5个复孔,实验终止前4 h加入20 mL MTT液,离心倒掉培养液,每孔加入100 μL DMSO终止反应,置于37℃振荡1~5 min,镜下观察结晶全部溶解。在自动酶标仪上以测定波长570 nm测定各孔吸光度值(OD值)。取各孔吸光度平均值,计算两组细胞抑制率。结果来自于3 次实验。公式:细胞存活率=(实验组OD值-本底OD值)/(对照组OD值-本底OD值)×100%。细胞生长抑制率=1-细胞存活率。
1.1.3 流式细胞术(FCM)检测细胞凋亡 将RPC-9细胞加入12孔板中,置于培养箱24 h后换液,实验组加入ABT-737和吉非替尼,ABT-737浓度(0、0.5、1、2、4、8、16 μmol/L)依次递增,而吉非替尼终浓度始终为10 μmol/L;对照组加入相应浓度的ABT-737 24 h后,收集用药物处理过的细胞,悬浮细胞,收集(1~5)×105细胞,加入500 μL的Binding buffer悬浮细胞,加入5 μL Annexin V-APC混匀后,加入5 μL 7-AAD染液,用流式细胞仪(Becton Dickinson 公司)检测。
1.1.4 RNA提取和Real-time RT-PCR RT-PCR检测Bim、Bak及Caspase-3 mRNA表达:将RPC-9细胞加入12孔板中,置于培养箱24 h后换液,实验组加入ABT-737和吉非替尼,ABT-737浓度(0、0.5、1、2、4、8、16 μmol/L)依次递增,而吉非替尼终浓度始终为10 μmol/L;对照组加入相应浓度的ABT-737。24 h后,收集用药物处理过的细胞,以TRIzol提取总RNA;按Takala试剂盒说明合成cDNA:按照SYBRR Premix Ex TaqTM Ⅱ试剂盒说明进行qRT-PCR检测Bim、Bak、Caspase-3 mRNA表达差异。见表1。
1.2 ABT-737逆转EGFR T790M突变所致EGFR-TKIs耐药的在体研究
1.2.1 构建RPC-9细胞裸鼠移植瘤模型 将RPC-9细胞浓度调整为 1×107个/mL;SPF(specific pathogen-free)级BALB/C-nu裸小鼠28只由浙江中医药大学动物实验研究中心在SPF级屏障系统中分笼饲养。本研究经浙江中医药大学实验动物伦理委员会批准(实验时间为 2017年3月2日~3月30日)。在SPF级屏障系统中用75%酒精消毒裸鼠右肩背部皮肤,皮下注射 0.3 mL RPC-9细胞悬液,接种细胞数为 3×106个/只。移植瘤长径及短径以公式(V=πab2/6)计算肿瘤体积。接种后第7天裸鼠背部移植瘤長至约100 mm3,随机分组实验。将裸鼠随机分为Ⅰ空白对照组、Ⅱ吉非替尼组、ⅢABT-737组、ⅣABT-737+吉非替尼组,每组7只。每隔2日灌胃给药1次,共给药8次。
Ⅰ空白对照组:每隔2日灌胃生理盐水300 μL/只。Ⅱ吉非替尼组:每隔2日灌胃给药300 μL/只,吉非替尼22.2 mg/kg。ⅢABT-737组:每隔2日灌胃给药300 μL/只,ABT-737 22.2 mg/kg。ⅣABT-737+吉非替尼组:每隔2日灌胃给药300 μL/只,ABT-737+吉非替尼分别22.2 mg/kg。共给药 8次。
1.2.2 测定裸鼠移植瘤大小 观察裸鼠一般情况。每次灌胃前测量裸鼠肿瘤长短径。于末次灌胃给药后次日,脱颈处死裸鼠,剥离移植瘤,并计算移植瘤体积。 1.2.3 RT-PCR法 检测移植瘤组织中 Bim、Bak、Caspase-3表达(方法同细胞实验)。
1.2.4 组织病理学检测 将裸鼠瘤体组织石蜡切片常规脱蜡脱水,行苏木素-伊红(HE)染色:烤片,二甲苯透明、经梯度乙醇脱水置换后,HE染色,二甲苯透明后封片。图文分析仪分析每例切片。
1.2.5 免疫组化法 裸鼠瘤体组织石蜡切片常规脱蜡脱水,3% H2O2室温封闭,高压抗原修复,山羊血清封闭液封闭,稀释的Bim、Bak及Caspase-3抗体4℃过夜,24 h后辣根酶标记山羊抗兔 IgG 聚合物孵育30 min,后DAB染色,苏木素复染,镜像观察。
1.3 统计学分析
采用统计学软件SPSS20.0分析数据,计量资料以(x±s)表示,组间比较采用t检验,计数资料比较采用χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 ABT-737逆转EGFR T790M突变所致EGFR-TKIs耐药的细胞研究
2.1.1 RPC-9细胞EGFR基因检测 RPC-9细胞EGFR基因E20发生突变,核苷酸变化c.2369C>CT;氨基酸变化790T>T/M(图1)。
A.EGFR-E19参考峰;B.RPC-9细胞EGFR-E19测序峰;C.EGFR-E20参考峰;D.RPC-9细胞EGFR-E20测序峰。RPC-9细胞EGFR-E20核苷酸变化c.2369C>CT;氨基酸变化790T>T/M
2.1.2 MTT法檢测细胞抑制率 Ⅰ组各种浓度的ABT-737和Ⅱ组ABT-737联合吉非替尼组(10 μmol/L)均能抑制RPC-9细胞增殖,24 h细胞增殖抑制率ABT-737联合吉非替尼组明显高于单一ABT-737用药组(表2),在4 μmol/L范围内均呈浓度依赖性,差异具有显著统计学意义(P<0.05),且0.5 μmol/L、1 μmol/L、2 μmol/L、4 μmol/L浓度组内及组间差异均有统计学意义(P<0.05)。随着浓度的继续升高,4 μmol/L、8 μmol/L及16 μmol/L,ABT-737联合吉非替尼(4 μmol/L)对RPC-9细胞的增殖抑制率无明显继续提高,差异无统计学意义。见表2、图2。
2.1.3 流式细胞术(FCM)检测细胞凋亡 ABT-737联合吉非替尼(10 μmol/L)作用RPC-9细胞24 h后,不同浓度的ABT-737各组细胞均发生不同程度的凋亡(表3),凋亡率在4 μmol/L内随ABT-737浓度升高而升高,呈剂量依赖性。0.5 μmol/L、1 μmol/L、2 μmol/L、4 μmol/L ABT-737联合吉非替尼(10 μmol/L)药物浓度比较细胞凋亡率上升明显,差异具有统计学意义(P<0.05),随着药物浓度提高至8 μmol/L及16 μmol/L时,细胞已大部分发生凋亡及坏死,凋亡率较4 μmol/L浓度组无明显变化,差异无统计学意义(P>0.05)。见表3、图3。
2.1.4 RT-PCR检测Bim、Bak及Caspase-3 mRNA表达 0.5 μmol/L、1 μmol/L、2 μmol/L、4 μmol/L ABT-737联合吉非替尼(10 μmol/L)药物浓度两两比较Bim、Bak及Caspase-3 mRNA表达上升明显,差异具有统计学意义(P<0.05),随着药物浓度提高至8 μmol/L及16 μmol/L时,Bim、Bak及Caspase-3 mRNA表达水平无明显变化,差异无统计学意义(P>0.05)。见表4、图4。
2.2 ABT-737逆转EGFR T790M突变所致EGFR-TKIs耐药的在体研究
2.2.1 裸鼠移植瘤大小测定 接种12 d后Ⅳ组裸鼠移植瘤体积明显低于Ⅰ、Ⅱ、Ⅲ组,差异有统计学意义(P<0.05)。Ⅱ、Ⅲ组较Ⅰ组裸鼠移植瘤体积稍小,但组间差异无统计学意义(P>0.05)。见表5,图5、6。
Ⅳ组裸鼠移植瘤体积明显小于Ⅰ、Ⅱ、Ⅲ组,差异有统计学意义(P<0.05)。Ⅰ、Ⅱ、Ⅲ组裸鼠移植瘤体积在接种后12 d后生长速度加快,Ⅰ、Ⅱ、Ⅲ组裸鼠移植瘤体积组间差异不明显,差异无统计学意义(P>0.05)。
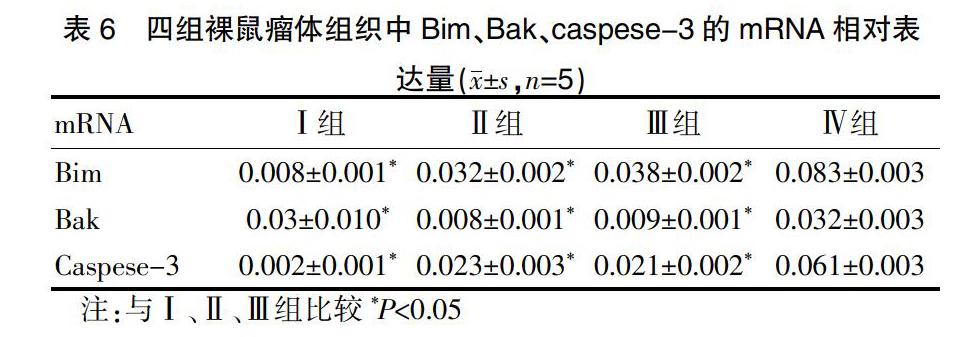
2.2.2 检测裸鼠移植瘤组织Bim、Bak及Caspase-3 mRNA表达 Ⅳ组裸鼠移植瘤组织Bim、Bak及Caspase-3 mRNA表达上升明显,与Ⅰ、Ⅱ、Ⅲ组组间比较差异具有统计学意义(P<0.05),Ⅱ、Ⅲ组较Ⅰ组稍增高,差异无统计学意义(P>0.05)。见表6、图7。
2.2.3 组织病理学检测 各组裸鼠移植瘤组织病理均为低分化腺癌,且肿瘤组织包膜完整,肿瘤细胞呈弥散片状分布、排列紧密,呈腺样或条索状排列,见局灶性坏死。肿瘤细胞核大深染,呈圆形,核仁明显,见核分裂象,胞质丰富(封三图2)。
2.2.4 免疫组化法检测Bim、Bak及Caspase-3蛋白表达 细胞浆Bim、Bak及Caspase-3蛋白着黄棕色,为阳性细胞,细胞浆未着色为阴性。采用半定量方法测定Bim、Caspase-3蛋白表达。选取5个高倍镜视野(200倍)计数瘤体组织中Bim、Bak及Caspase-3表达阳性细胞数,分为以下4个等级:0级≤5%,5%<1级≤25%,26%<2级≤60%,3级>60%。阳性强度淡黄色为1分,黄色为2分,棕黄色为3分。两个相乘,0~3分为阴性(-),4~l2分为阳性(+)。Ⅱ、Ⅲ、Ⅳ组为阳性,Ⅰ组为阴性(封三图3、4、5)。
3 讨论
Bim在人体多种组织中均有不同程度的表达,在预防自身免疫、维持造血细胞稳态及调控肿瘤的发生中均起着重要作用[12-14]。人们研究发现,在恶性肿瘤细胞中,Bim表达的下降会抑制肿瘤细胞的凋亡作用,从而加速肿瘤的发生、发展[15-17]。许多研究表明Bim在肺癌靶向治疗效果显著主要是在肿瘤细胞凋亡中发挥关键作用。EGFR TKIs的继发性耐药是分子靶向治疗所面临的最严重问题。Ng等[18]通过聚合酶链反应(polymerase chainreaction,PCR)证实在EGFR-TKIs耐药的EGFR突变型非小细胞肺癌HCC2279细胞中存在Bim基因的缺失多态性。学者们研究发现在吉非替尼等靶向药物治疗敏感的EGFR突变NSCLC患者中,Bim表达明显上调,而对治疗不敏感者Bim表达无上调,Bim基因敲除后阻断吉非替尼对突变细胞的凋亡作用[19,20]。我们在前期试验中成功培养了EGFR T790M突变致吉非替尼耐药肺腺癌细胞RPC-9,基因测序法检测显示EGFR基因E20发生突变,E20核苷酸变化为:c.2369C>CT;氨基酸变化为:790T>T/M。本研究中,ABT-737单独用药能够对RPC-9细胞产生生长抑制作用[最大抑制率(11.036±0.992)%],而且呈浓度依赖性,但是作用效果有限。当ABT-737联合吉非替尼(10 μmol/L)作用细胞时,对RPC-9细胞的生长抑制作用[最大抑制率(57.594±3.271)%]明显强于ABT-737单独用药。我们通过流式细胞术进一步验证了ABT-737联合吉非替尼(10 μmol/L)对RPC-9细胞的促凋亡作用,发现不同浓度的ABT-737联合吉非替尼对RPC-9细胞均有作用,在4 μmol/L范围时,呈剂量依赖性,差异具有统计学意义(P<0.05),随着药物浓度提高至8 μmol/L及16 μmol/L时,细胞已大部分发生凋亡及坏死,凋亡率较4 μmol/L浓度组无明显变化,差异无统计学意义(P>0.05)。本文还通过RT-PCR检测RPC-9细胞,发现ABT-737联合吉非替尼组较ABT-737单独用药组Bim、Bak、Caspase-3 mRNA表达均显著升高。
本研究通过皮下移植法成功建立EGFR T790M突变肺腺癌裸鼠模型,为进一步研究肺腺癌EGFR TKIs的继发性耐药机制提供工具。本文通过动物实验发现吉非替尼灌胃组(Ⅱ组)、ABT-737灌胃组(Ⅲ组)较空白对照组(Ⅰ组)裸鼠瘤体体积稍小,裸鼠食欲、活动能力也较强;而ABT-737联合吉非替尼灌胃组(Ⅳ组)裸鼠食欲、活动能力较其他各组明显更强,瘤体体积也较其他组小,其中3只裸鼠瘤体体积较自身灌胃前稍有变小,其余4只裸鼠瘤体体积生长也较其他组裸鼠瘤体明显变小。我们通过裸鼠瘤体组织RT-PCR和免疫组化发现,Ⅳ组裸鼠瘤体组织中Bim、Bak、Caspase-3 mRNA及蛋白表达最高,Ⅱ、Ⅲ组次之(差异无统计学意义,P>0.05),Ⅰ组最低,其结果与细胞实验结果一致。因此,我们认为,可能是由于ABT-737使RPC-9细胞内凋亡通路中Bim的表达显著升高,促进EGFR-MAPK-ERK信号途径的抑制,增加了吉非替尼的促细胞凋亡的作用,引起促凋亡蛋白Bak的释放,Caspase系统的激活,最终使原先发生EGFR-TKIs耐药的RPC-9细胞重新死亡,从而逆转了EGFR T790M突变所致的EGFR-TKIs的耐药作用。
有研究發现[21]BH3模拟物联合二代TKIs在增强治疗效果的同时可减少耐药性和不良反应,这提示BH3模拟物联合TKIs有望成为一种新型的治疗方法。NSCLC将来的治疗,我们可以将Bim作为临床治疗NSCLC的分子靶点或联合其他药物治疗吉非替尼耐药的新思路。采用不同途径、多个靶点的联合治疗,最大发挥药物疗效同时减少耐药的发生。
[参考文献]
[1] Siegel RL,Miller KD,Jemal A. Cancer statistics,2016[J]. CA Cancer J Clin,2016,66(1):7-30.
[2] Siegel R,Naishadham D,Jemal A. Cancer statistics,2013[J].CA Cancer J Clin,2013, 63(1):11-30.
[3] Sacco JJ,Al-Akhrass H,Wilson CM. Challenges and strategies in precision medicine for non-small-cell lung cancer[J]. Curr Pharm Des,2016,22(28):4374-4385.
[4] Kao HF,Lin CC,Yang JC. EGFR inhibitors as the first-line systemic treatment for advanced non-small-cell lung cancer[J]. Future Oncol,2013,9(7):991-1003.
[5] Goffin JR,Zbuk K. Epidermal growth factor receptor:pathway,therapies,and pipeline[J]. Clin Ther,2013,35(9):1282-1303.
[6] Stewart EL,Tan SZ,Liu G,et al. Known and putative mechanisms of resistance to EGFR targeted therapies in NSCLC patients with EGFR mutations-a review[J]. Transl Lung Cancer Res,2015,4(1):67-81.
[7] Faber AC,Ebi H,Costa C,et al. Apoptosis in targeted therapy responses:The role of BIM[J]. Adv Pharmacol,2012, 65:519-542.
[8] Fan W,Tang Z,Yin L,et al. MET-independent lung cancer cells evading EGFR kinase inhibitors are therapeutically susceptible to BH3 mimetic agents[J]. Cancer Res,2011, 71(13):4494-4505.
[9] Cragg MS,Kuroda J,Puthalakath H,et al. Gefitinib-induced killing of NSCLC cell lines expressing mutant EGFR requires BIM and can be enhanced by BH3 mimetics[J]. PLoS Med,2007,4(10):1681-1689.
[10] Sakakibara-Konishi J,Oizumi S,Kikuchi J,et al. Expression of Bim,Noxa,and Puma in non-small cell lung cancer[J]. BMC Cancer,2012,12:286.
[11] Ogino A,Kitao H,Hirano S,et al. Emergence of epidermal growth factor receptor T790M mutation during chronic exposure to gefitinib in a non small cell lung cancer cell line[J]. Cancer Res,2007,67(16):7807-7814.
[12] Akiyama T,Tanaka S. Bim:guardian of tissue homeostasis and critical regulator of the immune system,tumorigenesis and bone biology[J]. Arch Immunol Ther Exp(Warsz), 2011, 59(4):277-287.
[13] Gillings AS,Balmanno K,Wiggins CM,et al. Apoptosis and autophagy:BIM as a mediator of tumour cell death in response to oncogene-targeted therapeutics[J]. Febs J, 2009,276(21):6050-6062.
[14] Sionov RV,Vlahopoulos SA,Granot Z. Regulation of Bim in Health and Disease[J]. Oncotarget,2015,6(27):23058-23134.
[15] Lqi Y,Deutzmann A,Choi PS,et al. BIM mediates oncogene inactivation-induced apoptosis in multiple transgenic mouse models of acute lymphoblastic leukemia[J]. Onco-target,2016,7(19):26926-26934.
[16] Gray DH,Kupresanin F,Berzins SP,et al. The BH3-only proteins Bim and Puma cooperate to impose deletional tolerance of organ-specific antigens[J]. Immunity,2012, 37(3):451-462.
[17] Bean GR,Ganesan YT,Dong Y,et al. PUMA and BIM are required for oncogene inactivation-induced apoptosis[J].Sci Signal,2013,6(268):20.
[18] Ng KP,Hillmer AM,Chuah CT,et al. A common BIM deletion polymorphism mediates intrinsic resistance and inferior responses to tyrosine kinase inhibitors in cancer[J].Nat Med,2012,18(4):521-528.
[19] Li Z,Zhou S,Zhang L,et al. BIM induction of apoptosis triggered by EGFR-sensitive and resistance cell lines of non-small-cell lung cancer[J]. Med Oncol,2011,28(2): 572-577.
[20] Krysan K,Cui X,Gardner BK,et al. Elevated neutrophil gelatinase-associated lipocalin contributes to erlotinib resistance in non-small cell lung cancer[J]. Am J Transl Res, 2013,5(5):481-496.
[21] Ko TK,Chin HS,Chuah CT,et al. The BIM deletion polymorphism:A paradigm of a permissive interaction between germline and acquired TKI resistance factors in chronic myeloid leukemia[J]. Oncotarget,2016,7(3):2721-2733.
(收稿日期:2019-03-12)

