功能性便秘幼儿肠道菌群的16SrDNA和REP-PCR检测分析及效果评价
王帆 王娟 翁明瑶 尹燕 文革生


[摘要] 目的 研究功能性便秘幼兒肠道菌群的16SrDNA和细菌基因组重复序列PCR技术(repetitive-element PCR,REP-PCR)检测分析及效果评价。 方法 选取我院2018年1~12月收治的功能性便秘患儿80例作为观察组,同期选取我院正常幼儿80例作为对照组。应用16SrDNA片段扩增和REP-PCR技术对两组幼儿的粪便进行检测分析,并对观察组患儿进行益生菌治疗。比较两组幼儿的肠道常驻菌及优势菌群在门和在属水平的差异性,计算出16SrDNA和REP-PCR检测的灵敏度和特异度。 结果 对照组肠道菌群中放线菌门水平明显低于观察组,对照组肠道菌群中变形菌门水平明显高于观察组(P<0.05),两组肠道菌群中无壁菌门、厚壁菌门、拟杆菌门、梭菌属门水平比较无明显差异(P<0.05);对照组肠道菌群中副杆状菌属、拟杆菌属水平明显低于观察组,对照组肠道菌群中普氏菌属水平明显高于观察组(P<0.05);16SrDNA检测的灵敏度为87.17%,特异度为92.03%,REP-PCR检测的灵敏度为85.29%,特异度为84.25%。 结论 应用16SrDNA和REP-PCR检测分析功能性便秘幼儿肠道菌群具有重要价值,患儿肠道菌群表现为放线菌门、副杆状菌属、拟杆菌属水平升高,变形菌门、普氏菌属水平降低,对治疗起到指导作用,值得在临床推广。
[关键词] 功能性便秘幼儿;肠道菌群;16SrDNA;REP-PCR
[中图分类号] R723.14 [文献标识码] A [文章编号] 1673-9701(2019)18-0001-04
[Abstract] Objective To study the detection analysis and effect evaluation on 16SrDNA and bacterial genome repetitive-element PCR(repetitive-element PCR, REP-PCR) for intestinal flora in children with functional constipation. Methods 80 children patients with functional constipation who were admitted to our hospital from January to December 2018 were selected as the study subjects and were assigned to the observation group. In the same period, 80 healthy children in our hospital were selected as the control group. The fragment amplification of 16SrDNA and REP-PCR techniques were used to detect and analyze the feces of the two groups of children, and the probiotics was used for treatment in the observation group. The differences were compared between the two groups of intestinal resident bacteria and dominant bacteria at the levels of phylum and genus. The sensitivity and specificity of 16SrDNA and REP-PCR detection were calculated. Results The level of Actinobacteria in the intestinal flora in the control group was significantly lower than that in the observation group. The level of Proteobacteria in the intestinal flora in the control group was significantly higher than that in the observation group(P<0.05). There were no significant differences in the levels of Mycobacterium, Absidia, Bacteroides and Clostridium in the intestinal flora between the two groups(P<0.05); in the control group, the levels of Parabacteroides and Bacteroides in the intestinal flora were significantly lower than those in the observation group. The level of Plasmodium in the intestinal flora in the control group was significantly higher than that in the observation group(P<0.05); the sensitivity of 16SrDNA was 87.17%, and the specificity was 92.03%. The sensitivity of REP-PCR was 85.29%, and the specificity was 84.25%. Conclusion It is of a great value to analyze the intestinal flora of children with functional constipation by 16SrDNA and REP-PCR techniques. The intestinal flora of the children patients shows an increase in the levels of Actinobacteria, Parabacteroides, and Bacteroides, and an decrease in the levels of Proteobacteria and Plasmodium. It plays a guiding role in treatment and is worthy of clinical promotion.
[Key words] Functional constipation; Intestinal flora; 16SrDNA; REP-PCR
功能性便秘(functional constipation,FC)是常见于婴幼儿时期的一种便秘类型,继发于代谢病等非器质性疾病,FC发病率受环境、地域、饮食等多种因素影响[1]。FC最初常见于中老年人,但随着全球快速变化的生活习惯和饮食结构,FC总体发病率提高,据调查,现阶段婴幼儿发病率也已高达29.6%[2]。临床上,排便难、粪便硬等是FC患儿最主要的临床表现,当FC患儿相继出现恶化、腹胀、呕吐、肠梗阻和穿孔等严重不良反应,食欲不振是患儿常见伴发症状,严重影响婴幼儿的生长发育。一直以来,关于FC的治疗,效果并不明显,临床主要以饮食调整及针对性去除病因为主。据报道,功能性便秘患儿的肠道菌群的改变是疾病的重要标志,其可对疾病的发病机制进行一定解释[3-4]。因此,对患儿肠道菌群的构成及比例进行检测,成为临床主要的检测手段,同时,也衍生出通過调节菌群平衡治疗疾病的方法[5]。以往,临床通过对细菌的培养进行病原微生物的鉴定,该过程复杂繁琐,耗费时间长达4 d,极易导致患儿不能及时就诊,限制临床的发展,因此目前临床致力于更高效的检测手段的探索[6]。近阶段分子生物学得到飞速进展,临床上逐渐开始使用可代表生物结构和功能的生物标志物进行检测,最常见的有DNA、RNA、蛋白质等[7]。目前临床依据原核生物中普遍存在16S rDNA基因短序列和细菌基因组内短重复序列,提出16SrDNA和REP-PCR两种分离鉴定微生物的方法[8-9]。然而,关于利用该方法对微生态菌群进行分析的报道尚不多见[10]。因此,本研究采用16SrDNA和REP-PCR对功能性便秘幼儿的肠道菌群进行检测分析,并分析治疗效果,旨在为临床提供指导。
1 资料与方法
1.1 一般资料
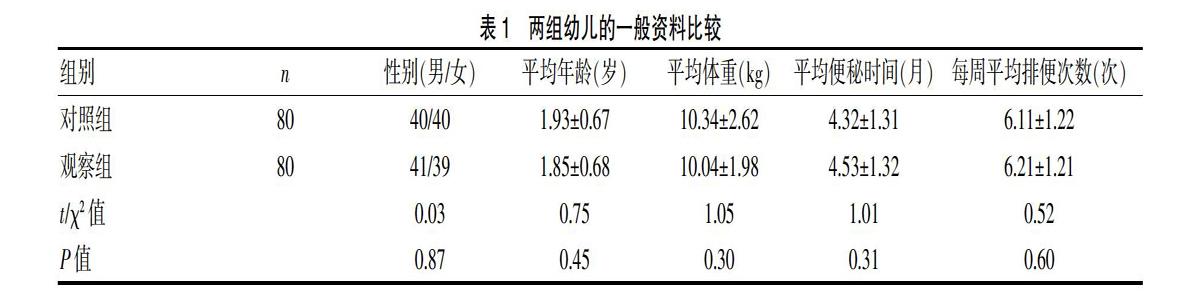
选取我院2018年1~12月收治的功能性便秘患儿80例作为观察组,均符合2016年儿童功能性胃肠病罗马Ⅳ诊断标准[11],年龄<4岁的儿童至少符合以下2项条件,持续时间达1个月:①每周排便≤2次;②大量粪便潴留史;③有排便疼痛和排便费力史;④排粗大粪便史;⑤直肠内存在大量粪便团块。对于接受排便训练的儿童,以下条件也作为选项:①能控制排便后每周至少出现1次大便失禁;②粗大粪便曾堵塞抽水马桶。所有患儿均排除器质性病变,病程达1个月以上,患儿家属均自愿参加并签署知情同意书。排除标准:①合并有严重的先天性基础器官缺陷畸形者;②合并有严重的恶性肿瘤者;③伴有严重血液性疾病者。同期选取我院正常幼儿80例作为对照组,两组幼儿的一般资料比较均无显著性差异(P>0.05),具有可比性,见表1。
1.2 方法
收集所有研究对象排便后4 h内的粪便置于密闭避光的粪便储存器内作为粪便标本待检测,随机迅速将装有粪便标本的粪便储存器置于-80℃的低温冰箱内保存待检,检测时从标本中称取0.2 g粪便(不足0.2 g者记录具体重量),并用QIAamp DNA Stool Mini Kit(QIAGEN)(北京鸿跃创新科技有限公司)从粪便细菌基因组中分离纯化提取DNA,按说明书进行操作,提取后迅速置于-20℃环境下保存待用。
1.2.1 16SrDNA检测 首先,采用1%琼脂糖凝胶电泳对基因组DNA进行检测抽提;其次,利用聚合酶链反应(PCR)法进行扩增,并用2%的琼脂糖凝胶电泳检测混合后的同一样本的PCR产物,并采用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)对PCR产物进行切胶回收,随即采用Tris-HCl对其进行洗脱;然后,根据电泳检测的初步定量结果,采用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)对PCR产物进行检测定量,随即根据每个样本的测序量具体要求,对其按比例进行混合;最终,构建Illumina平台文库,并采用Illumina平台测序。
1.2.2 REP-PCR检测 采用BOX-PCR、ERIC-PCR、ERIC2-PCR、(GTG)5-PCR进行细菌基因组内重复序列检测,同时采用REP-PCR技术对其进行分析。其中,BOX-PCR、ERIC2-PCR和(GTG)5-PCR采用单引物扩增,ERIC-PCR和REP -PCR采用双引物扩增。引物序列为:BOXA -1R 5′-CTACGGCAAGGCGACGCTGACG-3′;ERIC1f 5′-ATGTAAGCTCCTGGGGATTCAC-3′,ERIC2r 5′-AAGTAAGTGACTGGGGTGAGCG-3′(ERIC2r作为单引物用于ERIC2 -PCR);(GTG)5 5′-GTGGTGGTGGTGGTG -3′;REP1r 5′-IIIICGICGICATCIGGC -3′,REP2I 5′-ICGICTTATCIGGCCTAC-3′。所有引物均来自Invitrogen 公司(美国英杰生命技术有限公司)。扩增体系(50 μL)由50 ng DNA模板,1.5 U Hot Start Taq DNA聚合酶(TaKaRa,Dalian,China),1×PCR buffer(包含2.5 mmol/L MgCl2),2 mmol/L引物,200 mmol/L dNTP组成。REP-PCR 扩增过程:除预变性95℃ 7 min和最后65℃延伸16 min外,还需进行35个循环,每一循环的过程在94℃环境下进行3 s的变性,在92℃的环境下进行30 s的变性,随即退火1 min,并在65℃的环境下进行8 min的延伸。其中,REP-PCR和(GTG)5 -PCR应在40℃的环境下进行退火,ERIC-PCR、ERIC2-PCR和BOX-PCR应该在50℃的环境下退火。
1.2.3 凝胶电泳分析 采用1.5%的琼脂糖凝胶电泳对PCR扩增产物进行分离,随后应用溴化乙锭(EB)染色,并在5 V/cm的条件下电泳,时间为3 h,电泳结果在UVI全自动凝胶成像分析系统(UVItec)上拍照,最后采用Quantity One 1-D Analysis Software进行指纹图谱相似性分析。
1.3观察指标
①比较两组的肠道常驻菌及优势菌群在门水平差异性;②比较两组的肠道常驻菌及优势菌群在属水平差异性;③计算16SrDNA和REP-PCR检测的灵敏度和特异度:假设真阳性人数为a,假阳性人数为b,假阴性人数为c,真阴性人数为d,则灵敏度=[a/(a+c)]×100%,特异度=[d/(b+d)]×100%。
1.4统计学方法
采用SPSS21.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,采用t检验。计数资料以[n(%)]表示,采用Z检验,并绘制ROC曲线以AUC值评价各指标诊断价值,P<0.05为差异有统计学意义。
2 结果
2.1 两组的肠道常驻菌及优势菌群在门水平差异性比较
对照组肠道菌群中放线菌门(Actinobacteria)水平明显低于观察组(P<0.05),对照组肠道菌群中变形菌门(Proteobacteria)水平明显高于观察组(P<0.05),两组肠道菌群中无壁菌门(Tenericutes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭菌属门(Fusobacteria)水平比较无明显差异(P>0.05),见表2。
2.2 两组的肠道常驻菌及优势菌群在属水平差异性比较
对照组肠道菌群中副杆状菌属(Parabacteroides)、拟杆菌属(Bacteroides)水平明显低于观察组,对照组肠道菌群中普氏菌属(Prevotella_9)水平明显高于观察组(P<0.05),见表3。
2.3 两种检测方法的灵敏度和特异度比较
16SrDNA检测的灵敏度为87.17%,特异度为92.03%,REP-PCR检测的灵敏度为85.29%,特异度为84.25%,差异有统计学意义(P<0.01),见表4、封三图1。
3讨论
便秘是临床上常见的幼儿疾病,儿童便秘中约有95%为功能性便秘,其发病机制尚不清楚,治疗手段尚不成熟。功能性便秘的发生受饮食、地域等多方面影响,因此,时代的快速改变导致婴幼儿功能性便秘发病率迅速增高,目前已成为全球性疾病[12]。陈焕等[13]在报道中指出,尽早诊断及治疗是提高功能性便秘治疗效果的关键,能预防幼儿功能性便秘的恶化,同时能减少功能性便秘对幼儿生长发育的影响,具有重要的临床意义。因此,临床越发致力于功能性便秘的诊断和治疗。现阶段,多项报道指出,正常机体胃肠道中存在大量细菌并构成肠道微生态平衡,细菌种数多达500种,总数量高达1×1014个,而功能性便秘的发生受肠道菌群失衡的影响,表现为放线菌门、副杆状菌属、拟杆菌属水平升高,变形菌门、普氏菌属水平降低,可引起神经系统和肠功能改变,尤其当患儿处于0~3岁生长发育关键阶段时,治疗的不及时会严重阻碍患儿身体各系统的发育及智力的完善,大小便失禁成为患儿常见症状[14-15]。因此,通过对肠道菌群进行分析可为功能性便秘的临床检测和治疗提供新的方向。据研究,人粪便重量的60%是細菌,因此,肠道菌群的分析主要借助于粪便标本,是远端结肠腔内环境的主要代表[16]。以往,临床培养分离细菌的方法有较多局限,仅有25%的细菌能被检测出,敏感性差且受培养基影响大[17]。
功能性便秘患儿肠道菌群的分析为疾病的治疗提供了指导,基于患儿肠道菌群的改变,多项研究指出,可以通过菌群的调整来达到治疗效果,针对性更高。如李豪等[18]通过应用双歧杆菌三联活菌制剂联合常规药物治疗功能性便秘,总体疗效提高,且预后质量更佳。谢尚奎等[19]应用益生菌治疗便秘大鼠,恢复大鼠肠道菌群状态效果显著,并减少肠道排空时间。因此,通过分析患儿肠道菌谱并进行针对性的改变,是一种新的治疗理念,值得进一步研究。
近年来,随着分子生物学的发展,传统细菌培养逐渐被分子技术所取代。多项研究发现,几乎所有原核生物体内存在16SrDNA,最重要的是16SrDNA可以长久地保持其原有结构,并不随着生物进化而发生改变,因此,16SrDNA被临床用于检测肠道菌群,具有灵敏度、特异度高等优势,可以检测出绝大多数菌群。目前,已有少量研究将16SrDNA检测应用于菌群的分析,如李柏胜等[20]将16SrDNA检测用于肝硬化患者肠道细菌毒性的研究,检测效果显著。而本研究是将16SrDNA检测应用于多功能便秘患儿的肠道菌群分析,原理一致,研究结果显示,16SrDNA检测的灵敏度为87.17%,特异度为92.03%,价值显著。同时,相关文献报道,一般情况下,细菌基因组内存在大量重复性较高的短序列,在此基础上,临床逐渐衍生出REP-PCR技术,尤其是BOX-PCR、ERIC-PCR、ERIC2-PCR、(GTG)5-PCR、REP-PCR等技术,其检测机制为通过提供清晰准确的DNA指纹图谱来显示菌群种类,特异度和灵敏度表现出一定的优势,目前在生物遗传多样性方面已有广泛应用,而本研究是将REP-PCR技术应用于微生态菌群多样性的分析中,原理一致,本研究结果显示,REP-PCR检测的灵敏度为85.29%,特异度为84.25%,价值显著。通过分析正常幼儿和患儿的肠道菌群在门、属水平的差异,研究结果显示,在门水平,对照组肠道菌群中放线菌门水平明显低于观察组,对照组肠道菌群中变形菌门水平明显高于观察组,两组肠道菌群无壁菌门、厚壁菌门、拟杆菌门、梭菌属门水平比较无明显差异,同时,在属水平,对照组肠道菌群中副杆状菌属、拟杆菌属水平明显低于观察组,对照组肠道菌群中普氏菌属水平明显高于观察组,证明多功能便秘的肠道菌群具有明显的特异性改变,两种分子检测方法具有显著优势,对临床诊治指导价值高。
综上所述,应用16SrDNA和REP-PCR检测分析功能性便秘幼儿肠道菌群具有重要价值,并针对性指导治疗,值得在临床推广。
[参考文献]
[1] 徐娜娜,范文廷,毕茹茹,等. 功能性便秘患者肠道菌群分析及肠道菌群调节作用的研究进展[J]. 临床检验杂志,2018,36(1):34-36.
[2] Huang Y,Wang X,Li X,et al. Successful fecal bacteria transplantation and nurse management for a patient with intractable functional constipation:A case study[J]. Holistic Nursing Practice, 2016,30(2):116.
[3] 黄文献,王和平,王玉蕾,等. 高通量测序检测肺炎婴幼儿抗生素治疗前后肠道菌群变化[J]. 中国微生态学杂志,2016,28(5):497-500.
[4] Liu D,Li T,Zheng H,et al. Study on alterations of physiological functions in aged constipation rats with fluid-deficiency based on metabonomic and microbiology analysis[J]. Rsc Advances,2017,7(76):48136-48150.
[5] 付雯,刘兴隆,张珑琼,等. 3种方法治疗肠道菌群失调合并过敏性哮喘大鼠对肠道菌群的影响[J]. 重庆医学,2017,46(25):3477-3479.
[6] 杜喜峰,冯晋兴,于爱真,等. 深度测序分析早产儿坏死性小肠结肠炎肠道菌群多样性变化[J]. 中国妇幼保健,2017,32(19):4700-4702.
[7] Meij TG,Groot EF,Eck A,et al. Characterization of microbiota in children with chronic functional constipation[J]. Plos One,2016,11(10):e0164731.
[8] 黄林生,屈潇,孔程,等.合生元对慢性功能性便秘患者肠道特定菌群的影响及其功能注释[J].中国全科医学,2019,22(3):296-301.
[9] 刘龙,龚晗,杨彪,等. 鹅肥肝形成中肠道生理指标、菌群及代谢物的变化[J]. 扬州大学学报:农业与生命科学版,2016,37(4):37-42.
[10] 蒋艾廷,李宝坤,金丹,等. 新疆塔城传统酸奶中乳酸菌的多样性及发酵特性分析[J]. 食品工业科技,2017, 38(15):122-128.
[11] 耿岚岚,刘明南,龙高,等. 儿童功能性胃肠病罗马Ⅳ标准[J]. 中华儿科杂志,2017,55(1):4-14.
[12] 阿孜尔古丽·阿布都克日木,马兰英,孙玉萍,等. 维吾尔族结肠癌患者肠道菌群的分布情况研究[J]. 现代生物医学进展,2016,16(12):2227-2230.
[13] 陈焕,唐维兵. 婴儿功能性便秘的诊治现状[J]. 中国医师杂志,2017,19(3):349-351.
[14] 高祀龙,刘颖,刘曼,等. 酒精性肝病患者肠道菌群变化与肝功能的相关性研究[J]. 广东医学,2017,38(16):2484-2486.
[15] Ren RR,Sun G,Yang YS,et al. Chinese physicians perceptions of fecal microbiota transplantation[J]. World Journal of Gastroenterology,2016,22(19):4757-4765.
[16] 张弘,蒋勇军,张远瞩,等. 基于 PCR-DGGE和拟杆菌(Bacteroides)16S rRNA 的岩溶地下水粪便污染来源示踪研究:以重庆南山老龙洞地下河系统为例[J]. 环境科学,2016,37(5):1805-1813.
[17] Tully DC,Ogilvie CB,Batorsky RE,et al. Differences in the selection bottleneck between modes of sexual transmission influence the genetic composition of the HIV-1 founder virus[J]. Plos Pathogens,2016,12(5):e1005619.
[18] 李豪,杨永志,袁耀宗,等. 双歧杆菌三联活菌制剂治療功能性便秘临床疗效Meta分析[J]. 中国微生态学杂志,2016,36(8):724-728.
[19] 谢尚奎,任东林,鲜振宇,等. 结肠慢传输型便秘大鼠肠道菌群的变化及益生菌的干预效果[J]. 广东医学,2016,37(3):325-327.
[20] 李柏胜,谢兰丰,刘岩红,等. 肝硬化自发性细菌性腹膜炎患者粪便大肠杆菌毒力基因Colv和腹水细菌分布的相关性[J]. 肝脏,2017,22(5):424-426.
(收稿日期:2019-03-14)

