含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶10在压力超负荷诱导的心肌肥厚中的表达及其与心肌纤维化的关系
王震,王梦龙,刘剑芳,叶晶,徐瑶,姜慧敏,叶迪,张记收,万军
心肌肥厚是心脏应对机械及神经体液等多种刺激产生的适应性改变,是高血压、心脏瓣膜病、心肌梗死及先天性心脏病等多种心血管病的共同病理生理过程,其主要病理变化包括心肌细胞体积增大、细胞外基质(ECM)合成增多和胶原沉积等[1-2]。含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶(ADAMTS)家族是一类新型的分泌型金属蛋白酶,参与血管形成、排卵、炎症反应和止血等生理过程。多项研究表明,ADAMTS家族参与调控多种心血管病,包括动脉粥硬化、心肌梗死、心脏瓣膜病和心力衰竭等[3-4]。本研究拟通过主动脉弓缩窄术(TAC)建立小鼠心肌肥厚模型,探讨ADAMTS10在心肌重构病理生理过程中的作用,为防治心肌肥厚及纤维化提供理论依据和治疗的新靶点。
1 材料与方法
实验材料: SPF级C57BL/6J雄性小鼠60只,8~10周龄,体质量(25.0±2.0)g,由武汉大学心血管病研究所提供,许可证号:SYXK(鄂)2009-0053。饲养在武汉大学心血管病研究所动物房小鼠微屏障饲养系统,给予充足的喂食和水,待小鼠适应环境后,利用计算机生成随机数字表,采用随机数字法随机分为假手术组(n=20)和实验组(n=40)。
试剂和仪器:主要试剂:二喹啉甲酸(BCA)蛋白浓度测定试剂盒(Thermo Fisher公司,美国);ADAMTS10(ab173290)、波 形 蛋 白(Vimentin,ab92547)和甘油醛-3-磷酸脱氢酶(GAPDH, ab8245)抗体均购自Abcam公司(英国);二抗(LI-COR公司,美国);TRIzol试剂和反转录试剂盒(Roche公司,瑞士),其余试剂为国产分析纯。主要的实验仪器有:超声裂解仪、研磨仪、包埋机、超高速离心机、分光光度计、酶标仪、烤箱、水浴锅、脱水机、病理切片机、蛋白/核酸电泳仪、转膜槽、摇床、封膜机、双色红外荧光成像系统、倒置荧光显微镜、实时荧光定量聚合酶链式反应(PCR)检测仪、MyLab30CV型超声仪(Biosound Esaote公司,意大利)。
心肌肥厚模型的建立:由本实验室专职工作人员负责造模,操作步骤如下:(1)实验组小鼠的制备:3%戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉小鼠后,备皮,将小鼠仰卧位固定在操作台上,套管针气管插管后用小动物呼吸机辅助呼吸。在胸骨左缘2~3肋间做一横行切口,依次分离皮肤、肌肉及软组织,打开胸腔,用显微镊游离主动脉弓。将7-0结扎线穿过主动脉弓,同时平行主动脉弓放置一去尖的26/27 G针头,将主动脉弓与针头一起结扎,然后迅速抽出针头,逐层关胸。(2)假手术组小鼠:只穿线,不结扎,其余步骤同前。
检测心功能和血压:分别于术后4周和8周检测小鼠心脏功能。1.5%异氟烷吸入麻醉小鼠,备皮,涂抹耦合剂,仰卧位对小鼠行心脏超声检查,探头频率10 MHz。选取标准左心室乳头肌短轴切面,测量并记录左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)。
组织病理学检测:称量并记录小鼠体质量,其中实验组小鼠于第4周和第8周处死,取出心脏,放入10% KCl溶液中洗掉血液,称量并记录小鼠心脏质量。将心尖部分迅速放入液氮中保存,之后转移至-80℃冰箱保存备用。其余左心室组织进行多聚甲醛固定、脱水、石蜡包埋、切片。切片进行苏木素-伊红染色法(HE)、天狼猩红和麦芽胚凝集素染色(WGA),显微镜下观察并拍片,使用image pro plus 6.0软件计算心肌细胞横截面积和左心室胶原分数。
免疫荧光检测:切片进行抗原修复后,磷酸盐缓冲液漂洗3次,之后用2%小牛血清白蛋白封闭30 min。轻轻甩掉封闭液,在切片上分别滴加适当的抗体,平放于湿盒内4℃孵育过夜。切片洗涤3次后二抗孵育10 min,随后4',6-二脒基-2-苯基吲哚(DAPI)染液复染细胞核。切片稍甩干后用抗荧光淬灭封片剂封片,荧光显微镜下观察并采集图像。
心肌组织信使RNA(mRNA)表达的检测:于-80℃冰箱取出样本,TRIzol法提取总RNA,分光光度计测定RNA浓度,计算RNA提取量,将总RNA逆转录为cDNA。构建PCR反应体系,利用罗氏Lightcycler480 Real-time PCR仪进行扩增,反应条件为:95℃预变性10 min;95℃变性10 s、60℃退火10 s、72℃延伸20 s,共40个循环。以GAPDH作为内参,采用2-△△Ct法对结果进行定量分析。利用Primer-BLAST在线设计引物,特异度引物序列由北京擎科新业生物技术有限公司合成,特异性引物序列见表1。

表1 特异度引物序列
心肌组织蛋白表达水平检测:取适量心肌组织,按10 mg/100 μl反应体系加入裂解液,提取蛋白,BCA法进行定量。制备十二烷基硫酸钠-聚丙烯酰胺凝胶,按40 μg/孔道上样电泳,待电泳结束后取出凝胶,湿转法转膜后用5%脱脂奶封闭1 h,加入适量一抗(anti-ADAMTS 10,1:1 000稀释)4℃孵育过夜,随后二抗孵育1 h,双色红外荧光成像系统扫膜,以GAPDH为内参分析和计算相关蛋白表达水平。
统计学方法: 采用SPSS 22.0软件进行统计学处理。计量数据以均数±标准差(s)表示,多组间比较采用单因素方差分析,两变量间相关分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
两组小鼠心功能比较(表2):假手术组2只小鼠出现麻醉意外,实验组4周和8周各有2只不符合心肌肥厚标准,剔除出实验组。实验组与假手术组相比, 4周小鼠心脏质量明显增加(P<0.05),且在实验组第8周进一步升高(P<0.05);超声结果表明,与假手术组比较, 实验组4周小鼠LVEF和LVFS均显著降低(P<0.05),且在实验组8周进一步降低(P<0.05)。
表2 两组小鼠心功能比较(

表2 两组小鼠心功能比较(
注: BW:体质量;HW:心脏质量; LVEF:左心室射血分数;LVFS:左心室短轴收缩率。与假手术组比较aP<0.05;与实验组4周相比bP<0.05
项目 假手术组(n=18) 实验组4周(n=18) 8周(n=18)BW (g) 27.6±2.4 26.6±1.7 27.3±2.9 HW (mg) 120.1±9.6 156.1±11.3a 187.9±10.6b LVEF (%) 79.6±4.1 62.2±3.5a 50.4±4.3b LVFS (%) 41.2±2.3 33.6±3.1a 28.5±3.2b
两组大鼠心肌组织ADAMTS10 mRNA和蛋白表达的比较(图1、图2):与假手术组相比, 实验组4周小鼠心肌组织ADAMTS10 mRNA和蛋白表达上调(P<0.05);实验组8周与实验组4周小鼠比较, 8周小鼠的心肌组织ADAMTS10 mRNA和蛋白表达又进一步上调(P<0.05)。
ADAMTS10在心肌组织中定位(图3):免疫荧光染色结果提示:ADAMTS10与心肌成纤维细胞标志物波形蛋白(Vimentin)共表达,ADAMTS10定位于心肌成纤维细胞。
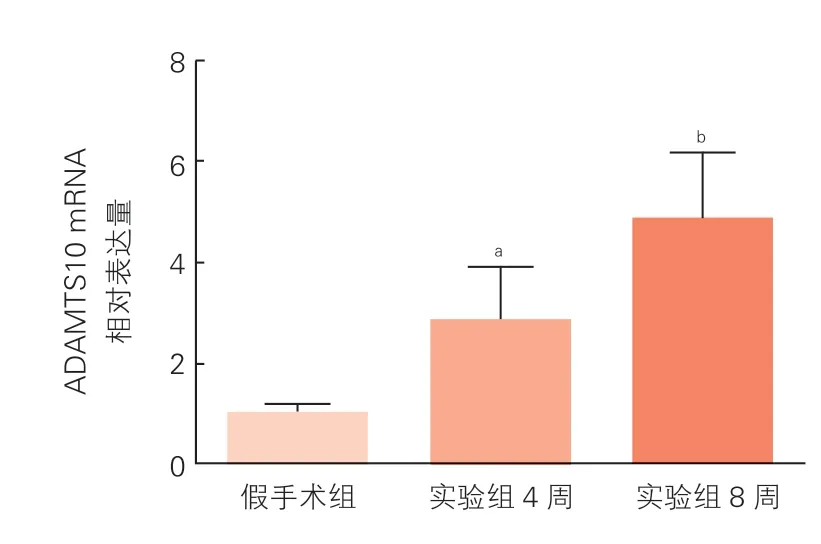
图1 两组小鼠心脏组织中ADAMTS10 mRNA表达情况(n=18)
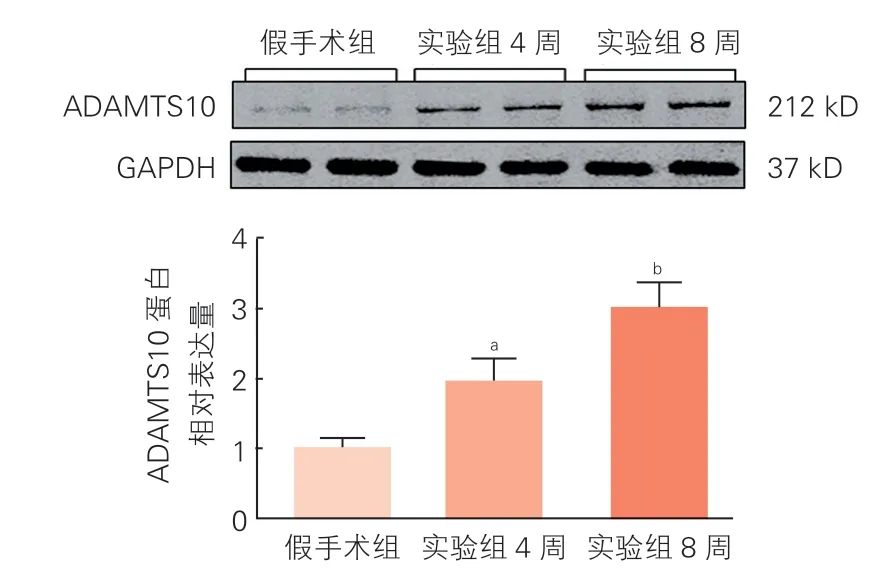
图2 两组小鼠心脏组织中ADAMTS10蛋白表达情况(n=18)
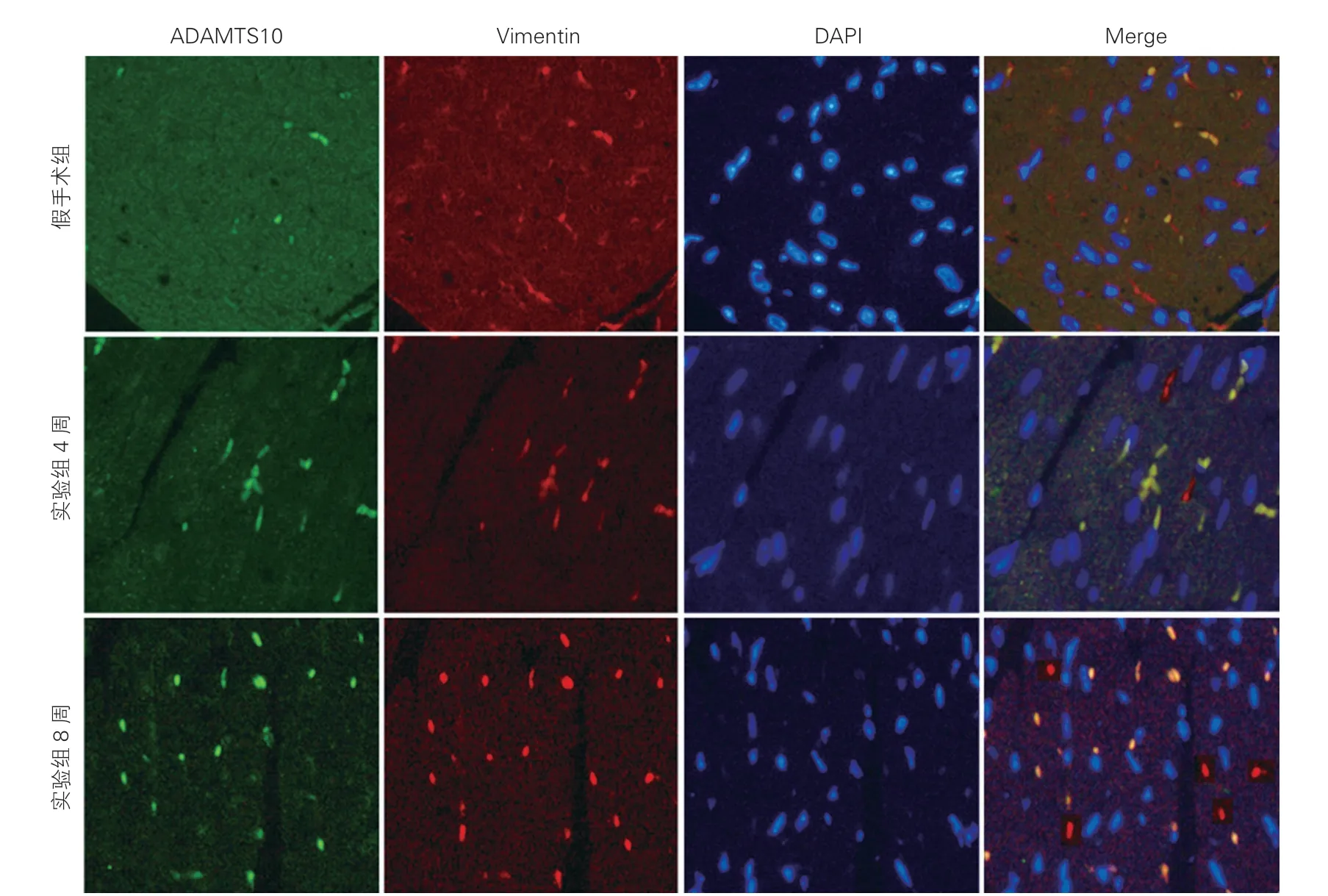
图3 ADAMTS10在小鼠心肌组织中的定位
心肌组织ADAMTS10与心肌肥厚的相关性分析:病理染色显示,实验组与假手术组相比,心肌细胞横截面积增大,且相较于实验组4周,实验组8周小鼠心肌细胞横截面积进一步增大,心肌肥厚程度进一步加重(P<0.05,图4)。实验组4周与8周小鼠心肌组织ADAMTS10 mRNA水平与心房钠尿肽(ANP)、β-心肌肌球蛋白重链(β-MHC)的mRNA水平呈正相关(P<0.05,图5)。
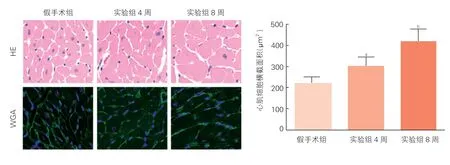
图4 小鼠心脏组织HE和WGA染色结果(X400)及心肌细胞横截面积
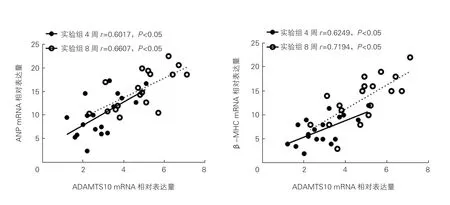
图5 实验组小鼠心脏组织中ADAMTS10 mRNA与ANP mRNA和β-MHC mRNA水平的相关性分析(n=18)
心肌组织ADAMTS10与心肌纤维化相关性分析:天狼猩红染色显示,实验组小鼠心肌胶原增加,且相较于实验组4周,实验组8周小鼠心肌胶原进一步增加,纤维化程度进一步加重(P<0.05,图6)。实验组 4周和8周小鼠心肌组织ADAMTS10 mRNA水平与MMP2、MMP9的mRNA水平呈正相关(P均<0.05,图7)。

图6 小鼠心脏组织天狼猩红染色结果(X400)
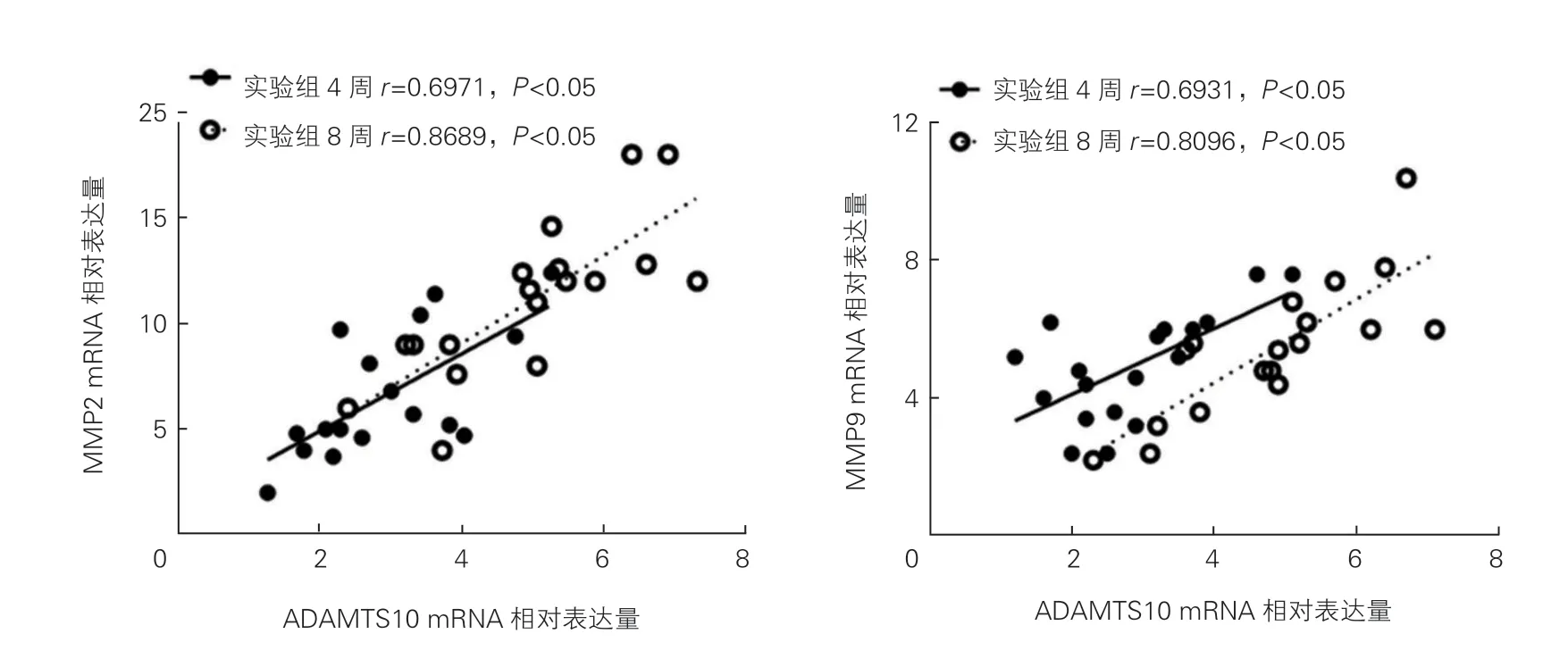
图7 实验组小鼠心脏组织中ADAMTS10 mRNA与MMP2 mRNA和MMP9 mRNA水平的相关性分析(n=18)
3 讨论
心肌肥厚是心脏应对各种损伤时产生的一种代偿机制。在组织器官水平表现为室壁增厚、室壁顺应性下降;细胞水平表现为心肌细胞肥大,基质细胞增殖导致大量胶原沉积;分子水平表现为肥厚相关基因的激活、肌节组装和蛋白质合成增加[5-7]。在心肌肥厚早期,心肌细胞体积增大,胶原纤维大量合成以维持心脏的正常形态完整性和功能,但持续的心肌肥厚可降低心肌顺应性和心脏功能,从而改变心脏血流动力学,导致心力衰竭、心律失常甚至猝死的发生。本研究通过TAC术建立小鼠心肌肥厚模型,术后4周和8周的小鼠心脏质量明显增加,超声提示小鼠心功能下降,组织病理学结果表明实验组小鼠心肌细胞横截面积增加,间质胶原蛋白大量沉积,且分布紊乱,与本实验室既往研究成果基本一致[8],表明本研究成功建立了压力负荷致心肌肥厚模型。
ADAMTS是一类多结构域基质相关性锌指金属蛋白酶,包含19个家族成员,具有相似的结构基础,包括解素样结构域、金属蛋白酶催化结构域、I型血小板结合蛋白富集区域和重复序列等[9]。ADAMTS分子结构及蛋白水解作用与基质金属蛋白酶家族类似,调节ECM的合成与水解。自ADAMTS家族发现以来,大量研究表明其与心血管病的发生发展密切相关。Wu等[10]的研究表明,心肌梗死患者血浆ADAMTS7水平与心室重构程度和预后相关,可作为心肌梗死患者心力衰竭的独立危险因素。而Krishnamurthy等[11]发现,在小鼠弹性蛋白敲除诱导的主动脉瓣膜病模型,ADAMTS5、MMP2和MMP9表达上调,ADAMTS5通过促进多功能蛋白聚糖异常降解,加快胞外基质重塑,最终导致主动脉瓣畸形和瓣膜病的发生。最近的研究表明,ADAMTS10与纤维蛋白1共定位在人类皮肤,同时与纤维蛋白1相互作用,促进其在皮肤成纤维细胞的细胞外基质中沉积[12]。本研究结果证实ADAMTS10在小鼠心肌组织表达,且定位在心脏成纤维细胞,那么ADAMTS10是否参与心肌肥厚调节?是否和心肌纤维化有关系呢?
ADAMTS10最早于小鼠胚胎中被发现,主要在肺、肾和骨中表达,具有与其他成员相似的结构,区别在于其C端存在5个特征性I型血小板结合蛋白重复序列[13-14]。研究表明,ADAMTS10基因变异可导致Weill-Marchesani综合征,是一种罕见的结缔组织病,也称球形晶状体短指畸形综合征,反马凡综合征等[15]。Wang等[16]证实在异丙肾上腺素诱导的离体实验模型中,ADAMTS2的表达上调,且沉默ADAMTS2的表达可减轻异丙肾上腺素诱导的心肌细胞肥大。与之类似,本研究使用RT-PCR和Western blotting检测ADAMTS10在实验组4周和8周小鼠心肌组织的表达情况,结果表明随着病程的持续,在心肌细胞肥大和心肌纤维化进行性加重的同时,ADAMTS10含量也呈进行性增加。ANP和β-MHC是心肌肥厚严重程度的指标,本研究发现心肌肥厚小鼠心肌中ADAMTS10 mRNA水平与ANP mRNA和β-MHC mRNA水平均呈正相关。心肌纤维化是心肌重构的重要组成部分,MMP过度降解正常胶原蛋白,导致ECM重构,可作为反映心肌纤维化程度的指标。本研究发现ADAMTS10 mRNA水平与MMP2 mRNA和MMP9 mRNA水平明显正相关。因此推测压力负荷诱导心肌组织ADAMTS10表达上调,继而升高的ADAMT10通过调节ECM的动态平衡参与心肌肥厚和纤维化的发生。
局限性:本研究仅做了相关性分析,未能进一步探究ADAMTS10调控ECM重构的具体分子机制,这也是下一步实验的重点研究内容。本文的亮点:初步证实了ADAMTS10在心肌组织表达,并定位在心肌成纤维细胞。其次,证实在压力负荷刺激下,ADAMTS10通过调控ECM重构,参与心肌肥厚和纤维化的发生发展,提示ADAMTS10可能是逆转心肌肥厚及纤维化的重要靶点。
利益冲突:所有作者均声明不存在利益冲突

