CYP2C19基因多态性影响颈动脉血管内支架置入术后氯吡格雷疗效
余建萍 邹显巍 张黎黎 何仲春 马 碧
抗血小板治疗是影响颈动脉血管内支架置入术(Carotid Artery Stenting,CAS)后远期通畅率的重要因素[1]。目前,氯吡格雷联合阿司匹林双联抗血小板治疗是临床常用策略。调控氯吡格雷代谢相关活性基因CYP2C19具有高度多态性,其正常基因型为*1/*1 型,常见的无功能突变为CYP2C19*2型和CYP2C19*3型,当CYP2C19基因发生无功能突变后,编码出来的酶的活性会减弱或丧失,直接影响氯吡格雷的代谢过程,最终减弱其抗血小板聚集的能力[2-4]。本研究旨在分析CYP2C19基因多态性对CAS术后氯吡格雷抗血小板治疗患者发生氯吡格雷抵抗(CR)和支架内血栓形成影响,现报道如下。
1 资料与方法
1.1 对象和分组
收集2014-10—2015-10本院收治的缺血性脑血管病[5]需行CAS治疗的患者80例,其中男53例,女27例;年龄50-75岁,平均65.58±8.15岁;脑卒中29例,冠心病17例,高血压62例,糖尿病30例,高血脂症36例,吸烟40例,饮酒33例。不同CYP2C19基因型患者的一般临床资料比较,差异无统计学意义(P>0.05),见表1。

表1 患者一般资料比较
1.2 病例纳入、排除及实验终止标准
纳入标准:(1)临床上诊断为缺血性脑血管病者;(2)行颈动脉血管内支架置入术者;(3)需长期服用氯吡格雷者。排除标准:(1)血小板计数<80×109/L;(2)凝血功能异常者;(3)有严重肝脏疾病者;(4)术前3个月内有服用氯吡格雷者;(5)既往有颅内出血病史者;(6)合并其它疾病可显著影响治疗方案及预后者;(7)抗血小板治疗禁忌证者。实验终止标准:(1)患者出现严重凝血功能障碍;(2)有局部或全身出血表现的不良事件;(3)出现意外伤残、病死事件时应立即终止实验。
1.3 仪器、试剂和主要药物
上海百傲科技有限公司CYP2C19基因检测试剂盒(批号2014104436851),Qiagen DNA提取试剂盒(产品货号 51304),BR-526-24全自动杂交仪、BE-2.0生物芯片识读仪。Roche公司的Light Cycler 480 扩增检测仪,美国Helena公司PACK-4多通道血小板聚集仪,拜耳医药保健有限公司阿司匹林肠溶片(国药准字J20130078),赛诺菲(杭州)制药有限公司氯吡格雷片(国药准字J20130083)。
1.4 患者治疗流程
患者入院后于手术前采集外周静脉血检测CYP2C19基因型。患者于术前3天和术后3月给予口服阿司匹林肠溶片(100mg/天)和氯比格雷片(75mg/天)。所有患者在术后第7 天采集外周静脉血检测血小板聚集率(PAR)。出院后采用电话随访3个月,主要终点事件为支架内血栓形成。
1.5 CYP2C19基因型检测
术前抽取外周静脉血5ml于EDTA抗凝管中,按试剂盒说明书提取全血DNA,随后进行PCR扩增,体系为19μl,扩增条件为94℃5min,94℃30s,58℃30s,72℃60s,连续36个循环,最后72℃7 min,4℃保存。设立空白对照样本和5%的重复样本,以评价检测结果的可靠性。取出杂交显色试剂盒,按试剂盒说明书操作,使用BR-526-24全自动杂交仪,通过多重高温连接酶检测反应进行基因分型检测,杂交显色反应结束后取出芯片放入BE-2.0生物芯片读取仪中读取结果。CYP2C19基因可分为*1/*1、*1/*2、*1/*3、*2/*2、*2/*3、*3/*3型,各基因型芯片结果见图1。
1.6 血小板聚集率检测
患者服用氯吡格雷7天后取静脉血2ml,加至0.5ml枸缘酸钠溶液(1∶9)混匀,经2 400r/min离心10min后获取富血小板血浆,稀释至250×109个/L,采用血小板聚集仪自动测定患者PAR。CR:PAR>50%,NCR:PAR≤50%[6]。

图1 CYP2C19各基因型芯片结果
1.7 支架内血栓形成检测
采用颈动脉彩超(美国GE公司Vivid3型彩色多普勒超声诊断仪)定期检查支架内血栓形成情况[7]。
1.8 统计学处理
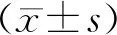
2 结 果
2.1 80例患者CYP2C19基因分型结果
80例患者CYP2C19基因筛查中,*1/*2基因型所占比率最高,为37.50%(30/80),其次为*1/*1基因型(31.25%,25/80)。CYP2C19基因无功能突变(*2、*3)所占比率为68.75%(52/80),携带一个无功能突变基因(*1/*2型30例、*1/*3型6例)所占比率为45.00%,同时携带2个无功能突变基因(*2/*2型12例、*2/*3型4例、*3/*3型3例)所占比率为23.75%。CYP2C19基因的三种等位基因频率(*1、*2、*3)分别为53.75%、36.25%、10.00%。
2.2 CYP2C19*2与CYP2C19*3携带者CR发生率和支架内血栓形成发生率比较
80例患者CR总发生率为25.00% (20例),术后3个月支架内血栓形成发生率为16.25% (13例)。CYP2C19*2基因携带者(*1/*2、*2/*2)CR发生率为25.87%(14/42),支架内血栓形成发生率为23.81%(10/42),高于CYP2C19*3基因携带者(*1/*3、*3/*3)CR发生率(22.22%,2/9)和支架内血栓形成发生率(11.11%,1/9),差异有统计学意义(χ2均>74.178,P<0.01)。
3 讨 论
随着人口的老龄化和人们生活水平的提高,动脉粥样硬化的发病率逐年上升。同时由于检查手段和治疗手段的提高,越来越多的患者接受了CAS治疗,且患者术后需长期服用抗血小板聚集药物预防手术部位血管再狭窄[8, 9]。支架内血栓形成是影响患者预后的主要并发症,其影响因素包括抗血小板药物抵抗、支架的物理刺激、内膜长期增生、慢性炎症作用等[10, 11]。目前,临床最常用的抗血小板药物有阿司匹林肠溶片和氯吡格雷等。在CAS术后抗血小板治疗中,氯吡格雷强大的抗血小板作用突出,可有效降低术后并发症和心血管不良事件的发生率[12]。
氯吡格雷是一种噻吩吡啶类前体药物,主要经CYP450酶系主导的多步氧化过程来转化成有活性的物质,从而产生抗血小板聚集作用[13]。美国食品药品管理局警示医生开具氯吡格雷药物前,必须了解患者CYP2C19基因突变的情况。Shuldiner等[14]研究表明冠状动脉支架术后CYP2C19基因多态性与氯吡格雷的药物疗效明显相关。CYP2C19是非常关键的一个代谢酶,其表现为基因多态性,其中亚洲人群中CYP2C19酶活性抑制归因于其突变CYP2C19*2和CYP2C19*3基因型[15]。在我国人群中CYP2C19*2、CYP2C19*3等位基因发生频率分别为25%-30%、2%-7%[16],故氯吡格雷的疗效存在很大的个体差异,有服药后抗栓不足的风险。氯吡格雷代谢离不开CYP2C19酶,作为体内代谢活化的关键酶,且基因多态性决定了个体间该酶活性的多样性,并影响氯吡格雷代谢产物的浓度差异及抗血小板作用的多样性[17]。目前国内关于服用氯吡格雷CAS患者CYP2C19基因检测报道较少,本研究以基因为导向,通过对CAS患者CYP2C19基因检测分组,分析不同CYP2C19基因型与患者CAS后CR发生率和支架内血栓形成发生率的差异。
80例CAS患者CYP2C19基因筛查中,*1/*2基因型所占比率最高,其次为*1/*1基因型。CYP2C19基因无功能突变(*2、*3)所占比率为68.75 %,携带一个无功能突变基因(*1/*2、*1/*3)所占比率为45.00 %,同时携带2个无功能突变基因(*2/*2、*2/*3、*3/*3)所占比率为23.75%。2015年,Li等[18]发现在中国人群CYP2C19基因多态性是支架内血栓形成唯一的独立预测因子,与亚临床血栓的发生关系密切,且发现突变基因CYP2C19*2与血栓形成有关。本研究显示,携带等位基因CYP2C19*2型患者的CR发生率与支架内血栓形成发生率均高于等位基因CYP2C19*3携带者,与上述研究结果基本一致。这表明等位基因CYP2C19*2型与患者CR及支架内血栓形成息息相关,可指导CAS患者术后的远期预后,意义重大。
综上所述,携带CYP2C19*2基因是CAS术后氯吡格雷抗血小板治疗患者CR发生与支架内血栓形成的重要因素,影响患者预后。对于CYP2C19基因发生无功能突变的患者,特别是CYP2C19*2基因型突变者,该如何使用抗血小板药物还需要前瞻性大样本临床随机对照研究来进行验证。

