CdTe量子点荧光探针检测血清和食品中Cr3+
龚婷婷,王秋月,吴一微
(湖北师范大学化学化工学院,湖北黄石435002)
Cr3+在脂肪、碳水化合物、核酸和蛋白质的代谢过程中起重要作用,是人体必需的微量元素之一。正常人每天需要摄入25~35μg的Cr3+来改善血糖、血脂的代谢,而Cr3+的缺乏可能会导致糖尿病和心血管疾病,但过量的Cr3+也会对细胞结构产生不利影响[1]。因此,建立一种简单、灵敏度高和选择性好的测定食品和生物样品中痕量Cr3+的新方法至关重要。
目前,铬的检测方法主要有电化学方法[2]、原子吸收光谱法[3]、电感耦合等离子体质谱法[4]和荧光法[5],其中荧光法因具有选择性好、灵敏度高和响应速度快等优点引起人们的极大兴趣[6]。在荧光检测技术中,荧光探针的选择是关键。量子点(QDs)因具有量子产率高、光化学稳定性好、斯托克斯位移大、吸收光谱宽、抗漂白强和荧光寿命长等优点受到广泛关注[7-9]。Abolhasani等[7]和Souza等[8]分别建立了基于Cr3+荧光猝灭巯基乙酸修饰的CdS QDs、CdSe QDs的传感新方法。Han等[9]在CdTe QDs表面修饰上不同的配体,利用配体的识别差异,成功地鉴别了Cr3+和Cr6+。然而,利用CdTe QDs在不同缓冲体系中对Cr3+的响应差异,建立Cr3+的分析新方法尚未见报道。
本文采用一锅法合成了尺寸均一且水溶性好的巯基乙酸修饰的CdTe QDs,基于Cr3+在不同介质中对该量子点荧光猝灭作用的差异,建立了食品和血清中痕量Cr3+的分析新方法。
1 实验部分
1.1 仪器和试剂
LS45荧光光谱仪(美国,Perkin Elmer);U-3010紫外-可见分光光度计(日本,Hitachi);PB-10型精密pH 计(德国,Sartorius)。
CdTe QDs的合成及表征同本课题组前期工作[10]。Cd(Ac)2·2H2O、NaBH4、CrCl3·6H2O、NaOH(天津市科密欧化学试剂有限公司),K2TeO3(Aladdin),巯基乙酸(Alfa Aesar)。1mg·mL-1Cr3+、Ag+、Cu2+、Hg2+等金属离子贮备液分别由相应的高纯盐 CrCl3·6H2O、AgNO3、CuCl2·2H2O和 Hg(NO3)2(上海化学试剂厂)配制而成。水为二次蒸馏水。
1.2 CdTe QDs探针检测Cr3+
将55μL CdTe QDs和400μL 0.1mol·L-1HAc-NaAc缓冲溶液(pH=6.0)混合于比色管中,分别加入不同浓度的Cr3+标准溶液,用水定容至5.0mL,混匀,室温下放置10min后,用荧光光度计测量其荧光强度(λex/λem=458/560nm,狭缝宽度均为10nm)。
1.3 样品预处理
将血液样品(黄石市二医院检验科提供)高速离心(3 500r/min)后,收集血清,待用。橙汁和牛奶样品(购于当地超市)高速离心(3 500r/min),弃掉大颗粒沉淀物后,再通过0.45μm滤膜过滤,收集滤液,待用。
2 结果与讨论
2.1 CdTe QDs在不同介质中对金属离子的选择性
分别研究了不同金属离子在B-R缓冲溶液和HAc-NaAc缓冲溶液中对CdTe QDs荧光强度的影响。从图1A可知,在B-R缓冲溶液中,Ag+、Cu2+和Hg2+对CdTe QDs荧光强度有明显的猝灭作用;而在HAc-NaAc缓冲溶液中(图1B),除了Ag+、Cu2+和 Hg2+外,Cr3+也能猝灭CdTe QDs的荧光。因此,基于本课题组前期工作[10],本文实验选择HAc-NaAc缓冲体系。
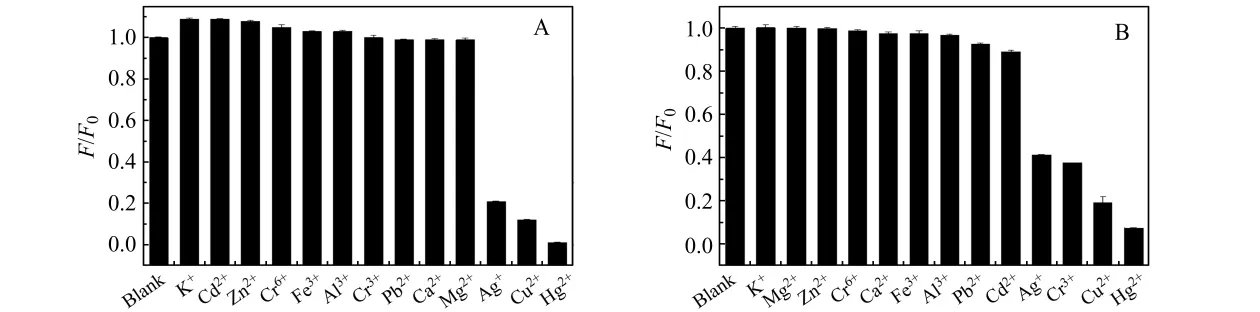
图1 在B-R缓冲溶液(A)和HAc-NaAc缓冲溶液(B)中不同金属离子对CdTe QDs荧光强度的影响Fig.1 Effect of various metalions on fluorescence intensity of CdTe QDs in B-R buffer(pH=7.0)(A)and HAc-NaAc buffer(pH=7.0)(B)
2.2 pH值的影响
强酸或强碱会影响QDs表面基团的质子化或去质子化,导致其表面结构发生变化,进而影响QDs的性质[11]。因此,分别考察了在体系中加或不加Cr3+的条件下,pH对CdTe QDs荧光强度的影响。结果表明:Cr3+不存在时,当pH=5.0~6.0,CdTe QDs荧光强度逐渐增加,pH=7.0~11.0CdTe荧光强度基本保持稳定;而Cr3+存在时,当pH=5.0~11.0,CdTe QDs荧光强度总体呈现微弱上升的趋势。比较两种结果发现,在pH=6.0时荧光强度差值最大,故选择pH=6.0为最优pH值。
2.3 HAc-NaAc缓冲溶液浓度的影响
在体系中分别加或不加Cr3+的条件下,考察了HAc-NaAc缓冲溶液浓度对CdTe QDs荧光强度的影响。结果表明,HAc-NaAc浓度在0.002~0.008mol·L-1范围内,荧光猝灭程度逐渐增加;在0.012~0.080mol·L-1范围内,荧光猝灭程度逐渐下降;在0.008mol·L-1时,荧光猝灭程度最大。因此,选择0.008mol·L-1的pH=6.0的HAc-NaAc缓冲溶液。
2.4 CdTe QDs体积的影响
在最佳条件下,固定Cr3+的浓度为40ng·mL-1,考察了不同体积的CdTe QDs对荧光强度的影响。结果表明,CdTe QDs体积在15~55μL范围内,荧光猝灭程度总体上逐渐增加;CdTe QDs体积在55~65μL范围内,荧光猝灭程度逐渐减小。因此,55μL CdTe QDs为最佳体积。
2.5 干扰离子影响的消除
采用二乙基二硫代氨基甲酸钠(DDTC)和NH4OH为掩蔽剂,消除Ag+、Hg2+和Cu2+对CdTe QDs检测Cr3+的干扰,从而实现对Cr3+的选择性检测,见图2。比较图2中曲线b和曲线c可见,在掩蔽剂的存在下,Ag+、Cu2+和 Hg2+对CdTe QDs检测Cr3+无明显影响。
2.6 CdTe QDs探针测定Cr3+的分析性能
在最佳条件下,考察了不同浓度的Cr3+对CdTe QDs的荧光强度的影响。实验结果显示,随着Cr3+浓度的增加,CdTe QDs的荧光强度逐渐减弱,荧光猝灭程度(F0/F)与Cr3+在0.50~45ng·mL-1范围内呈现良好的线性关系(F0表示不存在Cr3+时的荧光强度,F表示存在Cr3+时的荧光强度),线性方程为:F0/F=0.04148c+1.004,相关系数为0.9962,检出限为0.12ng·mL-1(2.3×10-9mol·L-1)。
表1列出了本方法与文献方法的性能比较。与同为荧光分析方法相比,本法的检出限比大多数方法低[12-14],但高于少数方 法[8];而 与 比 色 法[15-16]相 比,本 法 表 现 出 更 低的检出限。表明本法具有简单、廉价、灵敏度高和选择性好等优点。

图2 不同体系的荧光强度Fig.2 Fluorescence intensity(λex=458nm)of different systems(a)CdTe QDs:(b)CdTe QDs+Cr3+;(c)(b)+Ag+ +Cu2++Hg2+ +DDTC+NH4OH.[Ag+],[Cu2+]and[Hg2+]:10ng·mL-1;[DDTC]:2.0×10-6 mol·L-1;[NH4OH]:3.0×10-4 mol·L-1;CdTe QDs:55μL.
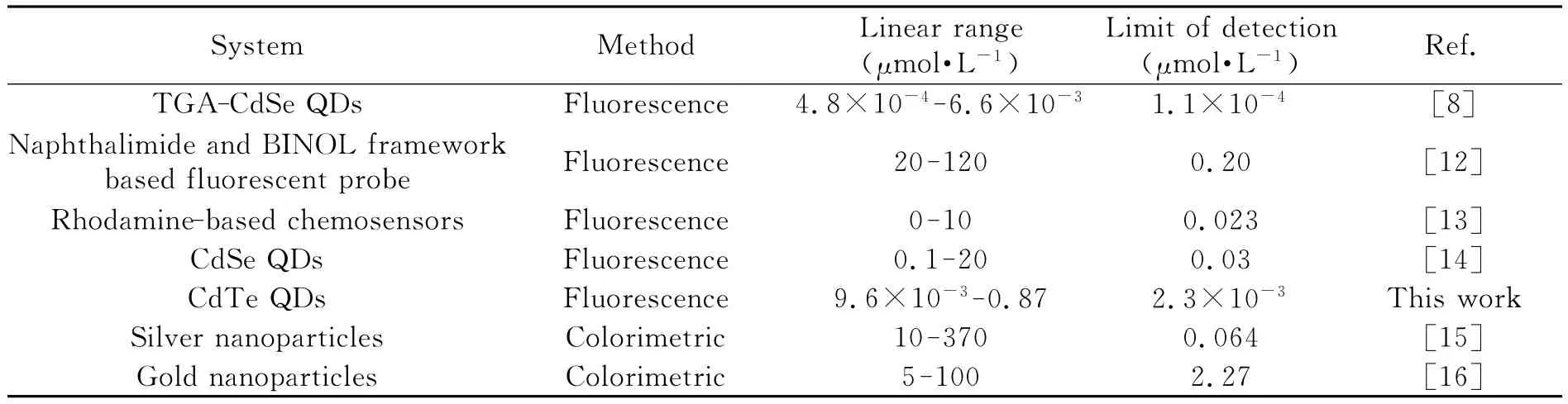
表1 本实验方法与文献方法对比Table 1 Comparison of this work with various reported methods
2.7 CdTe QDs检测Cr3+的可能机理
Cr3+能显著猝灭CdTe QDs的荧光,而Cr6+不能猝灭CdTe QDs的荧光原因可能如下:Cr3+和Cr6+在溶液中分别以阳离子和阴离子的形式存在,巯基乙酸包覆的CdTe QDs表面带负电荷,因此由于静电引力作用,CdTe QDs能吸附 Cr3+、排斥Cr6+[9],拉近了 Cr3+与CdTe QDs的距离,为电子转移铺平了道路[17],当CdTe QDs和Cr3+之间发生电子转移时,QDs表面快速形成缺陷,从而导致荧光猝灭。
2.8 实际样品分析
为探究CdTe QDs探针检测Cr3+的可行性,在最佳条件下,考察了CdTe QDs荧光探针检测血清、牛奶和果汁样品中Cr3+的加标回收情况。结果如表2所示,除橙汁未检测到Cr3+外,健康人、糖尿病人血清样品和牛奶样品中均检测到Cr3+,且糖尿病人血清中的Cr3+含量明显低于健康人。这是由于Cr3+对调节人体血糖至关重要,血糖越高,体内的Cr3+的含量越少,与实验结果一致。方法的加标回收率在91.8%~106%之间,符合检测要求。

表2 CdTe QDs应用于实际样品中Cr3+的检测Table 2 Detection of Cr3+in real samples by CdTe QDs
3 结论
基于CdTe QDs荧光探针,建立了一种简单、价廉、灵敏度高和选择性好的检测血清和食物样品中Cr3+的新方法,与大部分其他文献报道的方法相比,本法表现出更优异的分析性能。已成功用于血清样品,橙汁样品和牛奶样品中Cr3+含量的测定。

