高乳化活性的BSA-葡聚糖接枝物制备工艺的优化
吴子健,石振鹏,侯惠静,姜帆
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津300134;2.天津天狮学院生物与食品工程学院,天津301700)
蛋白质分子中的ε-氨基与多糖还原性末端上的羰基之间可在一定条件下自发形成蛋白质糖基化产物,能够显著提高蛋白质的功能性(如:水溶性、乳化性、热稳定性等),反应通常加热处理,而无需添加其他的化学试剂,属于“绿色加工工艺”[1]。牛血清白蛋白(bovine serum albumin,BSA)在生物化学及其他相关方面的研究中常作为一种标准蛋白来使用[2],同时也是一种天然的营养素载体,而通过糖基化改性,可进一步提高其乳化活性,改善其对营养素的包埋效果,BSA糖基化后,可在乳化过程中快速移动到油水界面,并在界面展开重排,对于包埋油溶性的营养素具有很好的效果[3-4]。
常用糖基化改性方法主要有两种,即干热法及湿热法。Cheetangdee N等[5]采用干热法制备β-乳球蛋白-己糖接枝物,提高其在等电点处的乳化活性;李海明[6]采用湿热法制备玉米醇溶蛋白-葡萄糖(或木糖)接枝产物,显著提高了玉米醇溶蛋白的亲水性。本研究以乳化活性为指标,优化湿法美拉德反应制备牛血清白蛋白-葡聚糖接枝产物的工艺,并对叶黄素进行包埋,检测其对油溶性分子的包埋效果。
1 材料与方法
1.1 材料与试剂
牛血清白蛋白Ⅴ(分子量68 kDa):Solarbio公司;葡聚糖(分子量20 kDa):MACKLIN公司;溶菌酶标品(14.3 kDa)、卵清蛋白标品(44.3 kDa)、卵转铁蛋白标品(77.9 kDa)、甲状腺球蛋白标品(165 kDa):sigma aldrich公司;其余试剂均为国产分析纯;去离子水、超纯水为天津市食品生物技术重点实验室自制。
1.2 仪器与设备
T 10 basic ULTRA-TURRAX小型分散机:德国IKA公司;SIM-F140BDL制冰机:日本Panasonic公司;3-18K离心机:德国Sigma公司;Seven Excellence pH计、UV-5紫外可见分光光度计:瑞士METTLER公司;2000 ES全自动四元梯度高效液相色谱仪:美国科学公司;FD-5N真空冷冻干燥机:日本EYELA公司;PROTEIN KW-803分子凝胶色谱柱(300 mm,8.0 mm×5 μm):日本SHIMADZU公司;SE 260垂直电泳系统:美国Hoefer公司;Essential V6凝胶成像系统:英国U-vitec公司;AH100B高压均质机:加拿大ATS公司;Ariummini plus纯水机:德国Sartorius公司。
1.3 方法
1.3.1 BSA-dextran接枝物的制备
参考Jiang Z等[7]的方法并做调整:将葡聚糖(dextran)与BSA按一定摩尔比混合,溶于0.01 mol/L PBS缓冲液中,恒温反应一定时间后,样品冰浴下冷却,4℃下离心(4 500 g,15min)取上清,上清液再在4.0℃下透析24 h(分子截留量为20 kDa±0.2 kDa),最后冻干,产物即为牛血清白蛋白-葡聚糖接枝物(BSA-dextran,DBSA)。
1.3.2 单因素试验
以反应温度、反应时间、反应物配比、BSA浓度、缓冲液体系pH值为单因素,以反应后DBSA接枝物的乳化活性为响应值,优化生成DBSA接枝物的反应条件。
1.3.3 响应面分析试验
单因素试验基础上,根据Box-Benhnken的原理[8],以 BSA浓度(A)、底物配比(B)、缓冲液体系 pH值(C)、时间(D)、温度(E)为自变量,以产物乳化活性(Y)为响应值,设计五因素三水平共46个试验点,其中6个为中心零点试验,40个为析因试验。零点为区域的中心值,析因点为自变量取值在A、B、C、D、E所构成的三维顶点。将因素的上下水平编码为1、-1,具体因素编码见表1。

表1 试验因素水平及编码Table 1 Variables and levels in central composite design
1.3.4 乳化活性的测定
乳化活性的测定参考吴鹏等[9]的方法并做调整,取1.0 mL糖蛋白溶液(2.0 mg/mL)与200.0 μL大豆油混合,16 000 r/min条件下匀浆1.0 min后,立即从底部吸取100.0 μL匀浆液,置于5 mL SDS溶液(0.1%)中,然后迅速振荡混匀,并在500 nm处测定吸光度(以0.1%SDS溶液为空白)。乳化活性(emulsifying ability index,EAI)按公式(1)计算。

式中:A500为乳状液吸光度值;n为稀释倍数;C为蛋白质质量浓度,mg/mL;φ为油相体积分数(φ=0.2)。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)
参考Bu G等[10]的方法:分离胶浓度10%,浓缩胶浓度4%,蛋白上样浓度1.0 mg/mL,上样量7.0 μL,电泳电压200 V,电泳结束后考马斯亮蓝R-250染色,再经脱色后拍照。
1.3.6 高效液相色谱(high performance liquid chromatography,HPLC)法
采用Bhatia M等[11]的方法并做调整:分子凝胶色谱柱(PROTEIN KW-803,300 mm,8.0 mm×5 μm)蛋白样品浓度2.0 mg/mL,进样体积20 μL,流速1.0 mL/min,检测波长220 nm;流动相0.3 mol/L NaCl(0.05 mol/L PBS 缓冲液,pH 6.80),时间 0~18 min。标准分子量蛋白采用溶菌酶、卵清蛋白、牛血清白蛋白Ⅴ、卵转铁蛋白、甲状腺球蛋白,以保留时间为横坐标,蛋白分子量的ln值为纵坐标,绘制标准曲线。
1.3.7 叶黄素包埋颗粒的制备
乙醇注入-高压均质法[12]制备叶黄素包埋颗粒:将BSA和DBSA分别溶于去离子水中,蛋白浓度为2mg/mL,充分溶解后再叶黄素乙醇溶液逐滴加入BSA或DBSA溶液中,使得每100 mL蛋白溶液中含叶黄素2 mg,充分混匀1.0 h,旋转蒸发(加热温度55.0℃)除去乙醇后,冰浴冷却后并用0.1 mol/L HCl调pH值至4.70,然后高压均质(85 000 kPa条件下,循环3次),于4.0℃下静置12 h,即得载有叶黄素的包埋颗粒,最后将上述叶黄素蛋白均质液进行真空冷冻干燥,即得固体的牛血清白蛋白-叶黄素包埋颗粒(bovine serum albumin-lutein,BSA-lutein)和牛血清白蛋白-葡聚糖-叶黄素包埋颗粒(bovine serum albumin-dextran-lutein,DBSA-lutein)。
叶黄素的包封率按照如下的公式(2)进行计算:

游离叶黄素含量通过有机溶剂洗涤法[13]测定:取0.5 mL的BSA-lutein或DBSA-lutein,加入2.0 mL正己烷,充分混合,7 000 r/min下离心5 min,并收集上层有机相。重复2次该操作,合并有机相,测定其在448 nm处的吸光值。以不同浓度叶黄素(正己烷溶解)在448 nm处吸光值做标准曲线(y=0.822x+0.016,R2=0.99),计算出游离叶黄素的含量。
总叶黄素含量通过十二烷基硫酸钠(sodium dodecyl sulfate,SDS)增溶法[14]测定:取 0.5 mL 的 BSA-lutein或DBSA-lutein,加入SDS(终浓度为0.3 mol/L)溶液充分振荡混合,30.0℃孵育5 min,测定其在448 nm处的吸光值,以不同浓度叶黄素(SDS溶解)在448 nm处吸光值做标准曲线(y=28.89x-0.013,R2=0.99)计算出包埋颗粒中叶黄素的总含量。
1.3.8 试验数据统计与分析
所有试验均重复3次,结果以均值±标准差的形式表示,并运用Origin 8.0与SPSS 17.0进行绘图及数据分析;响应面试验采用Design-Expert 8.0.6进行试验设计与数据统计分析。
2 结果与分析
2.1 湿法接枝反应条件对DBSA乳化活性的影响
2.1.1 反应温度对DBSA乳化活性的影响
控制缓冲液体系pH值为7.50,BSA浓度2.0mg/mL,底物配比(dextran∶BSA,摩尔比)3.5∶1,反应时间为3.0 h,调节反应体系的温度为 80.0、85.0、90.0、95.0、100.0℃,研究所得产物DBSA的乳化活性变化,结果如图1所示。

图1 温度对DBSA乳化活性的影响Fig.1 Effects of temperature on emulsifying activity of DBSA
随着反应体系温度的升高,DBSA的乳化活性逐渐升高,当体系温度达到90.0℃时,其乳化活性最好,为24.67 m2/g;当温度高于90.0℃时,乳化活性显著降低(P<0.05)。这可能是因为高温反应时,部分BSA迅速聚集沉淀,导致溶解度降低,从而使得乳化活性下降。
2.1.2 反应时间对DBSA乳化活性的影响
控制反应体系温度90.0℃,缓冲液体系pH值为7.50,BSA 浓度 2.0 mg/mL,底物配比(dextran∶BSA,摩尔比)3.5∶1,调节反应时间为 0、1.0、2.0、3.0、4.0、5.0 h,研究所得产物DBSA的乳化活性变化,结果如图2所示。
随着反应时间的增加,DBSA的乳化活性逐渐升高,当反应时间为2.0h时,其乳化活性最好,为25.59 m2/g,与未反应BSA的乳化活性(16.98 m2/g)相比,提高了0.5倍;但是随着反应时间的进一步增加,DBSA的乳化活性显著降低(P<0.05)。这可能是由于蛋白质引入的糖链过多,致使蛋白质过度亲水,失去亲水亲油平衡,导致乳化活性的下降[14]。

图2 时间对DBSA乳化活性的影响Fig.2 Effects of time on emulsifying activity of DBSA
2.1.3 底物配比对DBSA乳化活性的影响
控制反应体系温度为90.0℃,反应时间2.0 h,缓冲液体系pH值为7.50,BSA浓度2.0 mg/mL,调节底物配比(dextran∶BSA,摩尔比)为 1∶3、1∶1、3∶1、5∶1、7∶1,研究所得产物DBSA的乳化活性变化,结果如图3所示。

图3 底物配比对DBSA乳化活性的影响Fig.3 Effect of the raito of dextran to BSA on emulsifying activity of DBSA
随着底物配比中dextran含量的增加,DBSA的乳化活性先降低后升高:这可能是因为当底物配比为1∶3时,反应体系中BSA含量较高,即使反应程度较低,测得乳化活性值仍较高;当底物配比为5∶1的时候,DBSA乳化活性最好,为26.9 m2/g,显著高于底物配比为1∶3 时 DBSA 的乳化活性(25.12 m2/g)(P<0.05),说明通过接枝反应可以使得相同摩尔质量的BSA的乳化活性得到进一步的提高;但是当dextran含量进一步增加后,乳化活性反而降低。这可能是因为溶液中dextran含量过高,使得溶液黏度过大,流动性变差,不利于美拉德反应的发生[15]。
2.1.4 BSA浓度对DBSA乳化活性的影响
控制反应体系温度为90.0℃,反应时间为2.0 h,缓冲液体系pH值为7.50,底物配比(dextran∶BSA,摩尔比)5∶1,调节 BSA 浓度为 1.0、2.0、3.0、4.0、5.0 mg/mL,研究所得产物DBSA的乳化活性变化,结果如图4所示。

图4 BSA浓度对DBSA乳化活性的影响Fig.4 Effect of the concentration of protein on emulsifying activity of DBSA
随着BSA浓度的增加,DBSA的乳化活性先升高后降低:当BSA浓度为2.0 mg/mL时,DBSA乳化活性最好(P<0.05),为 26.83 m2/g;BSA 浓度继续增大,其乳化活性反而降低,这与Viviane D的研究结果一致[16]。
2.1.5 缓冲液体系pH值对DBSA乳化活性的影响
控制反应体系温度为90.0℃,反应时间2.0 h,底物配比(dextran∶BSA,摩尔比)为 5∶1,BSA 浓度 2.0 mg/mL,调节缓冲液体系 pH 值为 6.50、7.00、7.50、8.00、8.50,研究所得产物DBSA的乳化活性变化,结果如图5所示。

图5 pH对DBSA乳化活性的影响Fig.5 Effects of pH on emulsifying activity of DBSA
随着缓冲液体系pH值的增加,DBSA的乳化活性逐渐增大,当pH值为8.00时,DBSA乳化活性最好(P<0.05),为 27.32 m2/g;pH 值继续增大,DBSA 乳化活性开始下降,这与Ho Y T等[17]的研究结果一致。
2.1.6 Box-Behnken试验方案及结果
根据表1所设计的试验方案,通过Design-Expert 8.0软件计算出实际水平[18]。试验方案及结果见表2。

表2 Box-Behnken试验设计方案及结果Table 2 Design results of Box-Behnken
2.1.7 模型建立及显著性分析
使用Design-Expert 8.0软件,以Y(乳化活性)对表2中获得的数据进行多元回归拟合分析,得到的二次回归模型方程如下:Y=25.79+3.34 A+2.11 B+4.22 C-0.7D+0.95E-0.47AB+0.94AC-0.37AD-0.86AE+1.07BC+0.45BD+1.96BE+0.67CD+0.69CE+0.95DE-1.85A2-2.60B2-2.60C2-1.78D2-0.81E2。该模型的方差分析结果如表3所示。

表3 响应面二次回归方程模型方差分析结果Table 3 ANOVA for response surface quadratic model analysis of variance table
回归方程模型的F检验显著,失拟项不显著,这表明其他因素对试验结果的干扰较小,该模型能较好地反映数据。证明用此模型进行对DBSA乳化活性的优化是可行的。其中BSA浓度(A),底物配比(B),pH值(C)对乳化活性的影响为极显著,温度(E)对乳化活性的影响为显著,时间(D)对乳化活性的影响不显著;交叉项只有BE对乳化活性的影响为显著;平方项A2,B2,C2,D2对乳化活性的影响为极显著。交叉作用显著的因素的曲面图和等高线图如图6所示。

图6 底物配比和温度相互作用对乳化活性的影响Fig.6 Effect of substrate ratio and temperature interaction on emulsifying activity
2.1.8 最佳接枝产物工艺参数
根据模型求响应面的极值点,理论最佳条件为BSA 浓度 2.78 mg/mL,dextran∶BSA(摩尔比)=6.89∶1,pH值8.50,反应时间2.3 h,反应温度95.0℃,乳化活性最高为32.138 m2/g。以该最佳条件进行试验验证,试验重复3次,乳化活性为(31.743±0.45)m2/g,与预测值接近。这表明该具有一定的实用价值。
2.2 接枝产物结构分析
2.2.1 SDS-PAGE分析
DBSA电泳图谱结果如图7所示。
随着湿法美拉德反应的进行,BSA的特征条带逐渐变浅,而在分离胶顶端出现两条明显的蛋白条带,这表明有大分子量的糖蛋白形成,出现两条分子量不同的蛋白,可能是由于BSA的接枝度不同导致的,且随着反应时间的进一步增加,分子量低的糖蛋白逐渐减少,分子量高的糖蛋白逐渐增多。
2.2.2 HPLC分析
为了进一步研究所形成的糖蛋白的分子量,采用高效液相色谱(HPLC)进行分析,以保留时间为横坐标,标准蛋白分子量的ln值为纵坐标,得到标准曲线如图8所示。
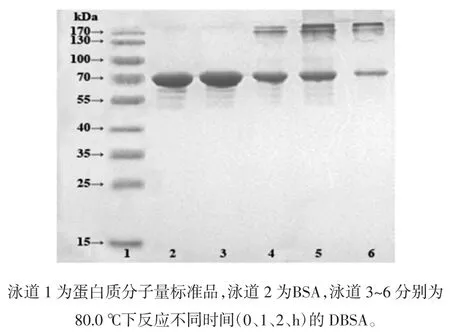
图7 牛血清白蛋白-葡聚糖接枝产物的SDS-PAGEFig.7 SDS-PAGE of BSA-Dextran Graft Product

图8 高效液相色谱洗脱时间标准曲线Fig.8 Standard curve of clution time of HPLC
回归方程为y=-0.592x+15.39,R2=0.987,蛋白质分子量范围在14 kDa~165 kDa内线性关系良好。BSA及DBSA的液相图谱如图9所示。

图9 牛血清白蛋白及接枝产物HPLC图Fig.9 HPLC of BSA and DBSA
由文献[19]可知,蛋白质的分子量越大,保留时间越短,BSA的保留时间为7.182 min,DBSA的保留时间为5.853 min,表明了大分子量的糖蛋白生成,根据标准曲线计算得到新的糖蛋白的分子量约为152 kDa。
2.3 叶黄素包埋颗粒的包封率
图10为经过乙醇注入-高压均质法制备的蛋白-叶黄素包埋颗粒的冻干粉末。

图10 蛋白-叶黄素包埋颗粒的照片Fig.10 Picture of BSA-lutein and DBSA-lutein embedded particles
BSA-lutein粉末颜色为淡黄色,DBSA-lutein相较于BSA-lutein黄色更深,二者复溶后,仅从感官上观察不出区别,但与lutein相比,二者在水中的溶解度有着明显的提高,且溶液在放置一周后,BSA-lutein溶液底部会观察到沉淀,说明叶黄素包埋颗粒聚集形成了大粒子而沉淀,但DBSA-lutein溶液则仍能保持均匀,这证明了蛋白质在与葡聚糖发生接枝反应后能够减少了颗粒的聚集,提高叶黄素的稳定性[20]。根据1.3.7中的方法计算得:接枝后,DBSA-lutein的包封率达到95.86%,高于BSA-lutein的77.82%,这与试验预期的情况相符。
3 结论
本文以乳化活性为指标,通过单因素结合响应面试验优化湿法美拉德反应制备牛血清白蛋白-葡聚糖接枝产物的工艺,得到的二次回归模型方程经检验证明是合理可靠的。其中各因素对乳化活性影响的大小关系为pH值>BSA浓度>底物配比>温度>时间,最佳工艺参数为BSA浓度2.78 mg/mL、dextran∶BSA(摩尔比)=6.89∶1、pH 8.50、反应时间 2.3 h、反应温度 95.0 ℃,此时制得的接枝产物乳化活性为(31.743±0.45)m2/g,分子量约为152 kDa,纯度为89.449%。使用DBSA制备的叶黄素包埋颗粒的包封率达到95.86%。

