蚓激酶对TGF-β1诱导HK-2细胞ColⅠ、PAI-1、NOX4表达的影响
魏晓露,李月红,李国霞
(1.天津中医药大学研究生院,天津 301617;2.天津南开医院肾内科,天津 300100 ;3.天津医科大学国际医学院,天津 300070 )
肾纤维化(renal fi brosis,RF)是慢性肾脏疾病发展至终末期肾功能衰竭的重要病理基础,严重危害人类健康,有效干预纤维化的发生、发展,已受到医学领域的广泛关注[1-2]。蚓激酶是中药地龙中具有蛋白水解作用的单体成分,有激活抗凝,抑制血小板聚集,改善微循环等作用,临床上主要用于防治心脑血管病、下肢深部静脉血栓、肾病综合征等。我们前期研究发现蚓激酶可有效阻抑UUO大鼠肾纤维化的进展[3]。基于前期研究,本实验从体外细胞角度,探讨蚓激酶对转化生长因子-β1(TGF-β1)刺激的人肾小管上皮细胞(HK-2)细胞胶原蛋白Ⅰ(ColⅠ)、纤溶酶原激活物抑制剂-1(PAI-1)、NADPH氧化酶4(NOX4)表达的影响。
1 材料
1.1 实验材料及试剂 人肾小管上皮细胞(HK-2),由天津中医药大学第一附属医院研究所惠赠;蚓激酶购自北京普天同创公司(规格:26000 U/支);盐酸贝那普利购自北京诺华制药有限公司;MTT购自Amresco公司;TGF-β1、DMSO、RIPA裂解液均购自Sigma公司;一抗 ColⅠ、PAI-1、NOX4、GAPDH兔抗大鼠单克隆抗体,二抗山羊抗兔 IgG均购自proteintech公司;TRIpure试剂购自艾德莱公司;cDNA合成试剂盒、实时定量PCR扩增预混合溶液均购自novoprotein公司。
1.2 主要仪器 细胞培养箱(Thermo);倒置显微镜CKX41(Olympus);酶标仪(Thermo Varioskan);电泳仪、转膜装置(美国 Bio-Rad);荧光PCR仪器ABI7500(美国ABI)。
2 方法
2.1 细胞培养 将冻存的HK-2复苏后,加入含10%胎牛血清的DMEM/F12(加入100 U/L链霉素和100 U/L青霉素)培养液在37 ℃、5%CO2的培养箱中培养,每2天更换1次细胞培养液,约培养3~4 d细胞融合至90%以上后可传代培养。
2.2 药物配制 将蚓激酶用含血清培养液溶解配置成1200 U/mL的贮存液TGF-β1用含血清培养液溶解配置成1 mg/mL的贮存液;盐酸贝那普利用DMSO助溶,用含血清培养液配置成终浓度为100 μmoL/L的贮存液,其中DMSO的终浓度≤0.5%。
2.3 MTT法检测不同剂量蚓激酶对HK-2活性的影响 收集对数期细胞,调整细胞悬液浓度为1×105个/mL,在96孔板中每孔加入100 uL细胞悬液,每组设6个复孔,将96孔板放入37 ℃、5%CO2培养箱, 待贴壁后给药(设蚓激酶7个质量浓度:20、40、60、80、100、120、140 U/mL);给药后细胞放入培养箱培养24 h,药物作用结束后,每孔加入 20 uL的MTT(5 mg/mL);终止培养,小心吸去孔内培养液,每孔加入150 uL DMSO,37 ℃温箱孵育 10 min后,用酶标仪检测单波长为490 nm处各孔的光密度(OD)值。
2.4 实验分组 1)正常组;2)模型组:TGF-β1+培养液;3)贝那普利组:TGF-β1+盐酸贝那普利(10 μmol/L)+培养液;4)蚓激酶低剂量组:TGF-β1+蚓激酶(30 U/mL)+培养液;5)蚓激酶中剂量组:TGF-β1+蚓激酶(60 U/mL)+培养液;6)蚓激酶高剂量组:TGF-β1+蚓激酶(120 U/mL)+培养液。其中TGF-β1提前 30 min作用于细胞,TGF-β1的终浓度为10 μg/mL,培养24 h后用于后续检测。
2.5 Western blotting 法检测 PAI-1、NOX4、ColⅠ的蛋白含量 RIPA裂解液提取总蛋白,将各组蛋白调至相同浓度后上样,SDS-PAGE电泳结束后将蛋白转移到PVDF膜上,5%脱脂奶37 ℃封闭3 h,一抗(1:2000稀释)4 ℃孵育过夜,漂洗后,加入二抗(1:10000稀释)37 ℃孵育l.5 h,最后加入ECL在仪器中显色。以GAPDH为内参,应用ImageJ图像分析软件对特异性条带做定量分析,以目标条带与内参的吸光度值比反映蛋白相对表达量。
2.6 荧光定量PCR检测PAI-1、NOX4、ColⅠ的基因表达 TRIpure 试剂提取各组细胞总RNA,鉴定RNA纯度;按照试剂盒说明书进行cDNA合成。PCR引物序列为:
ColⅠ上游5’- GGAGAGAGCATGACCGATGG -3’,
下游5’- GAATCGACTGTTGCCTTCGC -3’;
PAI-1上游5’- CTTCATGGGGCAAGTGATG-3’,
下游5’- TCTCCAGTTTCGTCCAAATGA-3’;
NOX4上游5’- CTTGGTGAATGCCCTCAACT-3’,
下游:5’-TCAGACCAGGAATGGTTG TG-3’;
GAPDH上游5’-CCTTCCGTGTTCCTACCC-3’,
下游5’-AAGTCGCAGGAGA CAACC-3’。反应条件为 95 ℃预变性15 min、95 ℃变性10 s、50 ℃退火/延伸30 s、循环40次,该实验重复3次。反应结果以Ct值表示,采用2-ΔΔCt法对目的基因进行相对定量分析。
3 结果
3.1 蚓激酶对HK-2活性的影响 MTT法显色深浅随孔板中活细胞数增加而逐渐加深,其光密度值(OD)亦随之升高。计算半数抑制率(IC50), IC50约为蚓激酶浓度120 U/mL的加药浓度。见表1。
表1 蚓激酶对HK-2活性的影响(± s ,n = 6)
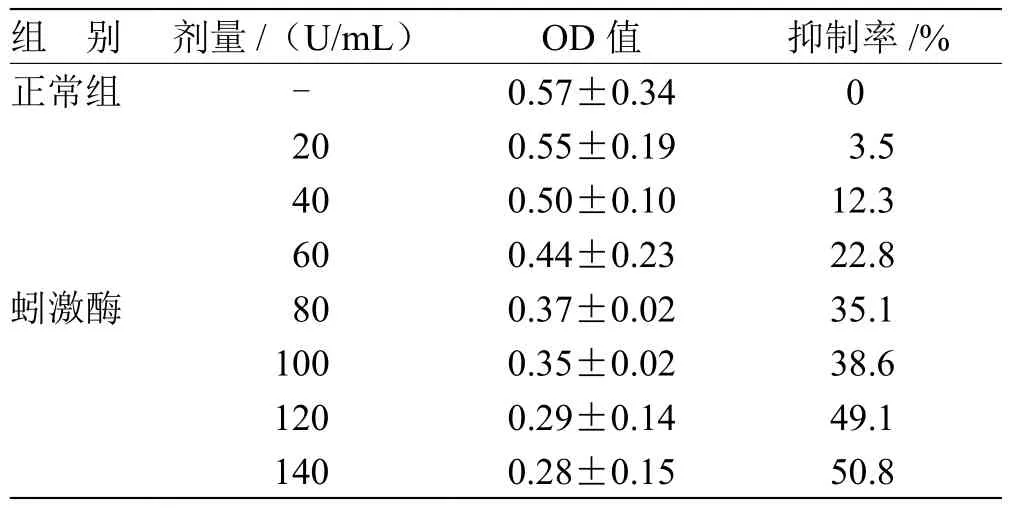
表1 蚓激酶对HK-2活性的影响(± s ,n = 6)
注:n为重复次数
组 别 剂量/(U/mL) OD值 抑制率/%正常组 - 0.57±0.34 0蚓激酶20 0.55±0.19 3.5 40 0.50±0.10 12.3 60 0.44±0.23 22.8 80 0.37±0.02 35.1 100 0.35±0.02 38.6 120 0.29±0.14 49.1 140 0.28±0.15 50.8
3.2 蚓激酶对TGF-β1刺激HK-2细胞ColⅠ、PAI-1、NOX4的蛋白含量的影响 模型组中HK-2经TGF-β1刺激后,与正常组比较,模型组ColⅠ、PAI-1、NOX4的蛋白含量均比正常组升高(P<0.05);贝那普利组及蚓激酶低、中、高剂量组ColⅠ、PAI-1、NOX4的蛋白含量均比模型组降低(P<0.05)。见图1、表 2。

图1 ColⅠ、PAI-1、NOX4及内参GAPDH的蛋白表达
表2 各组HK-2细胞ColⅠ、PAI-1、NOX4的蛋白表达情况(± ,n = 3)s

表2 各组HK-2细胞ColⅠ、PAI-1、NOX4的蛋白表达情况(± ,n = 3)s
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05;n为重复次数
组 别 ColⅠ PAI-1 NOX4正常组 0.07±0.01△ 0.36±0.03△ 0.41±0.03△模型组 1.14±0.12# 1.06±0.09# 1.13±0.09#贝那普利组 0.40±0.02#△ 0.58±0.06#△ 0.71±0.11#△蚓激酶低剂量组 0.97±0.07#△ 0.60±0.04#△ 0.92±0.02#△蚓激酶中剂量组 0.71±0.08#△ 0.59±0.05#△ 0.79±0.06#△蚓激酶高剂量组 0.70±0.02#△ 0.43±0.02#△ 0.75±0.02#△
3.2 蚓激酶对TGF-β1刺激HK-2细胞ColⅠ、PAI-1、NOX4的基因表达影响 与正常相比,模型组ColⅠ、PAI-1、NOX4基因表达均上调(P<0.05),在给药不同浓度的蚓激酶和贝那普利均能明显下调ColⅠ、PAI-1、NOX4基因表达(P<0.05)。见表3。
表3 各组HK-2细胞ColⅠ、PAI-1、NOX4的基因表达情况(± s ,n = 3)
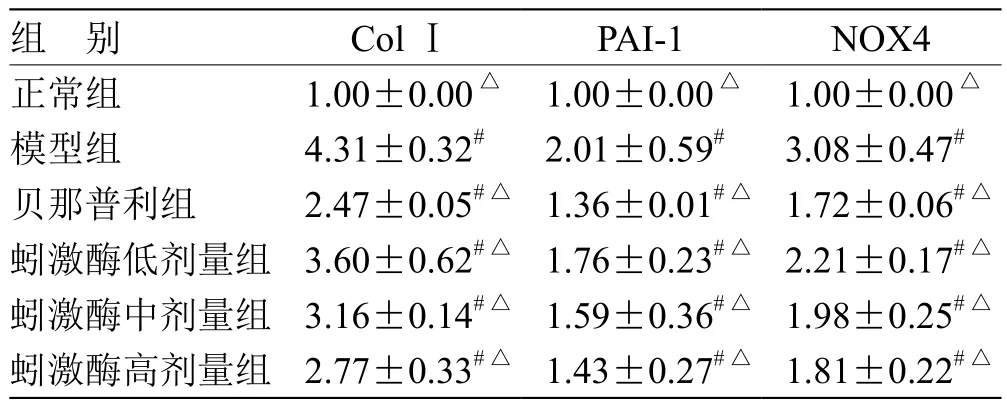
表3 各组HK-2细胞ColⅠ、PAI-1、NOX4的基因表达情况(± s ,n = 3)
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05;n为重复次数
组 别 ColⅠ PAI-1 NOX4正常组 1.00±0.00△ 1.00±0.00△ 1.00±0.00△模型组 4.31±0.32# 2.01±0.59# 3.08±0.47#贝那普利组 2.47±0.05#△ 1.36±0.01#△ 1.72±0.06#△蚓激酶低剂量组 3.60±0.62#△ 1.76±0.23#△ 2.21±0.17#△蚓激酶中剂量组 3.16±0.14#△ 1.59±0.36#△ 1.98±0.25#△蚓激酶高剂量组 2.77±0.33#△ 1.43±0.27#△ 1.81±0.22#△
4 讨论
地龙作为一种虫类药,具有搜风通络、活血祛瘀的功效[4],蚓激酶是从地龙体内提取的一组丝氨酸蛋白酶,因其溶栓能力强、不良反应小等优势而得到广泛关注。蚓激酶的药理作用是多方面的,包括激活抗凝,纤溶,抑制血小板聚集,改善微循环、抗肿瘤、抗炎等。有实验研究表明,蚓激酶对肺纤维化、心纤维化有一定的疗效[5-6],然而关于蚓激酶防治肾纤维化的实验研究尚未见报道。课题组前期研究发现蚓激酶能明显减轻UUO大鼠肾纤维化的病理改变,降低TGF-β1、α-SMA等纤维化因子的含量[3]。基于前期基础,本实验采用TGF-β1诱导HK-2细胞转分化,从细胞层面观察蚓激酶对肾纤维化的保护作用。
肾纤维化是各种类型的肾脏病进展到终末期的重要病理过程[7-8],包括肌成纤维细胞(myof i broblast,MyoFb)增殖和活化、肾小管上皮细胞凋亡、炎症细胞浸润、细胞外基质(extracellular matrix,ECM)在肾组织内过度沉积等[9-11]。肾小管上皮细胞是肾间质纤维化的主要参与者[12-13],TGF-β1作为经典的促纤维化因子[13],刺激HK-2细胞后,小管上皮细胞向间充质细胞转化[14-15],使HK-2细胞转化为MyoFb。MyoFb合成分泌Ⅰ型胶原、Ⅲ型胶原(ColⅠ,Col Ⅲ)、纤维连接蛋白(f i bronectin,FN)增多,加剧ECM的聚集,导致ECM在肾组织的过度沉积,引起肾纤维化。纤溶酶原激活物(PA)和PAI-1是调节ECM降解过程中蛋白溶解和抗蛋白溶解的重要参与者[16],纤溶酶可直接降解ECM,肾内PA/ PAI-1平衡失调可影响纤溶酶生成,促进肾间质纤维化发生。Yamaguchi I 等[17]发现PAI-1表达上调还可使肾间质MyoFb增多,TGF-β1和ColⅠ表达增加,而尿激酶活性显著减低。氧化应激在肾纤维化发生发展中起着重要的作用,活性氧(reactive oxygen species,ROS)是氧化应激过程中最重要的信号分子[18],而NOX4产生的ROS是肾纤维化时肾组织局部ROS的主要来源。NOX4可通过影响肾血流动力学、促进炎症反应、影响肾小管基底膜结构稳定性、介导TGF-β1各种通路来影响肾纤维化进程[19]。肾小管上皮细胞通过成纤维细胞活化和诱导氧化应激,增加各种炎症因子和趋化因子的表达,最终导致肾脏纤维化的发生[20]。
实验结果表明,HK-2细胞在TGF-β1刺激下,各组ColⅠ、PAI-1、NOX4蛋白和基因表达较正常组相比均升高;与模型组相比,蚓激酶各组ColⅠ、PAI-1、NOX4蛋白和基因表达也均有着不同程度的降低,说明蚓激酶可能是通过纠正纤溶平衡和阻抑氧化应激,从而对肾纤维化起到一定的防治作用。然而蚓激酶是通过具体何种通路对肾纤维化起防治作用,需要今后进一步实验研究。

