磷酸化对人中心蛋白2与蜂毒素作用的影响
赵亚琴,杨静
(山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
0 引言
人中心蛋白2(human centrin 2,HsCen2)是真核生物中高度保守、结合Ca2+的一种弱酸性蛋白,属于EF-hand超家族中钙调蛋白(calmodulin,CaM)的成员之一[1-3]。中心蛋白与中心体和基体功能密切相关,它主要集中在微管组织中心(microtubule-organizing centers,MTOC)周围,在细胞分裂过程中扮演着多重角色,参与中心体的复制和分离,并且是核苷酸切除修复系统中必不可少的成员[4]。该蛋白由172个氨基酸残基组成,其分子量约为20 kDa。
磷酸化是通过蛋白激酶将ATP的磷酸基转移到蛋白特定位点上的生化过程。磷酸化的作用位点为蛋白上的Ser、Thr或Tyr残基[5]。在磷酸化调节过程中,细胞的形态和功能都会发生改变。可逆的磷酸化过程几乎涉及所有的生理及病理过程,包括细胞周期、基因转录和 RNA翻译后的调控、代谢通路、神经元生长、信号转导以及记忆过程等[6-8]。研究表明,磷酸化可以调节中心蛋白的结构和生化活性,人中心蛋白和绿藻中心蛋白都可以在体内发生磷酸化,人中心蛋白2的磷酸化修饰与中心体的复制有关。绿藻中心蛋白的磷酸化作用与鞭毛根部的收缩和扩张以及细胞核的运动有关[9-11]。在癌症研究中发现,微管蛋白的磷酸化可能导致癌症的发生[12]。1998年,Lingle等人在乳腺癌细胞的中心体中发现了中心蛋白的异常磷酸化,这表明磷酸化的中心蛋白的产生与异常的细胞周期调节有关。在磷酸化后,中心蛋白的构象和表面电荷发生变化,这可能会影响它与下游靶蛋白结合[9]。因此,研究中心蛋白的磷酸化行为是很重要的。
中心蛋白生物功能的实现与其靶蛋白密切相关[13]。中心蛋白与其下游靶蛋白共同参与,完成了核苷酸切除、修复与识别过程,着色性干皮病组C蛋白 (Xeroderma Pigmentosum Group C Protein,XPC)为其中的一个重要蛋白[14]。HsCen2可以与XPC的一段氨基酸组成的小肽以1∶1形式结合,形成稳定的二元复合物。复合物HsCen2-XPC的晶体结构(PDB ID:2OBH)也进一步证实了该结论[15]。蜂毒素是一种钙调蛋白作用的模拟靶肽,包含26个氨基酸残基(GIGAVLKVLTTGLPALISWIKRKRQQ-NH2),在生理pH条件下,带有5个单位的正电荷[16]。它具有与中心蛋白靶蛋白结合的保守性序列WLL。本文以蜂毒素为人中心蛋白2的模拟靶肽,通过非变性聚丙烯酰胺凝胶电泳(native polyaarylamide gel electrophoresis,native-PAGE)、聚丙烯酰胺凝胶电泳(SDS polyarylamide gel electrophoresis,SDS-PAGE)、荧光光谱以及远紫外圆二色光谱(CD)方法研究了蜂毒素与磷酸化前后人中心蛋白2的相互作用。结果表明蛋白激酶A(protein kinase A,PKA)可以催化HsCen2 Ser170磷酸化反应,形成磷酸化的HsCen2(phosphorylated HsCen2,HsCen2p),磷酸化修饰后使得蛋白的α-螺旋含量明显减少,疏水空腔外露程度减弱。荧光光谱表明HsCen2、HsCen2p与蜂毒素均可形成1∶1的复合物,其结合能力分别为(3.9±0.12)×106、(1.5±0.05)×105L/mol。
1 实验部分
1.1 材料
三磷酸腺苷二钠(ATPNa2),超高纯级,Solarbio公司;N-2-羟乙基哌嗪-N′-乙磺酸(4-(2-Hydroxy Ethyl)-1-Piperazine Ethane Sulfonic acid,Hepes),分析纯,Sigma公司;2-对甲苯胺基-6-萘磺酸(2-p-toluidinyinaphthalene-6-sulfonate,TNS),纯度95%(质量分数),Sigma公司;蜂毒素(melittin),纯度达95%(质量分数)以上,Sigma公司。
1.2 HsCen2磷酸化修饰
人中心蛋白2(human centrin 2,HsCen2)、蛋白激酶A(protein kinase A,PKA)的表达、纯化均与八肋游仆虫中心蛋白类似[5]。将纯化得到的HsCen2 (5×10-3mol/L)、蛋白激酶A(protein kinase A,PKA)(0.5 mg/mL)与Mg2+(1.1×10-2mol/L)、ATPNa2(2.42×10-3mol/L) 溶解在0.01 mol/L的Hepes中,30℃条件下恒温水浴孵育10 h。多余的金属离子、ATP等通过PD-10脱盐柱除去。蛋白浓度采用Cary 50 UV-Vis紫外可见分光光度计测定280 nm处的吸光度,根据朗伯比尔定律A=εbc测定蛋白的浓度。ε280(HsCen2p)=1 490 L/mol·cm。
1.3 远紫外圆二色光谱
CD光谱的测定在室温下,0.01 mol/L Hepes,pH=7.4,光程为1 mm,使用Applied Photophysics 型圆二色谱仪进行数据采集。扫描范围为190 nm~250 nm。实验所获得的光谱图均为3次取其平均值,其中α-螺旋含量通过杨氏方程[16]求得。
(1)
1.4 荧光光谱测定
使用HORIBA-FluoroMax-4型荧光光谱仪测定TNS与HsCen2、HsCen2p的相互作用,激发波长为320 nm,激发、发射狭缝宽度均为10 nm,反应时间间隔均为3 min。为消除滴定过程中的稀释效应,数据处理过程中将荧光强度转化为摩尔荧光强度。
同样使用HORIBA-FluoroMax-4型荧光光谱仪测定磷酸化前后人中心蛋白2与melittin的相互作用,激发波长为295 nm,扫描范围为305~550 nm,激发狭缝宽度和发射狭缝宽度均为10 nm,反应时间间隔为3 min,结合常数为Ka和结合位点数n,由公式(2)求得。
(2)
F0,F分别为蛋白(HsCen2、HsCen2p)中存在或不存在melittin条件下蛋白在331 nm处的荧光强度。[Q]为蛋白(HsCen2、HsCen2p)的浓度,通过log[(F0-F)/(F-F∞)]对log[Q]作图,获得结合位点数及结合常数。数据处理过程中扣除滴定过程中所产生的稀释效应。所有荧光实验均在室温获得。
2 结果与讨论
2.1 人中心蛋白2的磷酸化修饰
在30℃,ATP、Mg2+存在下,蛋白激酶A(protein kinase A,PKA)与HsCen2过夜反应,HsCen2表达、纯化的SDS-PAGE图为1(A)所示。磷酸化反应产物电泳迁移结果如图1(B)所示。蛋白激酶A的磷酸化作用位点为蛋白上的Ser和Thr,由于HsCen2的C末端包含了蛋白激酶A可以识别的共有序列(KKTS*LY)[17],而Ser恰好位于HsCen2的第170位氨基酸,所以在特定的条件下,蛋白激酶A可以对HsCen2的Ser170的位点进行磷酸化修饰。磷酸化修饰HsCen2使得Ser170与磷酸氢根形成酯健,蛋白所带负电荷有所增加,另一方面,蛋白质被磷酸化修饰后,其自身的形态和功能会发生一定的改变,同时蛋白质的分子量增加。如果只有单一的氨基酸残基被磷酸化,则其分子量相应的增加80 Da[15]。该蛋白在native-PAGE中的迁移率受到电荷影响更为明显,因此磷酸化后更靠近负极[17]。

Fig.1 (A) SDS-PAGE analyze of HsCen2 expression and purified. Lane M was the protein molecular weight standards; Lane1, Lane2, Lane3 were induced to express the whole bacteria, supernatant and precipitation respectively. Lane 4 was the purified target protein.(B) Native PAGE analysis of HsCen2 (lane 1) and HsCen2p (lane 2)图1 (A) SDS-PAGE分析HsCen2表达、纯化图。泳道M为蛋白标准分子量,泳道1、2、3分别为诱导表达后的全菌、上清、沉淀,泳道4为目标蛋白。(B) HsCen2和HsCen2p天然胶电泳图
DEAE离子交换层析保留了琼脂糖极好的亲水性,与生物活性大分子有很好的相容性,具有离子交换容量高、特异性吸附少和流速快等特点,广泛用于蛋白质、核酸及多肽等生物大分子的实验室制备。本文通过DEAE离子交换层析法检测HsCen2和HsCen2p的行为差异。如图2所示,HsCen2在DEAE的洗脱体积为33.7 mL,而HsCen2p在DEAE的洗脱体积为34.5 mL,洗脱体积明显增大。DEAE阴离子交换层析柱结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,然后通过提高洗脱液中的盐浓度,将吸附在柱子上的蛋白质洗脱下来。结合能力较弱的蛋白质首先被洗脱下来,磷酸化修饰HsCen2后蛋白所带负电荷增多,使得HsCen2p与DEAE离子交换层析柱结合能力增强,洗脱时置后与HsCen2蛋白,从而洗脱柱体积增加。结合PKA对蛋白磷酸化修饰的氨基酸序列要求,可进一步证明PKA可以对HsCen2进行磷酸化修饰,且Ser170为其磷酸化位点。

Fig.2 Elution peaks of HsCen2 and HsCen2p in DEAE affinity chromatography图2 HsCen2和HsCen2p在DEAE亲和层析柱中的洗脱峰
2.2 磷酸化修饰后人中心蛋白2的构象变化
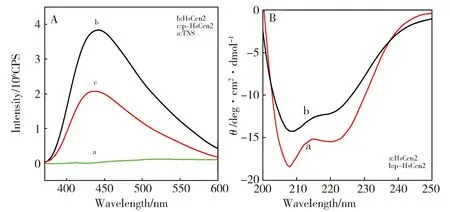
Fig.3 (A) Fluorescent spectra of TNS alone (a),in the presence of HsCen2 (b) and HsCen2p (c); in 0.01 mol/L Hepes, (pH 7.4, at 25 ℃), [Protein]=10 μmol, [TNS]/[Protein]=10∶1.(B) Far-UV CD spectra of HsCen2 (a) and HsCen2p (b).图3 (A) TNS在不同溶液中的荧光光谱,TNS (a),HsCen2-TNS (b),HsCen2p-TNS (c); 在0.01 mol/L Hepes (pH 7.4, 25 ℃) 的条件下, [蛋白]=10 μmol,[TNS]/[蛋白]=10∶1。(B) HsCen2 (a) 和HsCen2p (b) 的远紫外圆二色光谱
2-对甲苯胺基-6-萘磺酸(TNS)是一种重要的疏水性荧光探针,它在极性溶剂中与非极性溶剂中的荧光峰位置、峰强度明显不同[16]。据此,可通过观察TNS荧光峰的移动以及强度变化来探测蛋白质的结构变化。由图3(A)可见,0.01 mol/L Hepes缓冲溶液中,TNS的荧光强度几乎为零(图3(A)曲线a),在HsCen2溶液中加入TNS([TNS]/[HsCen2]=10∶1)后其荧光强度增大到4.1倍(图3(A)曲线b),证明TNS的微环境发生了改变;同时伴随TNS荧光峰从505 nm移动到438 nm,探针微环境的极性增大,推测TNS与HsCen2的疏水腔存在相互作用。同样,将TNS加入到HsCen2p溶液中([TNS]/[HsCen2p]=10∶1)也可以观察到探针荧光峰从505 nm移动到433 nm,荧光强度增强了2.1倍(图3(A)曲线c)。与HsCen2相比,磷酸化修饰后中心蛋白的疏水结构域的外露程度明显减弱。Ser170磷酸化修饰后改变了蛋白的构象,因此导致其荧光强度明显不同。由图3(B)曲线a可见,HsCen2的远紫外圆二色光谱在208 nm以及222 nm处有负吸收出现,这是富含α-螺旋结构蛋白质的典型特征(由杨氏方程(1)计算得知)HsCen2的α-螺旋含量为53%。HsCen2p的远紫外圆二色光谱信号也出现在208 nm和222 nm,但其CD信号值减小22%,说明Ser170磷酸氢根的引入引起中心蛋白二级结构的改变。
2.3 HsCen2、HsCen2p与蜂毒素的相互作用
HsCen2属于仅含苯丙氨酸(Phe)和酪氨酸(Tyr)而不含有色氨酸(Trp)残基的A类蛋白,蜂毒素含有一个Trp,因此可以利用蜂毒素中Trp为探针分子去检测中心蛋白与蜂毒素的作用[18]。由图4(A)曲线b可见,蜂毒素的荧光峰位于356 nm,与Trp在水溶液中的发射光谱相似,证明色氨酸的微环境是亲水的。将HsCen2加入到蜂毒素溶液中蜂毒素的荧光峰逐渐蓝移到340 nm(曲线c),表明蜂毒素的Trp残基的微环境发生了改变,从一个极性环境转移到了一个非极性的疏水性的环境中。同时伴随有Trp残基的荧光强度大大增强,推测HsCen2与蜂毒素发生了相互作用。另外,等当量蜂毒素与HsCen2混合溶液的荧光光谱(曲线c)与HsCen2荧光光谱与蜂毒素光谱的理论加和光谱(曲线d)图完全不同,进一步证明蜂毒素与HsCen2相互作用形成了复合物。HsCen2滴定蜂毒素的荧光光谱见图4(B)。随着HsCen2的加入,蜂毒素Trp荧光峰逐渐移动,荧光强度逐渐增强,当[HsCen2]/[蜂毒素]=1∶1时荧光强度值达到最大,说明HsCen2与蜂毒素可以形成1∶1复合物。由HsCen2对蜂毒素滴定的滴定曲线(图4B插图),由公式(2)计算得到其结合常数为(3.9±0.12)×106L/moL。同样,PKA磷酸化HsCen2后的蛋白HsCen2p可以与蜂毒素结合,其荧光发射峰位置也有相应的移动,其结合比为1∶1,图4(C)插图由公式(2)计算得结合常数为(1.5±0.05)×105L/mol。结合TNS检测磷酸化前后蛋白的疏水表面暴露减少,进一步证明磷酸化修饰HsCen2使得Ser170与磷酸氢根形成酯健后改变了蛋白的构象,由于磷酸化位点和靶肽结合位点都在HsCen2的C末端,而磷酸化位点不在EF-hand结构域,带有5个单位正电荷的蜂毒素与HsCen2 C端的EF-hand结构域作用时,并没有受磷酸化负电荷增加的影响,只是由于疏水腔暴露减小的原因,已有文献报道蛋白与靶肽的主要作用力为疏水作用[11],进一步论证了磷酸化修饰后降低了蛋白与蜂毒素的相互作用能力。

(A) HsCen2 (a), melittin (b), complex of HsCen2-melittin (c), and the calculated sum spectra of the same concentration of HsCen2 and melittin (d). (B) Fluorescence titration spectra of the melittin by HsCen2. InsetPlot of fluorescence intensities of protein at 331nm as a function of [HsCen2]/[melittin]. (C) Fluorescence titration spectra of the melittin by HsCen2p. InsetPlot of fluorescence intensities of protein at 331nm as a function of [HsCen2p]/[melittin]Fig.4 Fluorescence spectra of HsCen2 and melittin monitored by Trp fluorescence of melittin in 0.01 mol/L Hepes (pH 7.4)(A) HsCen2 (a),蜂毒素 (b),HsCen2-蜂毒素的复合物(c),HsCen2与蜂毒素的荧光光谱强度的叠加(d);(B) HsCen2滴定蜂毒素的荧光光谱,插图为331nm 处的荧光强度随[HsCen2]/[蜂毒素]比值的变化曲线;(C) HsCen2p滴定蜂毒素的荧光光谱,插图为331nm 处的荧光强度随[HsCen2p]/[蜂毒素]比值的变化曲线图4 HsCen2与蜂毒素的相互作用的荧光光谱
如上所述,HsCen2是典型富含α-螺旋二级结构的蛋白。溶液中游离靶肽没有经典的二级结构,因此可以通过检测中心蛋白CD信号的变化研究HsCen2与蜂毒素的相互作用。如图5A曲线a所示,蜂毒素在溶液中呈现无规则卷曲[16]。将等当量蜂毒素加入HsCen2溶液中,由杨氏方程(1)计算得知HsCen2的α-螺旋含量减小23%。(图5(A)中b),曲线c为HsCen2的CD光谱图,证明蜂毒素与中心蛋白结合后二级结构发生变化。当HsCen2p溶液(图5(B)中c)中加入蜂毒素 (图5(B)中a)时,混合溶液的CD信号(图5(B)中b)与HsCen2p相比变化不明显,说明磷酸化修饰改变了中心蛋白与蜂毒素的作用。
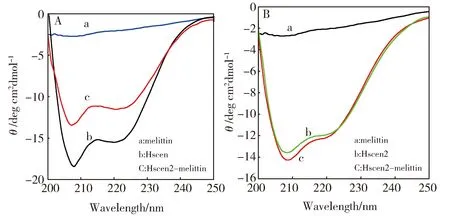
(A) CD spectral of melittin (a), HsCen2-melittin complex ([HsCen2]/[melittin]=1) (b), HsCen2 (c); (B) CD spectral of melittin (a), HsCen2p-melittin complex ([HsCen2p]/[melittin]=1) (b), HsCen2p (c)Fig.5 Far-UV CD spectra of HsCen2 and HsCen2p in the absence or presence of melittin(A) HsCen2与蜂毒素的相互作用的光谱图,蜂毒素 (a), HsCen2-蜂毒素的复合物([HsCen2]/[蜂毒素]=1) (b), HsCen2 (c);(B) HsCen2p与蜂毒素的相互作用的光谱图,蜂毒素(a), HsCen2p-蜂毒素的复合物([HsCen2p]/[蜂毒素]=1) (b), HsCen2p (c)图5 蜂毒素与 HsCen2、HsCen2p相互作用的远紫外圆二色光谱图
3 结论
本文通过非变性聚丙烯酰胺凝胶电泳、聚丙烯酰胺凝胶电泳、荧光光谱及远紫外圆二色光谱法探究了HsCen2、HsCen2p与蜂毒素的相互作用。结果表明,蛋白激酶A可以催化HsCen2使得其发生磷酸化反应,磷酸化修饰后的HsCen2构象有所改变。HsCen2、HsCen2p都可以与蜂毒素形成1∶1复合物,其结合常数分别为:(3.9±0.12)×106、(1.5±0.05)×105L/mol。说明磷酸化修饰HsCen2使得Ser170与磷酸氢根形成酯健后改变了蛋白的构象,从而降低了蛋白与蜂毒素的相互作用能力。

