氮限制和海洋酸化对颗石藻Emiliania huxleyi NIWA1108生理指标的交互影响
廖 晏,冯媛媛,刘 瑶,李文学,李敬鸿,倪红东,石文婷
(天津市海洋资源与化学重点实验室,天津科技大学海洋与环境学院,天津 300457)
工业革命以来,人类活动的加剧导致大气中二氧化碳(CO2)排放量急剧上升,到21 世纪末,CO2浓度将超过800µatm[1].海洋吸收了人为排放CO2的1/3[2],大量CO2被海洋持续吸收,导致海水pH 降低,被称为海洋酸化(ocean acidification)[3].研究[4-5]表明,海洋酸化可影响海洋浮游植物的生长,尤其是对于具有钙化作用的藻类[6-8].此外,CO2是温室气体的重要组成部分,对全球气候起到重要的调节作用.随着CO2浓度不断升高,温室效应增强使得温度不断升高,导致冰川融化和降雨模式发生改变,从而增强海水分层、减低海洋混合层深度[9]、削弱从深海向表层海水的营养盐补充、加剧大洋表层水体的营养盐限制[10].
海洋颗石藻是一类生产碳酸钙(CaCO3)颗石粒作为外壳的单细胞浮游植物[11],它们能够通过光合作用和钙化作用进行有机碳和无机碳(CaCO3)的生产[12],贡献了全球海洋CaCO3生产量的50%,在海洋碳循环中起重要作用[10,13-15].除极地及热带海域外,颗石藻(Emiliania huxleyi)在全球海洋中都有广泛分布,并在很多海域中出现大规模可通过卫星遥感图像观测到的季节性水华[16-18],成为海洋碳循环研究中的模式生物[18].近年研究[19]表明,Emiliania huxleyi 的钙化作用对海水碳酸盐化学体系的变化响应尤为敏感,并存在明显的株间特性.除海洋酸化外,其生长、钙化作用及光合作用等生理学过程还受到其他环境因子的影响,如光照、温度、营养盐浓度变化等[19-23].因此,研究海洋酸化和其他环境因子的交互作用对颗石藻生理学指标的影响,对进一步预测未来多因子共同变化的海洋环境中Emiliania huxleyi 的生理学响应尤为重要.氮是维持浮游植物生长的一种重要的生源要素,也是在全球大洋水体中限制浮游植物初级生产的重要营养盐,然而针对海洋酸化和氮限制的交互作用对Emiliania huxleyi 的生理学指标影响的相关研究,尤其是在稳态生长下该藻的生理学响应却鲜有报道[20,24].本研究拟采用恒化培养装置对颗石藻Emiliania huxleyi NIWA1108 进行实验室内受控连续培养实验,研究海洋酸化和氮限制对该藻生理学指标在其稳态生长条件下的交互影响效应.
1 材料与方法
1.1 实验设置
本实验所用颗石藻是颗石藻钙化株Emiliania huxleyi NIWA1108,于2009 年分离自新西兰以东Chatham Rise 海域(41°35.8′S,175°41.5′E),在实验室中用f/20 海水培养基(10 倍稀释后的f/2 配方)进行保种培养[25],培养条件为 15 ℃、光照强度 80~110µmol/(m2·s)、光/暗周期为12 h/12 h.配制培养基所使用的海水取自于南海寡营养海域SEATS 站表层,并在使用前通过0.2µm 孔径的囊式滤器进行过滤处理,以达到无菌效果.
氮限制培养实验采用自制恒化培养器进行,共设置4 个处理组:(1)对照:p(CO2)400µatm,氮充足(n(N)/n(P)=24);(2)酸化:p(CO2)800µatm,氮充足;(3)氮限制(n(N)/n(P)=2.4):p(CO2)400µatm,低氮;(4)酸化+氮限制:p(CO2)800µatm,低氮.培养基采用过滤后SEATS 站表层海水配制,磷酸盐、微量元素及维生素添加至f/20 配方水平.氮充足条件下的培养基硝酸盐浓度添加至 f/20 水平(88µmol/L);低氮条件下硝酸盐浓度添加至8.8µmol/L(n(N)/n(P)=2.4).初始接种丰度为1.0×104mL-1,采用恒化培养器在培养箱内进行连续培养,至接种后第3 天打开蠕动泵,开始连续培养实验.培养基采用蠕动泵连续泵入培养瓶(培养瓶体积为3.6 L,为聚碳酸酯材质)中,每个培养瓶瓶颈处与流出口相连,以保证培养体系体积恒定.蠕动泵的稀释速率对于氮充足和氮限制处理组分别设置为0.5 d-1和0.2 d-1.实验过程中使用具有特氟龙涂层的搅拌器连续低速搅拌,使得藻液分布均匀.培养实验在恒温光照培养箱中进行,温度及光照条件与保种条件保持一致.
1.2 海水碳酸盐体系调节
采用曝气法调节海水培养基的碳酸盐体系.其中空气对照组(p(CO2)400µatm)向其中一桶海水中曝空气(空气中平均p(CO2)400µatm,从实验开始曝气直到实验结束),另一桶海水中通入空气和CO2混合气体(p(CO2)800µatm,从实验开始通气直到实验结束),气体在通入水体前均经0.22µm 的滤膜过滤.培养开始前,海水培养基曝气时间大于24 h,且在培养期间,储存海水培养基的储水桶和培养瓶一直保持持续曝气.各培养瓶中在细胞生长达到稳态后的碳酸盐体系各参数见表1,采用CO2SYS 1.05 版软件进行计算[26].

表1 采样时恒化器中碳酸盐化学体系参数Tab.1 Carbonate chemistry parameters in the chemostat vessels at the time of sampling
1.3 藻种培养
将处于指数生长期的 Emiliania huxleyi NIWA1108 接种于3.5 L 的培养液中,初始细胞丰度为1.0×104mL-1,置于光照培养箱中连续培养15 d.每隔24 h 取5 mL 藻液,分成3 份:一份用Trilogy 荧光仪测定活体荧光值;一份用pH 计测定pH;最后一份固定后用于细胞计数.培养至其生长进入稳态超过5 d(每个处理组中藻细胞丰度保持相对稳定,变化小于10%)后,进行最终采样,采样参数为活体荧光、pH、细胞计数、叶绿素a(Chl-a)、沉降速率及细胞元素组成.细胞元素组成包括颗粒有机磷(POP)、颗粒有机碳(POC)、颗粒无机碳(PIC)及颗粒有机氮(PON)含量.
1.4 样品分析
1.4.1 藻细胞计数及Chl-a 质量浓度的测定
取 1 mL 藻液并加入 6 μL 碱性鲁格氏溶液(Lugol’s)[27],并在4 ℃于暗处保存,最后用微藻计数框在显微镜下观测计数.取样至最后观测时间间隔不超过一周.
量取 30 mL 藻液,用隔膜真空泵过滤到Whatman GF/F 玻璃纤维膜上(直径25 mm),并保存于-20 ℃的冰箱中.测定时,在暗处将膜置于20 mL棕色玻璃瓶中,添加5 mL 体积分数为90%的丙酮,于-20 ℃暗处理24 h 后,用 Turner 型荧光仪测定其荧光值,根据式(1)[28]计算Chl-a 质量浓度(μg/L).

1.4.2 细胞元素组成的分析
POP 含量用钼酸盐测定法[29]进行测定.取30 mL 藻液过滤到经马弗炉灼烧(450 ℃,4 h)过的GF/F 膜上,用2 mL 0.17 mol/L 的Na2SO4溶液润洗,转移到经马弗炉灼烧(450 ℃,4 h)的硼酸盐闪烁瓶中,用2 mL 0.017 mol/L MgSO4溶液浸没附有藻液的GF/F 膜,然后将其置于60 ℃烘箱中,直至烘干.分析前,将装有GF/F 膜的闪烁瓶置于马弗炉中450 ℃灼烧4 h,冷却后向其中加入5 mL 0.2 mol/L 盐酸,旋紧瓶盖置于90 ℃烘箱中烘30 min.冷却后,加入染色剂[29],静置10~20 min,用紫外-可见分光光度计测定吸光度.过滤3 份等体积的培养基,作为空白样.
POC、PIC 和PON 含量用CHN 元素分析仪进行测定.取2 份100 mL 藻液分别过滤到事先经马弗炉灼烧(450 ℃,4 h)过的GF/F 膜上,一份不进行酸化处理,直接在60 ℃下烘干,用于测定总颗粒碳(TPC)含量;另一份用浓盐酸熏蒸3 h 后置于烘箱中60 ℃烘干,用来测定POC 和PON 含量.TPC 和POC 的差值即为PIC 含量.
1.4.3 沉降速率的测定
同源性采样法[30]用于测定浮游植物沉降速率.将沉降柱竖直固定在支架上,堵住3 个出水口,把藻液混匀,倒入沉降柱中,使藻液充满沉降柱,盖好沉降柱使其密封(避免气泡),在相同温度下避光静置2~4 h.从上到下分层取样,记录各层藻液体积,并分别过滤至GF/F 膜上,保存于-20 ℃的冰箱中,用于测定其叶绿素生物量.根据Bienfang[30]的沉降公式计算沉降速率.
1.4.4 扫描电镜图像观察
取1~5 mL 藻液过滤至0.6µm 聚碳酸酯滤膜上,过滤时控制压力小于0.02 MPa,再将滤膜轻轻平铺于培养皿中,自然风干.最后,用JSM-IT300 型扫描电子显微镜进行形态观察并拍照.
1.5 数据分析
环境因子的交互效应按照Folt 等[31]方法计算,单一环境因子(酸化(A)或氮限制(N)或两环境因子共同变化(A+N)下对某生理生化参数的表观影响(observed effect,OE)按照该处理组与对照组的变化百分比计算而得(正值为正向升高效应,负值为负向降低效应),二者的交互效应(multiplicative effect,ME)按照公式[31]:MEA+N=(1+OEA)×(1+OEN)-1计算.当|OEA+N|>|MEA+N|时,两种环境因子为协同性交互效应;当|OEA+N|<|MEA+N|时,两种环境因子为对抗性交互效应.由于本实验采用恒化连续培养方式,每个处理组到最终采样时已在各培养条件下保持若干代的稳定生长状态,没有平行样带来的误差,因此可以得到相应降低[32].
2 结 果
2.1 细胞Chl-a 含量
不同条件下Emiliania huxleyi NIWA1108 的细胞Chl-a 含量如图1 所示.当硝酸盐浓度一致,不同CO2分压条件下Emiliania huxleyi NIWA1108 胞内Chl-a 含量变化较小.但是在氮限制的条件下,p(CO2)400µatm 处理组中胞内Chl-a 含量与氮充足条件下相比降低了58.9%.在高二氧化碳分压和氮限制的共同作用下,胞内的Chl-a 含量进一步降低,比p(CO2)400µatm、氮充足的对照组降低了66.2%.
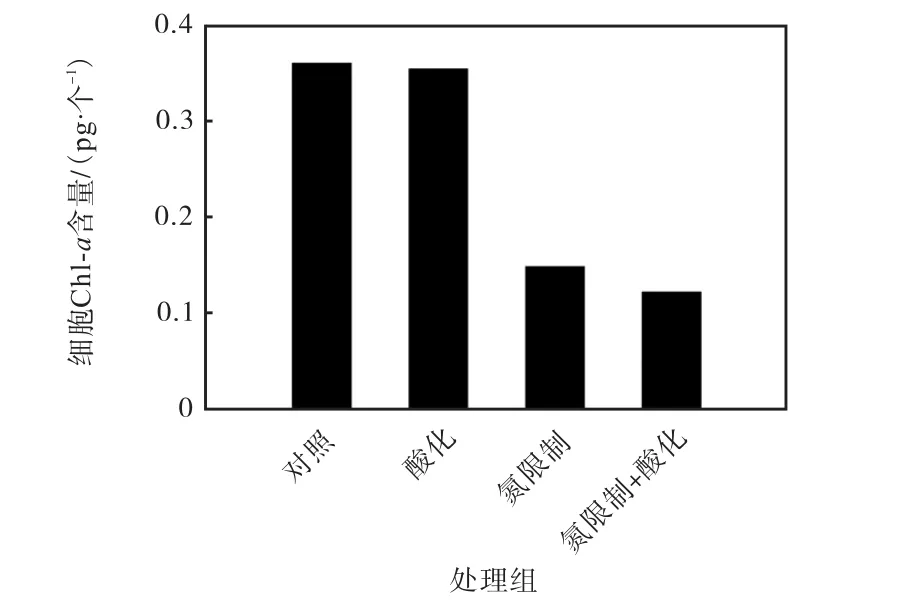
图1 不同条件下Emiliania huxleyi NIWA1108 的细胞Chl-a 含量Fig.1 Contents of cellular chlorophyll a in Emiliania huxleyi NIWA1108 under different conditions
2.2 细胞元素含量
Emiliania huxleyi NIWA1108 的细胞POP 含量受到CO2分压升高和氮限制的影响(表2).在氮充足的条件下,仅升高CO2分压,细胞POP 含量比对照组降低23.1%;在氮限制条件下,细胞POP 含量比对照组降低了48.8%;高CO2浓度和氮限制的共同作用下,细胞POP 含量进一步降低,降低了65.4%.
与细胞POP 含量相似,细胞PON 含量随CO2分压升高有下降的趋势(表2),而氮限制则进一步降低了该含量.在酸化和氮限制的共同作用下细胞内PON 含量下降程度最高(与对照组相比降低了54.0%).
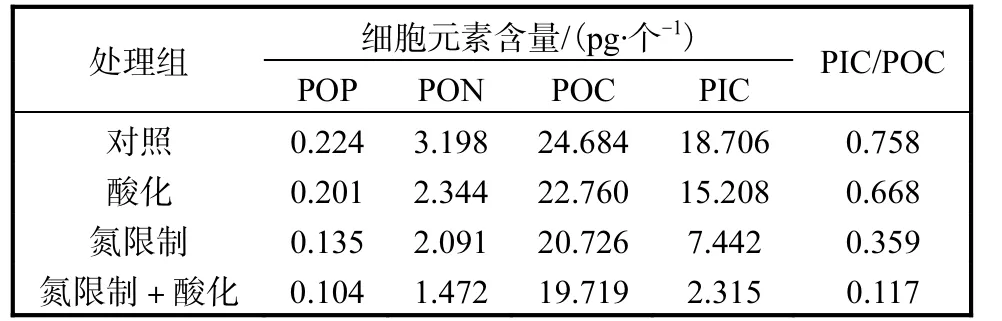
表2 不同条件下Emiliania huxleyi NIWA1108 的细胞元素含量Tab.2 Cellular elemental contents of Emiliania huxleyi NIWA1108 under different conditions
二氧化碳分压的升高及氮限制均使细胞POC 含量略有下降(表2),与对照组相比,分别降低7.8%和16.0%,而酸化+氮限制组则进一步降低,较对照组低20%.而PIC 含量受海水酸化以及氮限制的影响比较大(表2),酸化组中Emiliania huxleyi NIWA1108的细胞PIC 含量与对照组相比降低了18.7%;氮限制使得PIC 含量大大降低(与对照组相比降低60.2%);氮限制和海水酸化的共同作用下,进一步降低了PIC含量(与对照组相比降低87.6%).
与对照组相比,仅升高CO2分压的酸化组中,细胞PIC 与POC 比值(PIC/POC)有所降低(表2),降低了11.8%,氮限制下PIC/POC 下降得更为明显,氮限制处理组中PIC/POC 较对照组降低了52.6%;在酸化+氮限制处理组,细胞PIC/POC 最低,比对照组降低84.5%,比酸化组降低82.4%.
2.3 沉降速率
高CO2分压条件下(酸化组)Emiliania huxleyi NIWA1108 的沉降速率较对照组略有降低,而氮限制更加明显地降低了其沉降速率,氮限制及酸化+氮限制处理组分别较对照组下降47.9%和48.4%(图2).

图2 不同条件下Emiliania huxleyi NIWA1108 的沉降速率Fig.2 Sinking rates of Emiliania huxleyi NIWA1108 under different conditions
2.4 细胞形态
不同条件下Emiliania huxleyi NIWA1108 的扫描电镜照片如图3 所示.

图3 在不同条件下Emiliania huxleyi NIWA1108 的扫描电镜照片Fig.3 SEM images of Emiliania huxleyi NIWA1108 under different conditions
与对照组相比,Emiliania hux-leyi NIWA1108 的颗石球体积在高二氧化碳分压和氮限制条件下均有所降低,在氮限制条件下细胞相对更小且颗石粒脱落更多;在酸化+氮限制处理组,其颗石球体积最小、颗石粒直径也较小且存在大量颗石粒脱落.
2.5 海洋酸化和氮限制的交互作用
酸化和氮限制对颗石藻 Emiliania huxleyi NIWA1108 的各项生理及生物地球化学指标的交互作用见表 3.数据分析表明,酸化和氮限制对Emiliania huxleyi NIWA1108 细胞Chl-a 含量、PIC 含量、PIC/POC、细胞PON 含量及POP 含量产生协同性交互效应,而酸化和氮限制对细胞POC 含量和沉降速率产生对抗性交互效应.

表3 酸化和氮限制对颗石藻Emiliania huxleyi NIWA1108的各项生理及生物地球化学指标的交互作用Tab.3 Interactive effects of ocean acidification and nitrogen limitation on different physiological and biogeochemical parameters of Emiliania huxleyi NIWA1108
3 讨 论
本研究采用了恒化连续培养(chemostat continuous incubation)的方式[33],研究该藻在指数生长阶段的稳态条件下氮限制、酸化以及二者的交互作用对其生理指标的影响,更好地模拟自然低硝酸盐水体中颗石藻 Emiliania huxleyi NIWA1108 的自然生长状态.这与报道的一次性培养实验(batch culture)有所不同[34],一次性培养实验达到的氮限制条件往往是在营养盐消耗殆尽后的静止平台生长期,藻细胞濒于衰亡,更与藻类发生大规模水华后处于衰退期的状态相近.
氮限制可明显抑制Emiliania huxleyi NIWA1108的生长、光合作用、钙化作用,并降低其沉降速率,表明硝酸盐浓度是控制该藻生理生化过程的重要环境因子.同样,Feng 等[23]也发现硝酸盐浓度在Emiliania huxleyi NIWA1108 生长、光合及钙化作用中起到的重要作用,且在5 种环境因子中最为重要.氮是合成核酸和蛋白质的必需元素,氮限制可能会减少一些作为光合作用和钙化作用的重要转运体的蛋白质的生产[35].在本研究中,氮限制使Emiliania huxleyi NIWA1108 的细胞大小减小,因而细胞POC和PIC 含量均有所降低,然而氮限制下细胞PIC 降低的幅度更大,从而导致了细胞PIC/POC 比值在氮限制下明显下降.这与Müller 等[36]和Perrin 等[37]研究结果有所不同,其研究对象为处于静止生长期的Emiliania huxleyi NIWA1108 的细胞而无论在低光照或者高光照条件下,氮限制增加了细胞PIC/POC 比值,主要原因是处于静止期的藻细胞在细胞生长的G1 期,钙化作用继续而细胞分裂暂停,导致细胞PIC含量相对升高,本研究对象为指数生长期藻细胞,在极低硝酸盐浓度下,其钙化作用较细胞分裂更大程度受到抑制.氮限制导致的细胞体积减小和PIC 含量降低也大大降低了其相对于海水的比密度,从而导致沉降速率降低,这将会进一步降低该藻向深海的碳沉降通量.同样的,本研究中,随着细胞变小,细胞Chla 含量也减少,细胞PON 含量降低[23,38].同时由于功能性蛋白合成受到氮限制影响,降低对营养盐的吸收与有机磷合成,导致细胞POP 含量也降低.
本研究进一步表明了酸化和氮限制对颗石藻的生理和生物地球化学指标的潜在交互影响.酸化会导致颗石藻细胞花费更多的能量维持细胞内pH 平衡[39],因此随着 CO2分压升高,Emiliania huxleyi NIWA1108 的钙化作用通常会随之减弱[7,35].本研究中,当p(CO2)由400µatm 升高至800µatm 时,细胞PIC 含量和PIC/POC 比值均有所降低;而这种趋势在氮限制下尤为明显,换句话说,酸化和氮限制的交互作用对Emiliania huxleyi NIWA1108 的钙化作用产生了负向协同效应.此外,酸化和氮限制也对Emiliania huxleyi NIWA1108 的细胞碳氮比和碳磷比产生了正向协同效应.考虑到在未来全球变化下的海洋环境中,除了海洋酸化的趋势外[40],寡营养海域尤其是氮限制海域也会逐渐扩张[41],因此,为了更加准确地预测全球变化下颗石藻的生理学响应及该响应带来的对海洋生物地球化学尤其是碳循环的影响,酸化和氮限制的这种协同影响不容忽视.
4 结 论
通过对颗石藻Emiliania huxleyi NIWA1108 进行恒化连续培养,揭示了在稳态生长条件下,氮限制对该藻的生理学指标影响较大,减小了颗石球的体积,降低了细胞各元素含量;而酸化则进一步降低了细胞元素含量,尤其是细胞无机碳含量以及PIC/POC 比值,其沉降速率也随之降低.酸化和氮限制对颗石藻生理及生物地球化学指标尤其是钙化作用存在着潜在协同效应,这为进一步预测全球变化下颗石藻这一重要功能群的响应以及气候变化相关海洋生物地球化学模型的建立提供了理论支撑.

