增加雷斯青霉15α-羟化酶基因拷贝数提高甾体转化效率
李雪龙,李 改,谢东奇,金 鹏,毛淑红,王正祥,刘晓光
(1.天津科技大学生物工程学院,天津 300457;2.天津科技大学化工与材料学院,天津 300457)
甾体药物在临床上主要用于治疗类风湿性关节炎、哮喘、抗病毒、抗肿瘤和生育控制,此外还用于麻醉和心血管、淋巴白血病等疾病的治疗,是仅次于抗生素的第二大类药物[1-3].
孕激素中孕二烯酮避孕效果好、副作用小,是第三代高效口服避孕药的主要成分[4-5].15α-羟基左旋乙基甾烯双酮是合成口服避孕药孕二烯酮的关键中间体,过去主要通过有机合成来完成;但化学合成具有反应步骤多且专一性不强、得率低、使用大量有机溶剂等缺点[6].目前工业上已采用微生物转化的生产工艺,主要利用丝状真菌雷斯青霉(Penicillium raistrickii)细胞催化直接在左旋乙基甾烯双酮的C15α位引入羟基,合成15α-羟基左旋乙基甾烯双酮[7].
课题组前期根据该菌种转录组测序的结果,从预测的61 个细胞色素P450 基因中筛选出15 个候选C15α-羟化酶CYP 基因,并利用实时荧光定量PCR定量扩增考察了甾体底物诱导与非诱导条件下候选基因的表达差异情况,最终确定了12820 和6138 两个基因受甾体底物的高度诱导.甾体转化实验表明,6138 基因(简称8 号)对左旋乙基甾烯双酮没有转化活性,而12820 基因能够转化左旋乙基甾烯双酮,生成15α-羟基左旋乙基甾烯双酮,表明12820 基因为15α-羟化酶基因.从雷斯青霉ATCC10490 中克隆鉴定了参与左旋乙基甾烯双酮C15α-羟化反应的基因12820 (PRH),该基因编码一种细胞色素P450 羟化酶[8],其羟化反应所需的电子由雷斯青霉NADPH-细胞色素P450 还原酶提供[9].
转化效率偏低是目前工业上利用雷斯青霉转化左旋乙基甾烯双酮急需解决的问题(底物投料2 g/L,转化60 h,摩尔转化率75%).为了增加左旋乙基甾烯双酮C15α-羟化效率,本文通过增加C15α-羟化酶基因PRH 的拷贝数以提高其表达水平.考虑大多数真菌的细胞色素P450 酶位于微球体的膜上,而8号预测编码一个受甾体底物高度诱导的P450 酶,将PRH 基因定点整合至雷斯青霉ATCC10490 基因组的8 号基因位点,导致8 号基因失活.这样一方面增加了15α-羟化酶基因的拷贝数,另一方面微球体膜可能有多余的空间容纳过表达的目标C15α-羟化酶.鉴于雷斯青霉C15α-羟化酶基因的表达受底物左旋乙基甾烯双酮的高度诱导[9-10],分别构建过表达载体pPZP-p800-PRH 和pPZP-TrpC-PRH,使PRH 基因的表达受本身的诱导型启动子或外源组成型启动子的控制,通过同源重组的方法定点整合到雷斯青霉的基因组,达到增加基因拷贝数的目的,以期获得转化效率提高的基因工程菌株.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
雷斯青霉(Penicillium raistrickii)ATCC10490、根癌农杆菌(Agrobacterium tumefaciens)AGL-1,天津科技大学微生物菌种保藏中心.大肠杆菌(Escherichia coli)JM109 以及质粒pCSN44、pPZP-HYG2 均为本实验保存.
1.1.2 酶与试剂
限制性内切酶(EcoRⅠ、NotⅠ、SacⅠ、HindⅢ、KpnⅠ)、SolutionⅠ连接试剂盒及Pyrobest DNA 聚合酶,Takara 公司;甲醇、乙腈、乙酸乙酯及石油醚,天津市化学试剂六厂;其他常规试剂为进口分装或国产分析纯.引物的合成及序列的测定由北京华大公司完成.
1.1.3 主要溶液及缓冲液
K buffer:用 1.25 mol/L K2HPO4溶液调节1.25 mol/L KH2PO4溶液的 pH=4.8,121 ℃灭菌20 min 备用.
MN buffer:3.0 g MgSO4·7H2O、1.5 g NaCl 溶于去离子水,定容至100 mL,121 ℃灭菌20 min 备用.
IM Trace elements:0.1 g ZnSO4·7H2O、0.1 g CuSO4·5H2O、0.1 g H3BO3、0.1 g MnSO4、0.1 g Na2MoO4·2H2O 溶于去离子水,定容至 100 mL,121 ℃灭菌20 min 备用.
APS+N:2.61 g KCl、7.48 g KH2PO4、29.75 g NaNO3用去离子水溶解,定容至100 mL,用5 mol/L的KOH 溶液调节pH=5.5,121 ℃灭菌20 min 备用.
CM Trace elements:2.1 g ZnSO4·7H2O、1.1 g H3BO3、0.5 g MnCl2·4H2O、0.5 g FeSO4·7H2O、0.17 g CuSO4·5H2O、0.15 g Na2MoO4·2H2O、5.1 g EDTA 用去离子水溶解,定容至100 mL,121 ℃灭菌20 min备用.
1.1.4 培养基
PDA 培养基(g/L):土豆200,葡萄糖20,115 ℃灭菌15 min.
LB 培养基(g/L):蛋白胨10,NaCl 10,酵母粉5,121 ℃灭菌20 min.
YPD 培养基(g/L):蛋白胨20,酵母粉10,葡萄糖20,115 ℃灭菌20 min.
诱导培养基(IM):900 mL 去离子水,121 ℃灭菌20 min.加入预先灭菌的K buffer 0.8 mL、MN buffer 20 mL、1%CaCl2溶 液 1 mL、0.01%FeSO4溶液10 mL、IM Trace elements 5 mL、20%NH4NO3溶液2.5 mL、1 mol/L MES 40 mL、50%甘油10 mL、20%葡萄糖10 mL,摇匀备用.固体培养基将去离子水中加入15 g 琼脂粉,121 ℃灭菌20 min 备用.
真菌生长完全培养基(CM):在900 mL 去离子水中加入琼脂粉15 g,121 ℃灭菌20 min.使用前用微波炉加热至琼脂完全溶解,然后加入预先灭菌的APS+N 20 mL、1 mol/L MgSO4溶液2 mL、CM Trace elements 1 mL、10%酪蛋白水解物10 mL、10%酵母浸出物50 mL、50%葡萄糖20 mL.
1.1.5 甾体化合物
左旋乙基甾烯双酮(底物,英文缩写 GD)和15α-羟基左旋乙基甾烯双酮(产物,英文缩写15α-OH-GD)均由北京紫竹药业有限公司提供.
1.2 方法
1.2.1 雷斯青霉ATCC10490 重组菌的构建
为了将C15α-羟化酶基因PRH 定点整合至雷斯青霉ATCC10490 基因组的8 号位点[8],以雷斯青霉的8 号基因为同源臂,设计引物(8-L-F/R 和8-RF/R),以雷斯青霉基因组为模板,PCR 得到同源臂.用HindⅢ和XbaⅠ双酶切质粒pCSN44,胶回收后得到潮霉素抗性基因(HYG,2.2 kbp).用SacⅠ和KpnⅠ双酶切质粒pBluescript Ⅱ KS+,回收后得到3.0 kbp 的线性载体骨架片段.用引物(PRH-TT-F/R、p800-PRH-TT-F/R),以雷斯青霉基因组为模板,PCR扩增得到 PRH-TT 和p800-PRH-TT,用XbaⅠ和HindⅢ双酶切HYG,获得TrpC 启动子.将上述酶切体系进行切胶回收,获得目的片段与载体.
引物序列为 8-L-F:GGTACCTTCACTTTGCT TGGATTGAGCG,8-L-R:AAGCTTACTTGAGAT TACTGAGGATGATGG;8-R-F:GAATTCGCCGAAT AAGCAAGTCGAATG,8-R-R:GAGCTCGATAGTC TCGAACTTACTTGCGTC;PRH-TT-F:AAGCTTAT GGCTGTCCTCACCGAATTG,PRH-TT-R:GAATTC TTGTGCGGTCTGGAGTTCATG;p800-PRH-TT-F:TCTAGAGAGACTCAAGGCGTAGCTCCAG,p800-P RH-TT-R:GAATTCTTGTGCGGTCTGGAGTTCATG.
将回收的目的片段与载体连接分别得到重组质粒 pBlue-L-HYG、pBlue-p800-PRH-TT-R 和 pBlue-TrpC-PRH-TT-R.使用SacⅠ和XbaⅠ双酶切重组质粒pBlue-L-HYG,胶回收片段pBlue-L-HYG;使用SacⅠ和 XbaⅠ分别双酶切重组质粒 pBlue-p800-PRH-TT-R 和 pBlue-TrpC-PRH-TT-R,胶回收片段p800-PRH-TT-R 和 TrpC-PRH-TT-R.将 pBlue-LHYG 分别与p800-PRH-TT-R 和TrpC-PRH-TT-R 两个片段进行连接,将连接产物分别转化 E.coli JM109,得到相应的重组质粒:pBlue-L-HYG-p800-PRH-TT-R 和pBlue-L-HYG-TrpC-PRH-TT-R.
采取DNA 体外重组的方法分别构建雷斯青霉甾体15α-羟化酶的2 个表达载体:pPZP-L-HYGp800-PRH-TT-R 和pPZP-L-HYG-TrpC-PRH-TT-R.
1.2.2 雷斯青霉ATCC10490 孢子悬液的制备
用接种环将雷斯青霉ATCC10490 的孢子划线接种于PDA 试管斜面上,28 ℃培养3~5 d.待孢子成熟后,用预先灭菌的1 mol/L 山梨醇溶液洗涤,用灭菌的玻璃珠将其打散(震荡约15~30 min),用血球计数板计数,再稀释至相应浓度,分装,4 ℃保存备用.
1.2.3 根癌农杆菌AGL-1 的转化和培养
将重组菌(pPZP-L-HYG-p800-PRH-TT-R 和pPZP-L-HYG-TrpC-PRH-TT-R)通过电击转化的方法转入根癌农杆菌AGL-1 感受态中,挑取长势良好的转化子,进行菌落PCR 验证.PCR 引物为HYGF/HYG-R,HYG-F:GTACCTGTGCATTCTGGGTAA ACG,HYG-R:TGTTTATCGGCACTTTGCATCGGC.
将验证成功的阳性单克隆转化子在LB(含卡那霉素50 μg/mL)平板上划线,28 ℃培养72 h 后放于4 ℃备用.
将根癌农杆菌接种于5 mL LB 液体培养基中,28 ℃、200 r/min 摇床培养24 h 后,转接于装有50 mL LB 液体培养基的250 mL 的摇瓶中,28 ℃、200 r/min摇床培养至A600=0.8;5 000 r/min 离心10 min,弃上清液.使用IM 培养基重悬菌体,28 ℃、200 r/min 摇床诱导培养5 h.将诱导好的根癌农杆菌与雷斯青霉孢子悬液按体积比1:1 均匀混合,涂布于IM 平板上,25 ℃共培养48 h.用1 mL 生理盐水将菌丝洗下,并用涂布器打碎涂布于CM 平板上.
1.2.4 雷斯青霉过表达转化子的筛选与验证
待CM 平板上生长出单菌落,在其产孢前,随机挑选雷斯青霉阳性转化子于含300 μg/mL HYG 抗性的PDA 平板进行复筛,于28 ℃培养箱培养3~5 d.挑取长势良好的菌落于含有300 μg/mL HYG 抗性的PDA 试管斜面中,28 ℃培养箱培养3~4 d.待试管中转化子产生孢子后,用生理盐水将孢子洗下并保菌.余下的孢子悬液接种于PDA 液体培养基培养菌丝,提取雷斯青霉转化子的基因组,并以雷斯青霉出发菌株基因组作为对照,以L-F、HYG-R 为引物进行PCR 验证.L-F:CAGAAACTTCTCGACAGACG T,HYG-R:GATCTTCCAAACCACATAGGTG.
1.2.5 重组雷斯青霉PRH 基因的拷贝数检测
本课题组前期从雷斯青霉ATCC10490 中克隆鉴定了参与左旋乙基甾烯双酮C15α-羟化反应的基因12820(PRH),根据PRH 基因的cDNA 的序列设计目的基因的引物PRH-F 和PRH-R,根据转录组测序结果中提供的内参cDNA 基因序列设计一对特异性引物tublin-F 和tublin-R,该基因是雷斯青霉整个生长过程中表达稳定的内参基因.PRH-F:GAATTCATG GCTGTCCTCACCGAAT,PRH-R:CTCGAGCTACT CTCCCAAGAAACTCA;Tublin-F:AACCATCTCCG GTGAGCACG,Tublin-R:GCATGCAGATATCGTAC AGAGC.
将过表达PRH 基因与内参基因进行实时荧光定量 PCR(Real-time PCR).反应体系(20 μL):2×SYBR Green Mix 10 μL,ROX 0.4 μL,上、下游引物(10 μmol/L)各0.5 μL,模板(基因组)1 μL,dd H2O 7.6 μL.反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃1 min,40 个循环.实验过程中Ct 值表明扩增产物的荧光信号达到设定阈值时所经过的扩增循环数,利用每个模板的Ct 值与该模板起始拷贝数的对数存在的线性关系,以检测不同菌株之间表达差异.表达差异倍数按照文献[11]方法计算.
1.2.6 雷斯青霉重组菌的甾体转化实验
鉴于雷斯青霉C15α-羟化酶基因的表达受底物左旋乙基甾烯双酮的高度诱导,其PRH 基因前面是诱导型启动子.为提高雷斯青霉对甾体底物的转化效率,后续实验中在PRH 基因前面添加一个组成型启动子TrpC.为了初步探索重组菌的甾体15α-羟基化活性,将雷斯青霉出发菌株、诱导型PRH-p800 重组菌株和组成型PRH-TrpC 重组菌株各1 mL(计数为107)到30 mL YPD 培养基中,24 h 后加入2 g/L 的左旋乙基甾烯双酮,分别诱导转化12、24、36、48、60、72、84 h,28 ℃、180 r/min 培养,适时取样测定转化率.
1.2.7 硅胶薄层层析(TLC)分析
取1 mL 菌体发酵液,加入500 μL 的乙酸乙酯混匀,12 000 r/min 离心3 min,取上清液(乙酸乙酯层)200 μL,用直径为0.2 mm 的毛细管点样于硅胶层析板上.在距层析板边缘 1 cm 处点样,样点间距0.5 cm.在展开之前用展开剂将层析缸饱和30 min.将点有样品的硅胶板放入层析缸中展开,加盖,密封,待展开剂前沿快到顶端时,取出点样板,烘干.采用紫外检测仪观察转化产物.
1.2.8 转化产物的高效液相色谱(HPLC)分析
取样萃取后静置,取100 μL 上层有机相于干净的1.5 mL EP 管中,待乙酸乙酯挥发完,加入100 μL乙腈溶解后用0.22 μm 膜过滤.色谱条件:色谱柱为C18 柱(4.6 mm×250 mm,5 μm),流动相为乙腈-水溶液(体积比为4:1),流量0.8 mL/min,柱温25 ℃,进样量10 μL,检测波长240 nm.
1.2.9 雷斯青霉重组菌转化效率测定
通过色谱图中生物转化产物曲线下的峰面积确定获得的HGD 的质量.GD 到15α-OH-GD(HGD)的摩尔转化率按照式(1)计算[12].
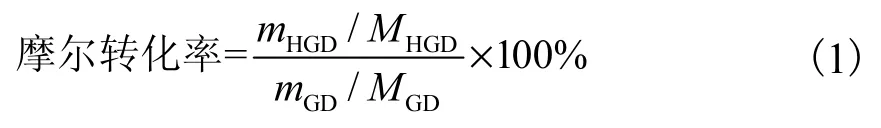
式中:mHGD和mGD分别为HGD 和GD 的质量,MHGD和MGD分别为HGD 和GD 的相对分子质量.
2 结果与分析
2.1 雷斯青霉ATCC10490 诱导型启动子与组成型启动子过表达载体的构建
为了改进现有生产菌种雷斯青霉ATCC10490 转化GD 合成15α-OH-GD 的效率,探讨增加目标基因PRH 拷贝数对 GD 转化活性的影响.首先构建GD15α-羟化酶基因PRH 的表达载体,表达载体构建示意图如图1 所示.

图1 过表达载体构建示意图Fig.1 Schema of overexpression vector construction
构建的过表达载体,将重组质粒分别进行酶切分析.载体pPZP 为6.7 kbp,其中HYG 抗性基因及其启动子为 2.2 kbp,p800-PRH-TT 片段为 3.3 kbp,TrpC-PRH-TT 片段为2.8 kbp.经XhoⅠ/XbaⅠ双酶切后,琼脂糖凝胶电泳结果(图2(a))显示约10 kbp的载体片段和3.3 kbp 的目的基因片段,证实过表达载体构建成功,命名为pPZP-L-HYG-p800-PRH-TTR.而经HindⅢ单酶切后3 个片段应为7.9、2.7、2.5 kbp.酶切电泳结果(图2(b))显示所得片段大小与理论值一致,证实PRH 基因组成型过表达载体构建成功,表达载体命名为pPZP-L-HYG-TrpC-PRHTT-R.

图2 过表达载体的酶切验证Fig.2 Enzymatic digestion verification of overexpression vector
2.2 雷斯青霉过表达载体转化根癌农杆菌
将过表达载体pPZP-L-HYG-p800-PRH-TT-R 和pPZP-L-HYG-TrpC-PRH-TT-R 电转至已经制备好的根癌农杆菌感受态中.因为载体在根癌农杆菌AGL-1 中的拷贝数较低,因此无法通过质粒提取的方法验证载体是否成功转化至根癌农杆菌,需通过菌落PCR 的方法验证载体是否成功转化至根癌农杆菌AGL-1.PCR 结果如图3 所示,菌落PCR 得到约2.1 kbp 的条带,与HYG 基因设计引物PCR 预测结果大小一致,证实过表达载体pPZP-L-HYG-p800-PRH-TT-R 和pPZP-L-HYG-TrpC-PRH-TT-R 已经成功转入根癌农杆菌AGL-1 中.
2.3 雷斯青霉重组菌株的鉴定
利用根癌农杆菌介导雷斯青霉ATCC10490 转化,将15α-羟化酶基因PRH 表达盒转入雷斯青霉中,通过同源重组定点整合的方式增加雷斯青霉PRH 基因的拷贝数.同源重组的原理及基因重组菌株验证策略见图4.将过表达重组菌株的基因组作为模板,以L-F、HYG-R 为引物进行PCR 验证.扩增结果如图5 所示,PCR 产物大小约为1.2 kbp 条带,与理论结果大小一致,表明成功得到了过表达PRH 基因重组菌株.
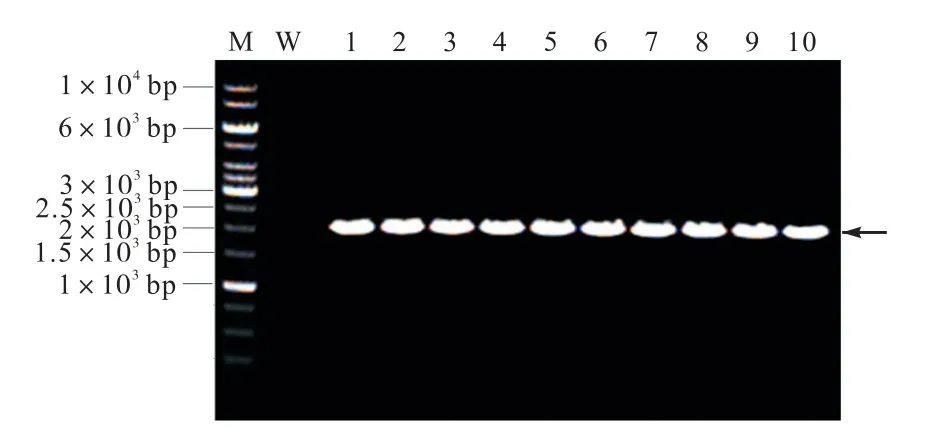
图3 根癌农杆菌AGL-1 pPZP-L-HYG-p800-PRH-TTR 和pPZP-L-HYG-TrpC-PRH-TT-R 转化子菌落PCR验证Fig.3 PCR verification of the A.tumefaciens AGL-1 transformants of pPZP-L-HYG-p800-PRH-TT-R and pPZP-L-HYG-TrpC-PRH-TT-R

图4 PRH-P800和PRH-TrpC基因表达盒定点整合Fig.4 Targeted integration of PRH-P800 and PRH-TrpC expression cassette
2.4 PRH 过表达重组菌株拷贝数的确定
利用实时定量PCR 检测野生型菌株、诱导型菌株PRH-P800 和组成型菌株PRH-TrpC 的PRH 基因拷贝数.基因组DNA 定量PCR 扩增结果(图6)显示:如果将野生型菌株PRH 基因的相对拷贝数定量为1.001 5,则菌株PRH-P800 的PRH 基因相对拷贝数为 2.043 3,菌株 PRH-TrpC 的相对拷贝数为1.846 2.这说明重组菌的PRH 基因相对拷贝数是野生菌的2 倍,达到预期结果.

图5 重组菌PCR验证Fig.5 PCR validation of recombined strains
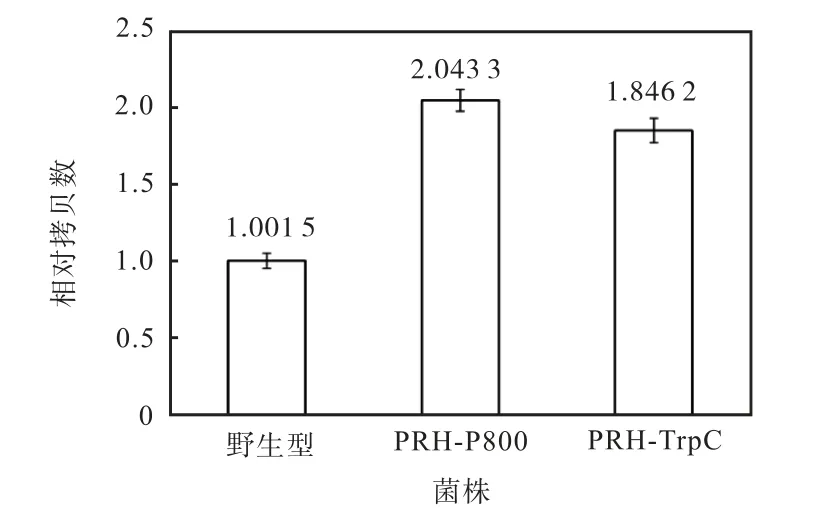
图6 雷斯青霉重组菌株PRH 基因拷贝数的定量PCR测定Fig.6 Determination of PRH copy number in P.raistrickii recombined strains with qPCR
2.5 增加甾体羟化酶基因一个拷贝对转化效率的影响
为了考察雷斯青霉重组菌株的左旋乙基甾烯双酮15α-羟基化活性,比较了野生型菌株、诱导型启动子重组菌株PRH-P800 和组成型启动子重组菌株PRH-TrpC 在底物投样量为2 g/L 时左旋乙基甾烯双酮转化情况.15α-羟化酶的特异性强,在转化产物中几乎没有副产物产生,但是在工业上转化效率偏低,增加甾体羟化酶基因一个拷贝后,与野生型菌株相比较,过表达PRH 基因重组菌株对左旋乙基甾烯双酮的转化效率明显提高.实验结果如图7 所示,重组菌PRH-TrpC 在48 h 左右摩尔转化率最高达到90%,重组菌PRH-P800在48 h 左右摩尔转化率达到85%,而野生型菌株在60 h 左右才达到75%.以上结果表明PRH 基因重组菌株PRH-P800 同出发菌株相比摩尔转化率高出13%,PRH-TrpC 同出发菌株相比摩尔转化率高出20%,而且转化时间均缩短了12 h.

图7 不同雷斯青霉过表达PRH 基因重组菌株的GD转化曲线Fig.7 Transformation curves of GD by PRH-overexpressing recombined P.raistrickii strains
3 结 语
本文考察了增加雷斯青霉ATCC10490 C15α-羟化基因PRH 的拷贝数对转化左旋乙基甾烯双酮效率的影响.分别构建了PRH 基因的诱导型和组成型过表达载体pPZP-P800-PRH 和pPZP-TrpC-PRH,并通过同源重组的方法定点整合到雷斯青霉基因组.转化实验表明,在出发菌株中增加一个PRH 基因拷贝显著提高了甾体左旋乙基甾烯双酮转化效率,重组菌PRH-P800 和PRH-TrpC 的摩尔转化率分别提高了13%和20%,同时转化时间均缩短了12 h.

