高剂量D-半乳糖复制C57BL/6J 衰老小鼠模型的研究
赵焕东,胥洪鹃,李坚,任彩萍,陈玉祥
(1.中南大学湘雅医院 手术室,湖南 长沙 410008;2.中南大学基础医学院 肿瘤研究所,湖南 长沙 410078;3.中南大学湘雅医院 普外科,湖南 长沙 410008; 4.中南大学湘雅药学院,湖南 长沙 410013)
随着医疗水平不断提高,人口老龄化已成为当今亟需解决的问题。近年来,衰老机制与抗衰老的研究备受关注[1]。众所周知,衰老是一个与氧化应激密切相关而又复杂的过程,不仅会导致机体形态学改变,而且会影响心、脑、肺等器官的功能[2-3]。为提高人们生活质量并有效延缓衰老,抗氧化和衰老药物或食品的研究成为热点。动物衰老模型的复制是衰老相关研究中必然涉及到的内容,选择合适的衰老模型极为重要。
1 材料与方法
1.1 材料与试剂
D-半乳糖(美国Sigma公司),水合氯醛(北京索莱宝科技有限公司),聚氰基丙烯酸正丁酯(Butyleyanoacrylate, BCA)试剂盒(北京康为世纪生物科技有限公司),十二烷基苯磺酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)试剂盒(杭州联科生物技术股份有限公司),超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒及丙二醛(Malondialdehyde, MDA)试剂盒购自南京建成生物工程研究所,组织裂解液、苯甲基磺酰氟购自上海碧云天生物技术有限公司,抗血红素加氧酶-1(heme oxygenase-1, HO-1)抗体(美国Abcam公司),抗β-actin抗体(美国CST公司),辣根过氧化物酶标记二抗(杭州联科生物技术股份有限公司),增强型化学发光液(Electrochemiluminescence, ECL)(苏州新赛美生物技术公司)。
1.2 主要仪器
电泳仪(美国Bio-Rad公司),全波长酶标仪(美国BioTek公司),化学发光、可见光成像系统购自美国ProteinSimple公司。
1.3 方法
1.3.1 实验动物与分组9周龄C57BL/6J小鼠30只,体重(20±2)g,由湖南斯莱克景达实验动物公司提供,许可证号:SYXK(湘)2015-0017。小鼠饲养环境由中南大学实验动物学部提供,SPF级,温度25℃,相对湿度60%,12 h昼/夜循环照明,自由进食、饮水。小鼠适应性饲养1周后,随机分为3组:500 mg/(kg·d)D-半乳糖组、1 000 mg/(kg·d)D-半乳糖组及对照组。每组10只,每组分2笼饲养,每笼5只。500和1 000 mg/(kg·d)D-半乳糖组小鼠分别经颈背部皮下注射500和1 000 mg/(kg·d)D-半乳糖,对照组小鼠按体重经颈背部注射0.9%生理盐水1次/d,持续8周。本研究所用动物实验方法通过中南大学实验动物学系的审批。
1.3.2 SOD、GSH-Px、MDA的检测给药结束后,小鼠禁食24 h,经水合氯醛麻醉,摘眼球取血,室温静置1 h,4℃、12 000 r/min离心分离血清,保存于-20℃。同时取肝、脑组织保存于-80℃备用。严格按试剂盒说明书进行操作,测定血清SOD、GSH-Px及MDA。制备肝脏和脑组织匀浆液,4℃、12 000 r/min离心,测定SOD、GSH-PX活性和MDA含量。
1.3.3 苏木精-伊红(HE)染色解剖小鼠时取部分肝脏和脑组织于10%甲醛浸泡,脱水后石蜡包埋,切片,行HE染色,样品扫描后用Case Viewer软件 分析。
1.3.4 Western blotting制备肝脏和脑组织匀浆液,4℃、12 000 r/min离心,取上清。采用BCA法测定蛋白浓度,行SDS-PAGE凝胶电泳,将电泳后的蛋白转至PVDF膜上,用5%牛血清蛋白TBST溶液室温封闭1 h,相继孵育一抗(抗HO-1和抗β-actin)和二抗。采用ECL发光显色,AlphaView软件进行条带分析。
1.4 统计学方法
数据处理分析采用SPSS 18.0 统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 高剂量D-半乳糖诱导C57BL/6J小鼠发生形态学改变
3组小鼠初始体重比较,经方差分析,差异无统计学意义(P>0.05);3组小鼠末次体重比较,经方差分析,差异有统计学意义(P<0.05);且3组体重增值均>7 g(见表1)。小鼠在形态表现上也有较大差异,从第6周开始,1 000 mg/(kg·d)D-半乳糖组小鼠头颈部陆续发生不同程度的脱毛现象,且随着干预时间延长,D-半乳糖组小鼠毛色逐渐泛黄,出现精神萎靡、皮肤弹性变差等(见图1)。
表1 3组小鼠药物干预第1天和最后1天的体重比较(n =10,g,±s)
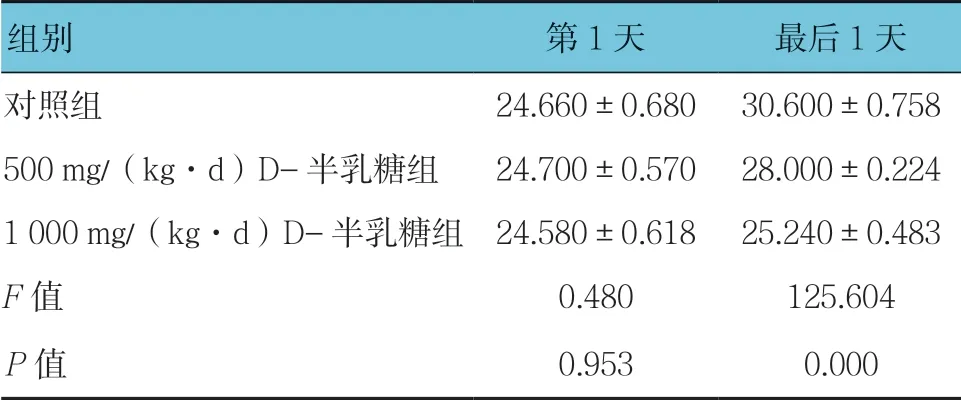
表1 3组小鼠药物干预第1天和最后1天的体重比较(n =10,g,±s)
组别第1天最后1天对照组24.660±0.68030.600±0.758 500 mg/(kg·d)D-半乳糖组24.700±0.57028.000±0.224 1 000 mg/(kg·d)D-半乳糖组24.580±0.61825.240±0.483 F值0.480125.604 P值0.9530.000
2.2 3组小鼠血清、肝脏和脑组织生化指标比较
2.2.1 SOD活性3组小鼠血清、肝脏和脑组织SOD活性比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较经LSD-t检验,500 mg/(kg·d)D-半乳糖组小鼠脑组织SOD活性低于对照组(P<0.05);1 000 mg/(kg·d)D-半乳糖组小鼠血清、肝脏和脑组织SOD活性低于对照组(P<0.05)。

图1 3组小鼠外观形态变化
2.2.2 GSH-Px活性3组小鼠血清、肝脏和脑组织GSH-Px活性比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较经LSD-t检验, 500 mg/(kg·d)D-半乳糖组小鼠血清、肝脏和脑组织GSH-Px活性低于对照组(P<0.05);1 000 mg/(kg·d)D-半乳糖组小鼠血清、肝脏和脑组织GSH-Px活性低于对照组(P<0.05);1 000 mg/(kg·d)D-半乳糖组小鼠肝脏GSH-Px活性低于500 mg/(kg·d)D-半乳糖组(P<0.05)。
2.2.3 MDA含量3组小鼠血清、肝脏和脑组织MDA含量比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较经LSD-t检验,500 mg/(kg·d) D-半乳糖组小鼠血清、肝脏和脑组织MDA含量高于对照组(P<0.05);1 000 mg/(kg·d)D-半乳糖组小鼠血清、肝脏和脑组织MDA含量高于对照组(P<0.05);1 000 mg/(kg·d)D-半乳糖组小鼠血清和肝脏MDA含量高于500 mg/(kg·d)D-半乳糖组(P<0.05)。见表2~4和图2。
2.3 肝脏和脑组织HE染色结果
对照组肝组织切片显示细胞核大且圆,肝索排列整齐,细胞无变性或者坏死,D-半乳糖处理后肝细胞出现点状坏死、水肿和空泡样变性,并且出现淋巴细胞浸润,肝索排列排混乱(见图3A~C)。从脑组织海马区齿状回切片可以观察到,与对照组比较,D-半乳糖处理过的小鼠脑颗粒细胞排列混乱,细胞形状变小,细胞核形状改变,发生固缩,且核深染(见图3D~F)。
表2 3组小鼠血清SOD、GSH-Px活性和MDA含量比较(n =10,±s)
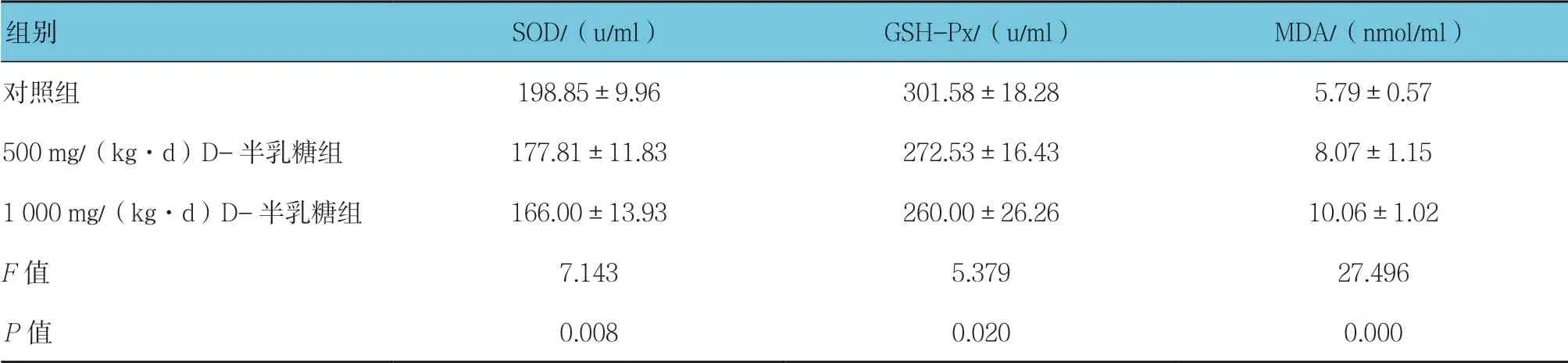
表2 3组小鼠血清SOD、GSH-Px活性和MDA含量比较(n =10,±s)
组别SOD/(u/ml)GSH-Px/(u/ml)MDA/(nmol/ml)对照组198.85±9.96301.58±18.285.79±0.57 500 mg/(kg·d)D-半乳糖组177.81±11.83272.53±16.438.07±1.15 1 000 mg/(kg·d)D-半乳糖组166.00±13.93260.00±26.2610.06±1.02 F值7.1435.37927.496 P值0.0080.0200.000
表3 3组小鼠肝脏SOD、GSH-Px活性和MDA含量比较(n =10,±s)
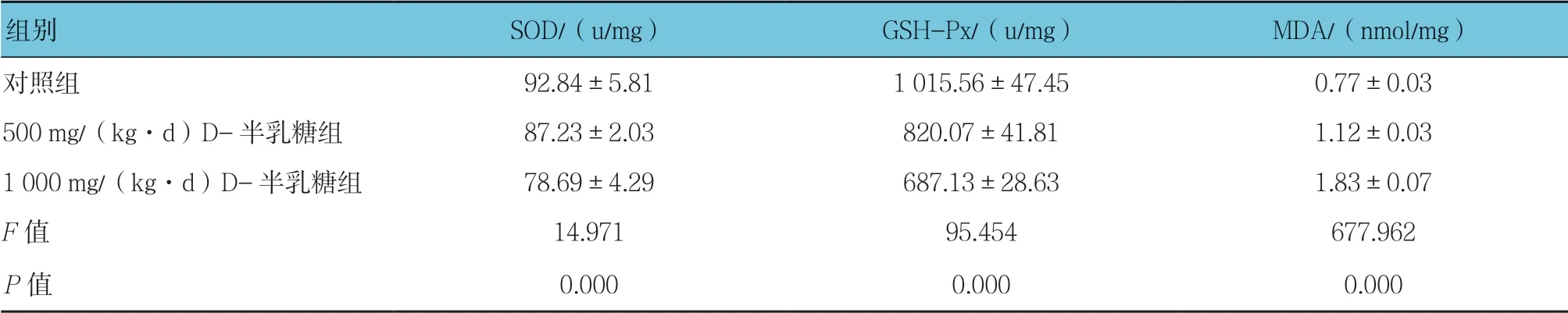
表3 3组小鼠肝脏SOD、GSH-Px活性和MDA含量比较(n =10,±s)
组别SOD/(u/mg)GSH-Px/(u/mg)MDA/(nmol/mg)对照组92.84±5.811 015.56±47.450.77±0.03 500 mg/(kg·d)D-半乳糖组87.23±2.03820.07±41.811.12±0.03 1 000 mg/(kg·d)D-半乳糖组78.69±4.29687.13±28.631.83±0.07 F值14.97195.454677.962 P值0.0000.0000.000
表4 3组小鼠脑组织SOD、GSH-Px活性和MDA含量比较(n =10,±s)
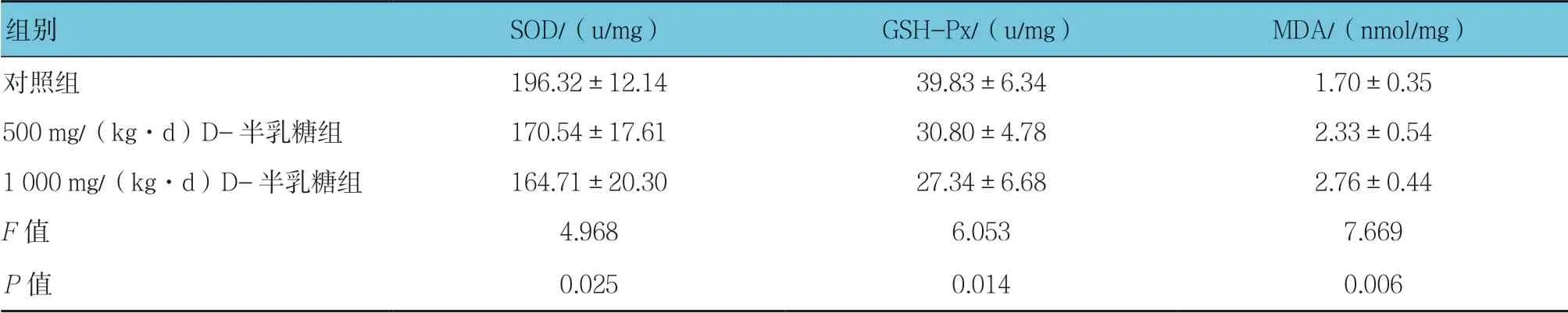
表4 3组小鼠脑组织SOD、GSH-Px活性和MDA含量比较(n =10,±s)
组别SOD/(u/mg)GSH-Px/(u/mg)MDA/(nmol/mg)对照组196.32±12.1439.83±6.341.70±0.35 500 mg/(kg·d)D-半乳糖组170.54±17.6130.80±4.782.33±0.54 1 000 mg/(kg·d)D-半乳糖组164.71±20.3027.34±6.682.76±0.44 F值4.9686.0537.669 P值0.0250.0140.006
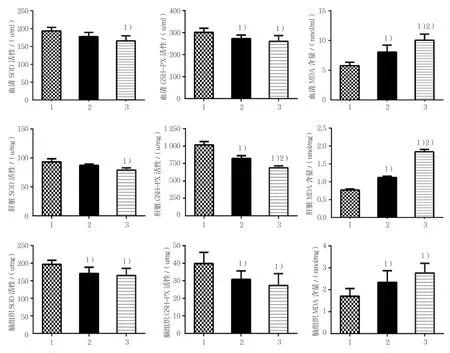
图2 3组小鼠血清、肝、脑组织生化指标比较(n =10,±s)
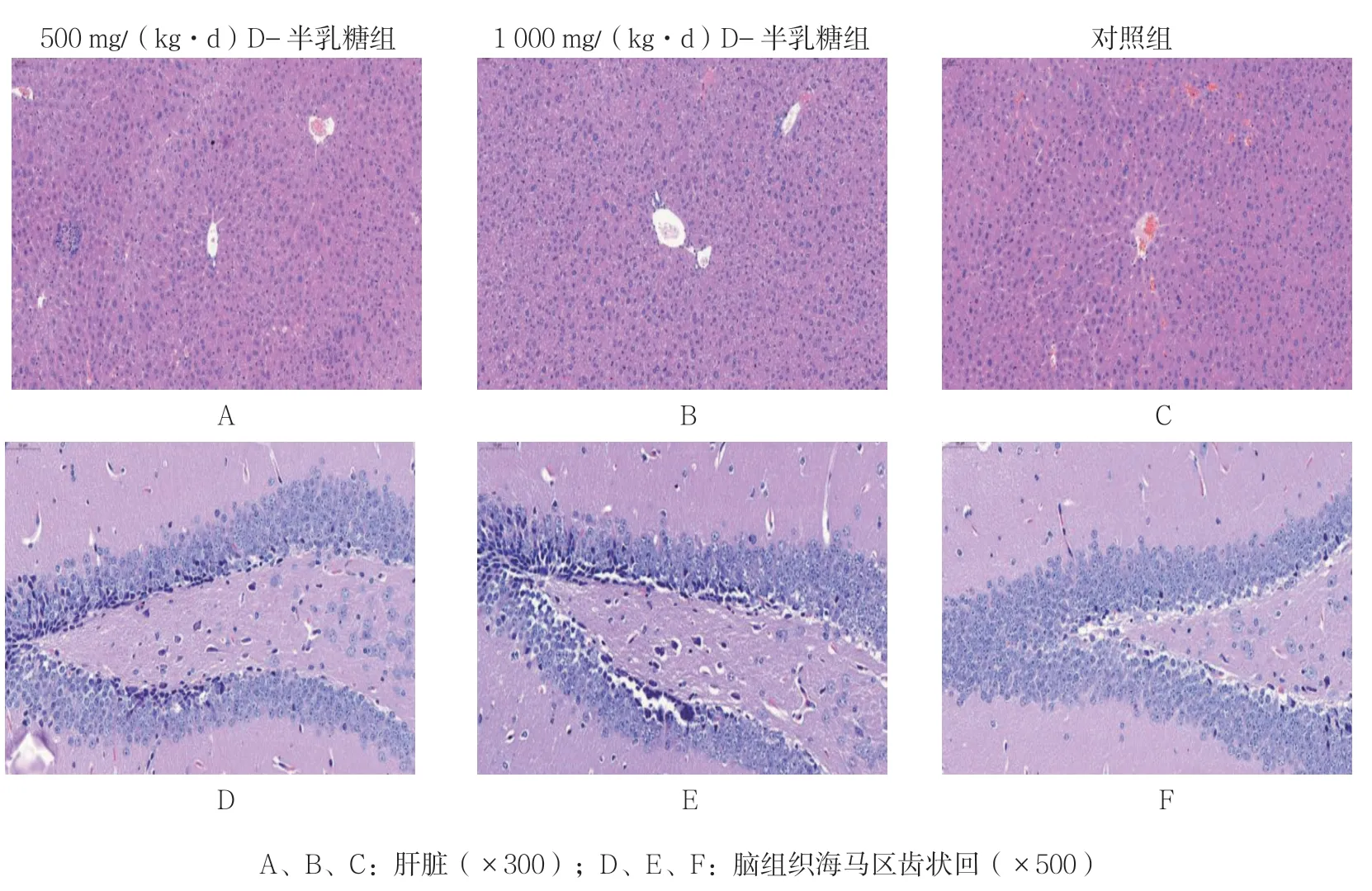
图3 小鼠肝脏和脑组织病理切片图(HE染色)
2.4 肝脏和脑组织HO-1蛋白的表达
3组大鼠肝脏HO-1蛋白表达水平比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较经LSD-t检验,500 mg/(kg·d)D-半乳糖组肝HO-1表达水平高于对照组(P<0.05);1 000 mg/(kg·d)D-半 乳糖组肝HO-1表达水平高于500 mg/(kg·d)D-半乳糖组(P<0.05)。3组大鼠脑组织HO-1蛋白表达水平比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较经LSD-t检验,500 mg/(kg·d)D-半 乳糖组脑HO-1表达水平高于对照组(P<0.05);1 000 mg/(kg·d)D-半乳糖组脑HO-1表达水平高于500 mg/(kg·d)D-半乳糖组(P<0.05)。见表5和图4。
表5 3组小鼠肝脏和脑组织HO-1蛋白表达水平比较(n =10,±s)
表5 3组小鼠肝脏和脑组织HO-1蛋白表达水平比较(n =10,±s)
组别肝脏脑组织对照组1.00±0.001.00±0.00 500 mg/(kg·d)D-半乳糖组1.22±0.031.41±0.09 1 000 mg/(kg·d)D-半乳糖组1.48±0.091.82±0.10 F值161.525104.939 P值0.0000.000
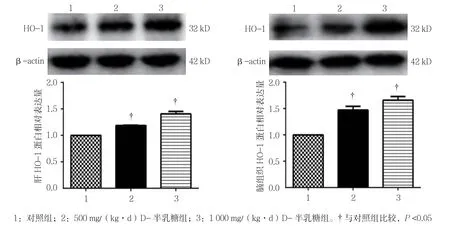
图4 小鼠肝脏和脑组织HO-1的表达
3 讨论
以往研究对于动物衰老模型的选择包括以下 5种:①自然衰老小鼠;②快速衰老小鼠SAMP8[4];③胸腺切除小鼠[5];④γ射线辐射衰老小鼠模型[6];⑤D-半乳糖诱导的衰老小鼠模型。其中D-半乳糖法复制衰老小鼠模型由我国学者龚国清等[7]在1991年 提出,因其操作简便、成本低廉和周期短等优点,受到众多科研工作者青睐。不同文献报道中使用的D-半乳糖剂量并不一致,最低为50 mg/(kg·d)[8],而最高可达1 250 mg/(kg·d)[9],但多数研究剂量为120~200 mg/(kg·d)[10-11],小鼠品种多为ICR和昆明种。目前未见关于D-半乳糖处理的小鼠是否会发生明显形态学改变的报道。C57BL/6J近交系小鼠相比ICR和昆明小鼠具有个体差异小、生长速率慢的特点,用于多种领域的研究[12-13]。关于D-半乳糖诱导衰老的机制仍不明确,目前有2种猜想:一种认为在半乳糖氧化酶的催化下,D-半乳糖反应产生醛糖和过氧化氢,导致ROS增加和超氧自由基大量累积,使机体受到损伤,发生衰老[14];另一种观点认为,在醛糖还原作用下,体内高浓度D-半乳糖被还原为半乳糖醇,不能发生进一步代谢而在细胞内累积,影响到渗透压,继而导致细胞发生肿胀和功能障碍[15]。本研究采用高浓度D-半乳糖 500 mg/(kg·d)和1 000 mg/(kg·d)诱导小鼠衰老模型,研究其对小鼠体内氧化应激相关指标的影响及对小鼠外观形态上的改变。
结本研究果发现,3组药物干预初始体重体重无显著性差异,而末次体重D-半乳糖组较对照组低,说明D-半乳糖对小鼠体重有一定影响。此外,本研究中,3组初次和末次体重增值均>7 g,而其他研究中ICR和昆明小鼠8周内体重增值均<10 g[16-17],说明C57BL/6J个体差异相对较小,生长速率慢,体重对后续检测指标影响小,有利于提高检测结果的可比性。1 000 mg/(kg·d)D-半乳糖处理8周后的小鼠头颈部出现脱毛现象,而其他部位没有,该症状通常与干细胞、细胞凋亡、氧化应激及黑色素含量丧失密切相关,与人体衰老特征相似[18-19],但这种脱毛以1个部位为中心的现象也类似斑秃,这是一种慢性炎症自身免疫性疾病,以无疤痕脱发为主要表现[20]。研究发现,斑秃与许多因素相关,其中就包括氧化应激[21]。但D-半乳糖是否会诱导出现斑秃并没有报道,还有待进一步研究。
SOD、GSH-Px活性和MDA含量与氧化应激和衰老密切相关[22-23]。其中,SOD与GSH-Px具有很强的清除自由基能力,是机体重要的抗氧化酶,MDA含量能反映脂质过氧化的程度及自由基对组织和细胞的攻击作用[24]。结果显示,D-半乳糖处理过后对以上指标都产生影响,尽管500和1 000 mg/(kg·d)D-半乳糖组并不是所有指标都有差异,但从趋势上看1000 mg/(kg·d)D-半乳糖组对以上指标影响更大。
衰老在细胞层面常常表现出细胞体积缩小,水分减少、核变形固缩、异常分叶、染色加深等病理学改变[25]。本研究结果发现,小鼠肝小叶细胞出现水肿、点状坏死等病理学改变,这与炎症密切相关,提示D-半乳糖诱导的衰老模型可能同时伴随着组织炎症反应,脑海马区齿状回颗粒细胞核深染固缩,这与细胞衰老所表现出的现象一致。
HO-1是血红素加氧酶中的诱导型酶,近年来发现其广泛参与体内抗炎与抗氧化过程,机体在正常情况下,HO-1的表达水平很低,但出现氧化应激时,作为应激蛋白HO-1表达水平会明显升高以抑制损伤的发生[26-27]。目前小鼠衰老模型的主要检测指标仍为生化指标,尚无检测HO-1的报道,本研究显示,D-半乳糖组小鼠肝脏和脑组织中HO-1表达水平高于对照组,证实HO-1与小鼠衰老密切相关。1 000 mg/(kg·d)D-半乳糖组HO-1表达水平比500 mg/(kg·d)D-半 乳糖组更高,这与生化检测结果趋势基本一致。
D-半乳糖诱导的小鼠衰老模型是一种简便的氧化应激和抗氧化、抗衰老的研究方法。虽然目前仍存在争议,但是已广泛应用到氧化应激相关研究中。本研究选用高剂量D-半乳糖诱导个体差异较小的近交系小鼠C57BL/6J,成功地复制一种可用于氧化应激和抗氧化、抗衰老研究的衰老模型。

