老年大鼠大脑中动脉永久性缺血与缺血再灌注 对大脑损伤的比较研究
许娜,渠静,王赛楠,江炜,奥婷,张君,张芹,肖淑英,张瑞华
(首都医科大学附属北京潞河医院 1.老年医学科,2.中美神经研究所,北京 101149)
缺血性脑卒中是中老年人易患的三大疾病之一,呈高发病率、高致残率和高死亡率的趋势,给社会和家庭带来沉重负担。脑缺血发病后出现缺血再灌注(ischemia reperfusion, IR)的相关问题,既可以改善脑组织的血液供应,恢复神经功能,又可导致损伤[1]。目前脑I/R带来保护或损伤的机制尚不清晰,炎症和氧化反应可能是重要的因素[2-4]。本研究采用大鼠中脑动脉闭塞(middle cerebral artery occlusion, MCAO)的方法复制动物模型,观察老年大鼠大脑I/R后脑梗死相关指标的改变[5]。
1 材料与方法
1.1 实验动物及分组
清洁级雄性老年SD大鼠(北京维通利华公司提供)30只,体重520~550 g,术前1周适应环境。将大鼠随机分为假手术组(Sham组)、永久性缺血组 (I组)和缺血再灌注组(I/R组),每组10只。I/R组插入线栓2 h后拔出,I组仅插入线栓不拔出,Sham组在麻醉后仅分离动脉。
1.2 实验试剂及仪器
2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)(北京兰博利德生物技术有限公司),硅胶线栓(北京西浓科技有限公司),高迁移率族蛋白-1(high mobility group protein 1, HMGB1)酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)ELISA试剂盒、丙二醛(Malondialdehyde, MDA)ELISA试剂盒(上海酶联生物科技有限公司),HMGB1单克隆抗体(美国Abcam公司),β-actin多克隆抗体(北京冠星宇科技有限公司)。
1.3 动物模型的复制
将老年大鼠置入麻醉机诱导箱内全身麻醉2~3 min,置于手术台改用呼吸导管维持麻醉,大鼠全身肌肉松弛,仰卧固定,剃去颈前区毛发,消毒手术区域皮肤,行颈正中切口,钝性分离皮下组织,用自制拉钩分离大鼠右侧乳突肌与胸骨舌肌之间的肌间隙,暴露颈总动脉,钝性分离颈总动脉与周围组织,显微镊挑出颈总动脉穿线备用。钝性分离颈内外动脉后,电凝颈外动脉小分支,于距颈总动脉3~4 mm处结扎颈外动脉并电凝离断,在游离血管残端与颈总动脉间打一活结。动脉夹夹闭颈总动脉及颈内动脉,在颈外动脉残端剪一小口,将硅胶线栓沿颈内动脉的夹角外切口插入,将颈外动脉残端拉向外上方,使之与颈内动脉走向平行,将线栓沿颈内动脉走向轻柔缓慢推进,当感觉到有阻力时,提示线栓进入大脑中 动脉[5-6]。
1.4 脑血流检测
老年SD大鼠经异氟烷诱导并维持麻醉,俯卧位固定,沿头皮正中切开,用双氧水去除骨膜及颅骨表面的脂类,充分暴露颅骨和前囟。在前囟后2 mm、右侧旁开5 mm处,用小型颅骨钻将颅骨磨薄(不能钻透)。用激光多普勒仪(瑞典PeriFlux5000系统)监测血流。
1.5 脑梗死体积测量
术后24 h麻醉大鼠,快速断头取脑组织,将脑组织切片置于2% TTC溶液中染色[7]。可见梗死灶区呈白色,正常组织呈红色,部分组织由白色向红色过渡。用Image J 1.42加以分析(NIH图像分析软件)。
1.6 脑组织HMGB1、MDA含量及SOD活性检测
各组大鼠处死后去脑组织,提取蛋白,严格按照ELISA试剂盒说明书进行操作,使用酶联仪于450 nm波长处测吸光度值,通过绘制标准曲线求出标本中的HMGB1、MDA及SOD质量浓度。
1.7 Western blotting检测脑组织HMGB1蛋白的表达
大鼠处死后取脑组织,置于冰上研磨,加入蛋白裂解液和蛋白酶抑制剂,4℃、12 000 r/min离心30 min,取上清。BCA法测定蛋白浓度。取10μg蛋白进行凝胶电泳。当电泳完成后,电转至聚偏二氟乙烯膜上,5%脱脂奶粉室温封闭1 h。加入单克隆抗体HMGB1(1∶10 000稀释)室温孵育2 h。TBST洗涤后,加入二抗室温孵育1 h。TBST洗涤,电化学发光试剂显色。β-actin作为内参,使用LabWork 4.0图像分析软件进行检测。每份样品检测3次,取其平均值。
1.8 统计学方法
数据分析采用SPSS 19.0统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠脑血流比较
3组大鼠术后0、2、6、12及24 h的脑血流量比较,采用重复测量设计的方差分析,结果如下:①不同时间点的脑血流量比较,差异有统计学意义(F=18.267,P=0.000);②3组的脑血流量比较,差异有统计学意义(F=103.912,P=0.000);③各组脑血流量变化趋势比较,差异有统计学意义(F=19.183,P=0.000)。见表1和图1。
表1 3组大鼠不同时间点脑血流量比较(n =10,ml/min,±s)
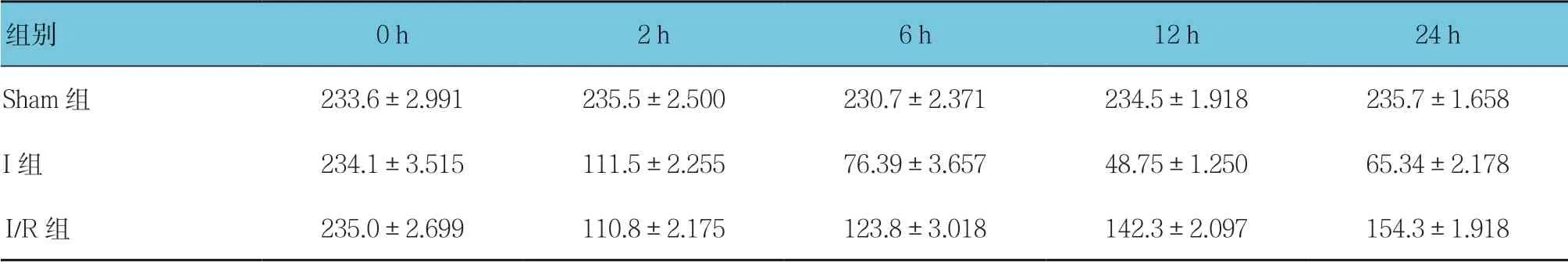
表1 3组大鼠不同时间点脑血流量比较(n =10,ml/min,±s)
组别0 h2 h6 h12 h24 h Sham组233.6±2.991235.5±2.500230.7±2.371234.5±1.918235.7±1.658 I组234.1±3.515111.5±2.25576.39±3.65748.75±1.25065.34±2.178 I/R组235.0±2.699110.8±2.175123.8±3.018 142.3±2.097154.3±1.918
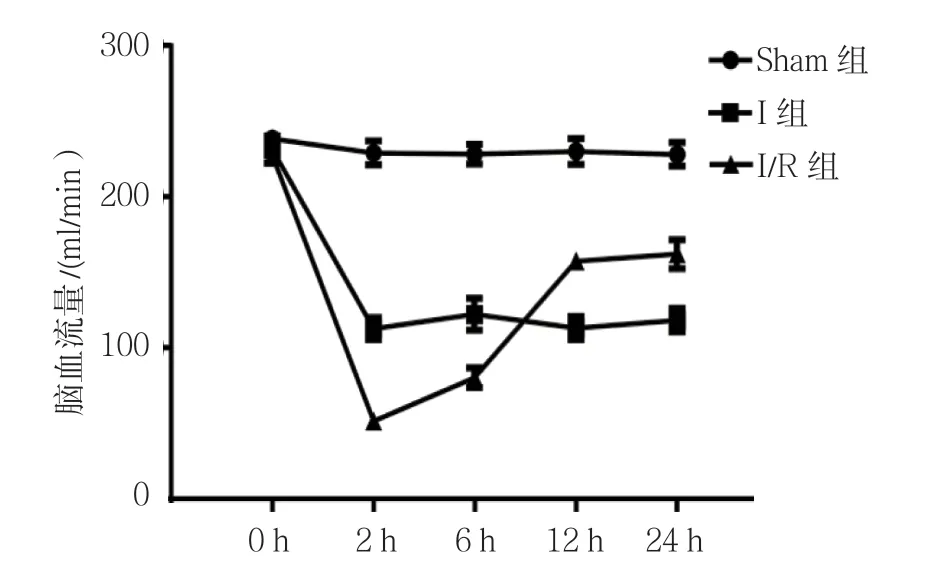
图1 3组大鼠脑血流量变化趋势(n =10,±s)
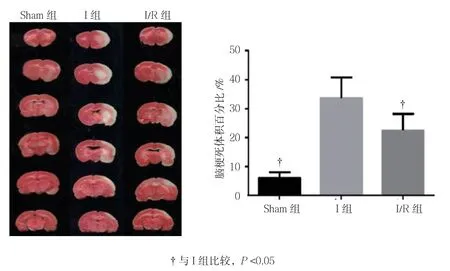
图2 3组大鼠脑梗死体积比较(n =10,±s)
2.2 3组大鼠脑梗死体积比较
Sham组、I组及I/R组大鼠脑梗死体积百分比分别为(6.673±1.690)%、(33.523±6.112)%和(20.167±4.733)%,经方差分析,差异有统计学意义(F=38.83,P=0.000)。与Sham组相比,I组升高(P<0.05);与I组相比,I/R组降低(P<0.05)。见图2。
2.3 3组大鼠脑组织SOD活性及MDA、HMGB1含量比较
Sham组、I组及I/R组大鼠脑组织SOD活性分别为(468.974±34.429)、(310.247±49.118)和(388.971±63.496)pg/ml,经方差分析,差异有统计学意义(F=15.410,P=0.000);与Sham组相比,I组降低(P<0.05),与I组相比,I/R组升高(P<0.05)。Sham组、I组及I/R组大鼠脑组织MDA含量分别为(103.009±44.517)、(228.558±41.504)和(163.879± 35.709)pg/ml,经方差分析,差异有统计学意义(F= 14.780,P=0.000);与Sham组相比,I组升高(P<0.05),与I组相比,I/R组降低(P<0.05)。Sham组、I组及I/R组大鼠脑组织HMGB1含量分别为(137.388±31.958)、(336.370±57.112)和(211.353±38.913)pg/ml,经方差分析,差异有统计学意义(F=33.780,P=0.000);与Sham组相比,I组升高(P<0.05),与I组相比,I/R组降低(P<0.05)。见图3、4。

图3 3组大鼠脑组织SOD活性及MDA含量比较(n =10,±s)
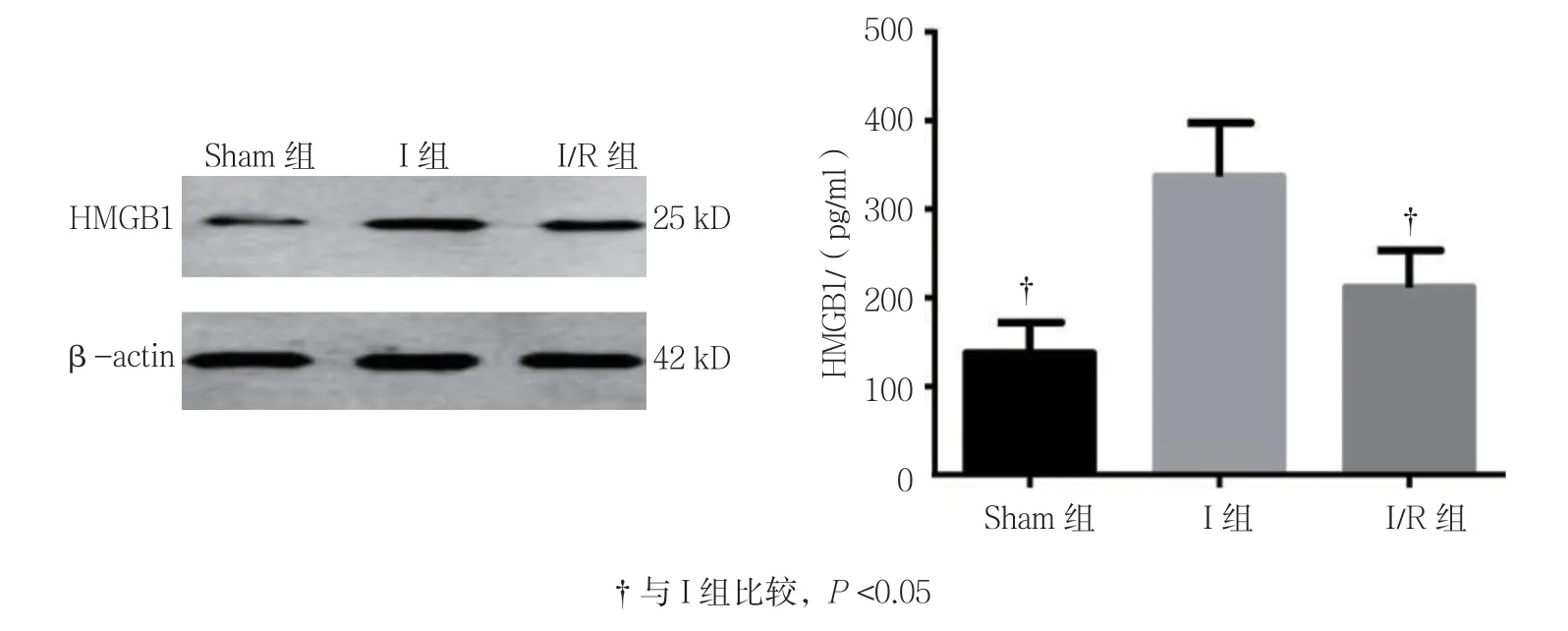
图4 3组大鼠脑组织HMGB1含量比较(n =10,±s)
3 讨论
大脑中动脉是缺血性疾病的好发部位,缺血机制和治疗手段的探索一直是神经科学领域关注的重要问题。在脑缺血机制的研究中,血管线栓阻塞大脑中动脉模型应用广泛[8]。本实验采用该方法分别复制老年大鼠永久性局灶性缺血模型和缺血2 h后拔出线栓形成的老年大鼠局灶性脑IR模型。
脑IR相关保护和损伤的机制尚不明确,其中炎症反应可能是重要因素[9-12]。炎症反应中期,机体释放大量的促炎因子,引发炎症反应,造成组织水肿甚至损伤;而炎症反应晚期,肿瘤坏死因子-α等细胞因子可促进HMGB1的释放,导致炎症反应,加重组织损伤[13-14]。CHEN等[15]的研究也相同结果,脑缺血损伤患者血浆中HMGB1表达高于正常人群。但是也有专家认为,IR相关保护方面的机制研究不足[2]。因此,笔者设计本实验,观察脑IR后梗死体积、SOD、MDA及HMGB1等相关指标。SOD是细胞内主要的抗氧化酶,能清除氧自由基从而抵抗其对细胞造成的损伤。MDA是细胞膜脂质氧化后的产物之一,也是细胞遭受氧化应激损伤的标志物[16]。本研究观察IR过程中老年大鼠脑组织中SOD活性及MDA含量,结果表明再灌注后SOD活性升高,MDA含量降低,提示再灌注可能通过提高抗氧化酶活性,降低氧化应激产物,从而减轻脑缺血后大脑的损伤。
本研究的另一结果是I组大鼠脑组织中HMGB1的表达高于Sham组,I/R组大鼠脑组织HMGB1的表达低于I组,提示HMGB1参与永久性缺血和IR的炎症反应过程,并且再灌注可能通过降低HMGBI的释放从而减轻脑缺血后对大脑的损伤。
综上所述,与永久性缺血相比,IR对脑梗死具有一定的保护作用,该作用可能通过提高抗氧化酶活性,降低氧化应激产物,抑制HMGB1的表达等途径得以实现,但其具体的分子调控机制,尚需进一步深入 研究。

