四种结核分枝杆菌检测方法临床诊断效能的评价
代小伟 陈双双 杨新宇 赵琰枫 田丽丽 易俊莉 陈昊 丁北川
结核病病原学检查是发现传染源的主要途径和手段,是确定结核病诊断和选择化疗方案的重要依据。世界卫生组织[1]在《2018年全球结核病报告》中指出,2017年全球约有1000万例新发结核病患者,其中有640万例新发患者被正式通报给国家有关部门,估计数与报告数之间的差距,主要是由于病例漏报以及漏诊造成的。为减少漏报和漏诊,提高细菌学检查阳性率,中华人民共和国国务院办公厅[2]发布了《“十三五”全国结核病防治规划》,要求肺结核患者病原学阳性率要达到50%以上。本研究采用痰涂片抗酸染色镜检(简称“涂片法”)、L-J培养基(Lowenstein-Jenden medium)固体培养(简称“L-J法”)、BACTEC MGIT 960液体培养(简称“MGIT 960法”)及GeneXpert MTB/RIF(简称“GeneXpert法”)等4种方法对疑似肺结核患者痰标本进行检测,比较和评价4种方法单独检测及联合检测的诊断效能。
材料和方法
一、一般资料
本研究选取2018年1月1日至2018年12月31日就诊于北京结核病控制研究所门诊的451例疑似肺结核患者(样本数量达到诊断性试验样本量的要求),每例患者留取痰标本,同时完成3次涂片法、2次L-J法、1次MGIT 960法和1次GeneXpert法检测。并对固体或液体培养物用PCR方法进行初步菌群鉴定,对非结核分枝杆菌(NTM)进行微阵列基因芯片检测。
二、仪器和试剂
萋-尼抗酸染色染液由珠海贝索生物技术有限公司生产,酸性罗氏培养基由河南赛诺特生物技术有限公司生产,MGIT 960全自动结核分枝杆菌快速液体培养仪及其配套试剂由美国BD公司生产,GeneXpert MTB/RIF核酸检测仪及试剂由美国Cepheid公司生产。PCR-荧光探针法检测使用Roche LightCycler 480仪,试剂由北京博奥晶典生物技术有限公司生产。晶芯分枝杆菌菌种鉴定试剂盒(微阵列基因芯片法)、核酸提取仪ExtractorTM36、晶芯微阵列芯片扫描仪LuxScan-10K/B、晶芯芯片杂交仪BioMixerTMⅡ、晶芯SlideWasherTM8芯片洗干仪均购自博奥生物有限公司。
三、检测方法
1.涂片法:采用萋-尼抗酸染色,按照《结核病实验室检验规程》[4](简称“《规程》”)进行痰涂片抗酸染色镜检及结果判读。同一例3份完成涂片的标本中,任何一份发现抗酸杆菌即判定为涂片阳性。
2.L-J法:按照《规程》,将痰液用4%NaOH以1∶1比例进行消化处理,15 min后取0.1 ml接种到酸性罗氏培养基中。每周观察1次培养基,发现菌落生长后挑取菌落完成涂片,菌落经抗酸染色镜检阳性者报培养阳性;2个月未见菌落生长报告阴性。同一患者2份完成固体培养的标本中,任何一份发现抗酸杆菌生长即判定为L-J检测阳性。阳性菌落进行抗酸染色镜检,确定菌纯度,同一份标本GeneXpert法检测阴性而L-J法培养阳性的菌株,进行PCR检测,做初步菌群鉴定。
3.MGIT 960法:严格按照BACTEC MGIT 960系统操作说明书进行操作,吸取0.5 ml痰标本加入到50 ml圆底离心管内,再加入1~2 ml前处理液(NALC-NaOH),震荡消化15 min,加入40 ml 磷酸盐缓冲液(PBS)中和离心(3000×g离心18 min),弃上清,加1 ml的PBS进行重悬沉淀,取0.1 ml接种到准备好的培养管内。培养阴性结果报告时间设定为满42 d。仪器报告阳性后,取培养液进行抗酸染色镜检,确定菌纯度,同一份标本GeneXpert法检测阴性而MGIT 960法培养阳性的菌,进行PCR检测,做初步菌群鉴定。
4.GeneXpert法:检测严格按照说明书操作,取1 ml痰标本,加入2 ml标本处理液,震荡混匀,静置15 min后,吸取2 ml液化标本于反应盒内,将加好标本的反应试剂盒放到检测仪内,开始自动检测,反应结束后在检测系统窗口下直接观察测试结果。
5.PCR检测:对GeneXpert 法检测阴性,且其他3种方法检测阳性的患者菌株进行PCR荧光探针法检查,挑取少量菌落入80 μl核酸提取液,充分涡旋后放入核酸提取仪,最大转速震荡5 min,95 ℃水浴5 min, 离心半径8.2 cm,5000 r/min 离心1 min;取上清2 μl入扩增反应液,上机。样本扩增曲线为S型,Ct值<40判定为阳性。
6.微阵列基因芯片:PCR检测鉴定为NTM的菌株,进行微阵列基因芯片检测。在核酸提取管中加入50 μl 核酸提取液,挑取单个菌落放入核酸提取仪,最大转速震荡5 min后95 ℃水浴5 min,5000×g离心1 min;将2 μl提取出来的DNA 加入至18 μl反应体系中,按晶芯分枝杆菌菌种鉴定试剂盒说明书进行扩增、变性,从盖片的加样孔中加入14 μl杂交反应物;盖上杂交盒并密封,将密封好的杂交盒水平放入50 ℃的芯片杂交仪中杂交2 h,记录芯片的编号、微阵列位置及对应的样本编号;待杂交反应结束后将芯片从杂交盒中取出,用十二烷基硫酸钠洗液和柠檬酸钠洗液冲洗干净,甩干后放入芯片扫描仪,用晶芯结核分枝杆菌检测芯片系统判读芯片结果。
四、质量控制
1.抗酸染色镜检质量控制:(1)相应检验项目按照《规程》相关规定,完成室间质量评估,项目质量合格。(2)相应检验项目按照《规程》相关规定,建立并严格执行室内质量保障体系相关规定。
2.痰培养质量控制:(1)固体培养质量控制。每批培养基进行无菌性测试和敏感性测试;培养基在冷藏条件下不超过2个月。(2)液体培养质量控制。每月打印质量控制报告;每批MGIT培养管进行常规质量控制检测(使用结核分枝杆菌H37Rv菌液制备)。
3.GeneXpert法质量控制:每个检测匣定期进行样品处理质量控制(SPC)和探针质量控制(PCC),以确保样品经过正确处理和探针符合指定的接受标准,保证检测系统合格。
4.PCR质量控制:检测中同时提取试剂盒内提供的阳性对照和阴性对照液体的DNA,并与样品同时检测,确保实验结果的准确性。
5.微阵列基因芯片质量控制:检测中同时扩增试剂盒内提供的阳性对照和阴性对照DNA,与样品同时检测,确保实验结果的准确性。
五、统计学处理
所有检测项目结果、患者基本信息及患者临床诊断结果,采用SPSS 17.0统计软件进行统计分析,计数资料的比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
一、临床诊断结果
451例疑似肺结核患者痰标本性状分布:889份为黏液痰,12份为干酪痰,37份为血痰,415份为唾液,合格痰标本占69.3%(938/1353),不合格标本占30.7%(415/1353)。根据临床症状、胸片及实验室检查项目结果,按照《WS 288—2017肺结核诊断》标准[5]进行诊断。451例可疑肺结核患者中,临床最终诊断为肺结核患者227例(肺结核225例、肺结核并发结核性胸膜炎2例),非肺结核患者224例(NTM肺病11例,陈旧性肺结核6例,肺部阴影待查181例,胸腔积液3例,肺纤维化1例,肺炎3例,肺癌1例,密切接触者筛查18例)。其中NTM肺病患者先经过PCR检测确定为NTM,再取患者2次培养阳性菌株进行微阵列基因芯片检测,2次检测结果为同一种NTM者,最终诊断为NTM肺病。
二、各方法单独检测及联合检测的诊断效能比较
1.本研究4种方法单独检测的诊断效能比较:以临床诊断为参考标准判断4种方法单独检测的诊断效能结果见表1。从表1可以看出,4种检测方法的敏感度与一致率从高到低的排位顺序为MGIT 960法、GeneXpert法、L-J法、涂片法。
对4种检测方法的诊断敏感度进行检验,L-J法检出率高于涂片法,差异有统计学意义(χ2=232.612,P<0.01);GeneXpert法检出率高于L-J法,差异有统计学意义(χ2=211.335,P<0.01);MGIT 960法检出率明显高于GeneXpert法,差异有统计学意义(χ2=213.736,P<0.01)。4种方法与临床诊断的一致率均在59.0%~69.0%之间。
2.本研究4种方法检测后联合判断的诊断效能比较:对3组联合检测方式的诊断敏感度进行检验,3种方法联用的检测敏感度高于2种方法联用,差异有统计学意义(χ2=155.807,P<0.01);4种方法联用的检测敏感度高于3种方法联用,差异有统计学意义(χ2=176.173,P<0.01),4种方法联用的检测敏感度最高,与临床诊断的一致率较4种方法单独检测高10%左右(表2)。
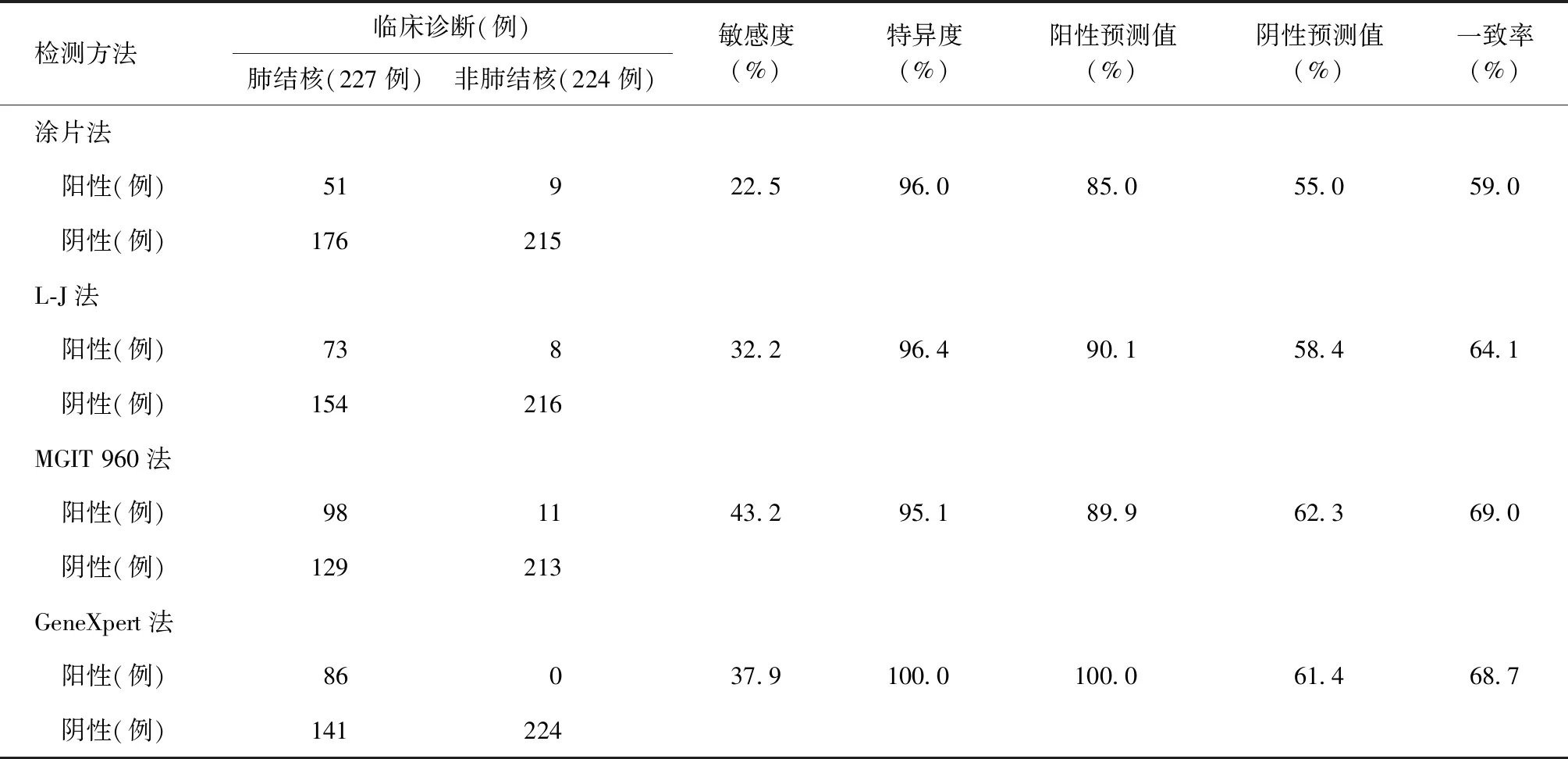
表1 以临床诊断为参考标准判断4种方法单独检测的诊断效能
注敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%;一致率=(真阳性例数+真阴性例数)/样本总例数
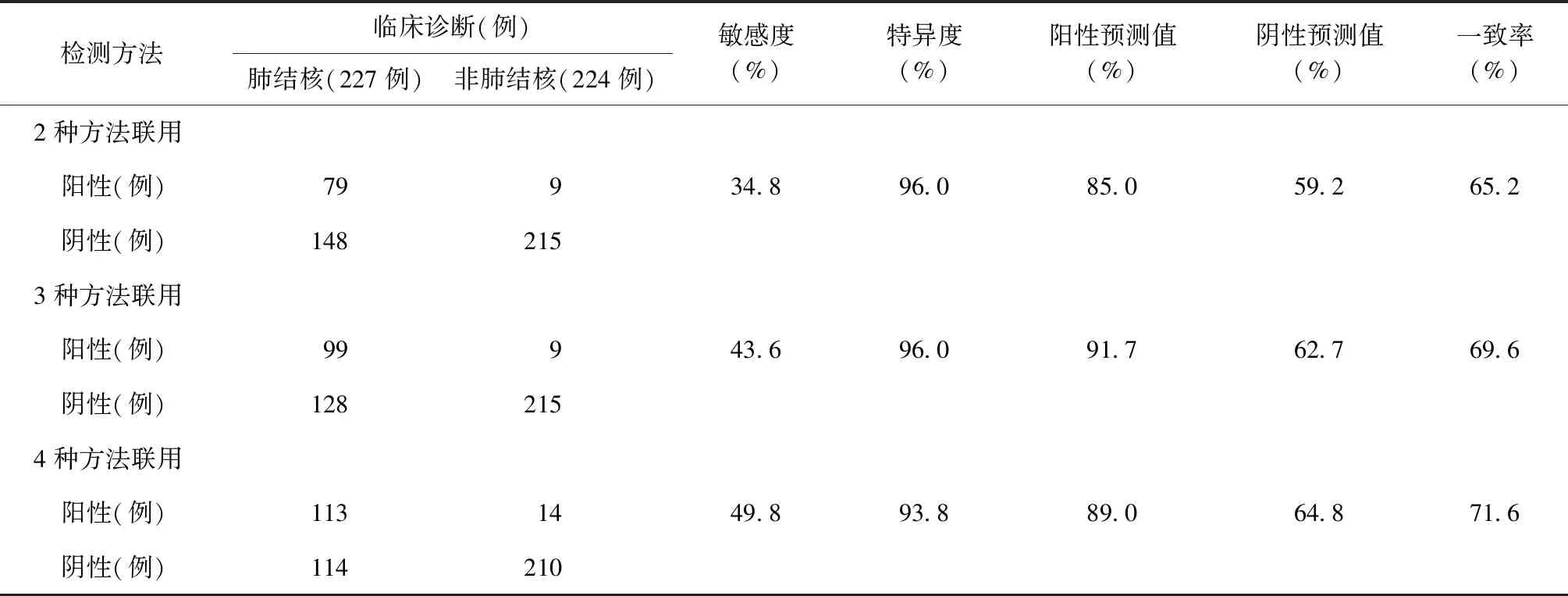
表2 以临床诊断为参考标准判断4种方法检测后联合判断的诊断效能
注2种方法联用:涂片法和L-J法联用;3种方法联用:涂片法、 L-J法 和GeneXpert法;4种方法联用:涂片法、L-J法、GeneXpert法和MGIT 960法联用。敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%;一致率=(真阳性例数+真阴性例数)/样本总例数
3.涂阴疑似肺结核患者中L-J法、GeneXpert 法以及MGIT 960法的检出情况:227例肺结核患者中,涂片法检测阴性为176例。涂阴的标本中,用L-J法检出阳性28例,阳性检出率为15.9%;用GeneXpert法检出阳性40例,阳性检出率为22.7%;用MGIT 960法检出阳性52例,阳性检出率为29.5%。GeneXpert法与L-J法对涂阴结核病的阳性检出率比较,差异有统计学意义(χ2=44.599,P<0.01);MGIT 960法与GeneXpert法比较,差异有统计学意义(χ2=56.693,P<0.01)。
讨 论
2017年11月9日,中华人民共和国国家卫生和计划生育委员会颁布了《WS 288—2017 肺结核诊断》。将分枝杆菌核酸检测和液体培养均纳入了结核病病原学检查范畴[5]。本研究选取门诊疑似肺结核患者痰标本,进行涂片法、L-J法、MGIT 960法和GeneXpert等4种病原学方法检测。涂片法简单快捷,成本低易普及,目前仍是国内最主要的患者发现方法和随访时疗效的监测手段[6-7]。但涂片法阳性检出率低,在本组结核病患者中检测敏感度为22.5%(51/227),难以满足临床诊断的需求。从结核病控制、流行病学调查研究和临床诊断与治疗的角度看,分枝杆菌的分离培养是结核病病原学诊断的“金标准”[8]。但结核分枝杆菌生长缓慢耗时长,需5~8周时间,明显滞后于临床医师对肺结核早期诊断的期望[9]。
2010年WHO即推荐使用GeneXpert MTB/RIF分子诊断技术,其基于半巢式定量PCR扩增过程,在一个封闭的试剂盒中自动完成,可在2 h内完成检出结核分枝杆菌的同时,可检测结核分枝杆菌对利福平的耐药基因是否发生突变[10],进而为判断是否存在利福平耐药提供参考依据;该检测方法对结核病的诊治具有里程碑式的意义[11]。本研究中GeneXpert法检测的敏感度明显高于涂片法和L-J法,与赵冰等[12]、周喜桃等[13]的研究结果一致,并以该检测方法具有快速、简单、敏感度高、对生物安全要求不高且能同时检测对利福平的耐药情况等优点,推荐其在基层实验室使用和推广。1977年美国BD公司研制出基于液体培养的BACTEC分枝杆菌全自动检测系统。与固体培养相比,目前的MGIT 960系统,在操作步骤上除了去污染试剂相对“温和”且更高效外,还调整采用了中和离心集菌等接种前的处理步骤,明显提高了分枝杆菌分离培养阳性率;同时由于在专用7H9培养管中加入含有Ruthenium的荧光底物,当细菌生长时,通过细菌代谢监测底物激发产生荧光,也缩短了阳性结果的判定时间。本研究中,MGIT 960法检测的敏感度最高达43.2%,与Zhao等[14]的研究结果相符。4种检测方法中,GeneXpert法和MGIT 960法的敏感度明显高于传统的涂片法和L-J法。
目前,大部分基层医院以传统抗酸染色镜检为结核病患者的主要发现手段,阳性率仅在25%左右,仍有75%的涂阴肺结核疑似患者面临诊断问题[15]。本研究总结了涂阴结核病患者分别用L-J法、GeneXpert法和MGIT 960法检测后,阳性检出率均有不同程度的提高,其中L-J法和MGIT 960法对涂阴肺结核的检出率与张娟等[16]的研究结果相近,较郭新枝等[17]的研究结果低近1倍,分析原因可能与痰标本的质量有关系。杨新宇等[3]研究显示,痰标本的质量与检测阳性率有着密切的关系;郭新枝等[17]的研究中,研究对象均为住院患者,其在医护人员指导和监视下留痰的质量比较高;而本研究的研究对象均为门诊患者,痰标本质量不易控制,其中不合格标本占30.7%。
为掌握结核病临床诊断病原学依据,满足结核病防治工作的要求,已有很多报告尝试和研究将不同检测方法进行联合检测[18-21]。根据《“十三五”全国结核病防治规划》要求,肺结核患者病原学检测阳性率要达到50%以上。按照北京市各区(县)结核病检测实验室的实际情况,本研究将病原学检测方法进行3种组合,并比较其诊断效能。传统涂片法和L-J法联合应用时,阳性率为34.8%,检出效率不如单独应用GeneXpert法或MGIT 960法高;将GeneXpert法与涂片法和L-J法联合应用时,病原学阳性率提高到43.6%;而将涂片法、L-J法、GeneXpert法和MGIT 960法联合应用时,病原学阳性率可达到49.8%;如果加强对结核病患者进行宣传教育,引导其正确地留取高质量痰液标本,必然能达到国家《“十三五”全国结核病防治规划》关于病原学检测阳性率达到50%以上的要求。虽然液体培养仪器和实验操作步骤略复杂,前处理有集菌过程,对实验人员和实验环境要求都比较高,但鉴于MGIT 960法对病原学阳性率的贡献,以及其培养时间较短、阳性培养物可后续进行分子及表型药物敏感性试验等优点,仍应鼓励有条件的区(县)结核病检测实验室积极开展液体培养。
本研究结果显示,以临床诊断为参考标准,MGIT 960法检测的敏感度、一致率最高,GeneXpert法特异度最高。有研究主张用GeneXpert、离心浓缩涂片法及MGIT 960法取代传统的涂片及培养[22],笔者认为在不同条件的检测实验室,各种检测方法均占有重要的地位,检测中不能互相代替。为更好地服务患者、服务临床,以及提高病原学阳性率、减少漏诊,建议将上述4种病原学检测方法联合应用,以实现各种检测方法诊断效能的最大化。

