超微血流成像技术在颈部淋巴结结核分型诊断中的应用价值
沈梦君 陈宏伟 毕珂 张怡 丛阳 王茵
淋巴结结核表现多样,与部分良、恶性淋巴结疾病鉴别困难,且随病程发展同一患者不同病灶之间分期也有差异,给临床诊断造成很大困难[1]。既往有学者在淋巴结结核不同病理阶段的基础上,根据大小、数量、形态、边缘、内部回声特点、有无淋巴门及血供情况,对颈部淋巴结结核进行超声分型,被证明具有较高的临床实用性,对指导患者治疗和随访起到了一定的作用[2]。
由于上述分型方法在观察淋巴结血供情况时采用传统的彩色多普勒血流成像技术(color doppler flow imaging, CDFI)仅能显示管径>0.2 mm、流速相对较高的血流信号[3],因此丢失了部分血流信息,造成分型诊断的误差。超微血流成像技术(superb micro-vascular imaging,SMI)是近年来发展的一项新的高分辨率彩色血流成像技术[4],它通过智能化测量及自适应的信号处理技术来精准区分血流与组织运动产生的伪像。前期临床研究表明,SMI技术能够检测0.4 cm/s甚至更低的血流流速信号[5],且较CDFI具有更高的空间分辨率,运动伪像产生更少,因此在对病灶的血供检测中具有更高的敏感度和准确性。
本研究在应用灰阶超声+CDFI进行淋巴结结核的超声分型诊断基础上,采用SMI对结核性淋巴结的血流进行再次检测,对比应用灰阶超声+CDFI与灰阶超声+SMI的血流信号显示情况和超声分型诊断的差异,并与病理结果进行比较,探讨SMI在颈部淋巴结结核超声分型诊断中的价值。
资料和方法
一、研究对象
回顾性分析2018年3—6月就诊于同济大学附属上海市肺科医院超声科行淋巴结穿刺活检且明确诊断为颈部淋巴结结核的30例患者。30例患者有78枚肿大淋巴结,其中10例(33.3%)单发,20例(66.7%)多发;年龄17~66岁,平均年龄(42.9±15.2)岁,男9例(30.0%),女21例(70.0%)。每例患者检查前均签署知情同意书。
二、 入组标准和排除标准
1. 入组标准:(1)目标淋巴结纵径>10 mm者;(2)穿刺活检后经病理学、细菌学或结核分枝杆菌基因检测确诊为淋巴结结核者;(3)未经抗结核药物治疗者。
2. 排除标准: (1)严重精神障碍不能配合者;(2)严重器官功能衰竭者;(3)存在其他有创操作禁忌证者。
三、仪器与方法
1.仪器与器械:彩色多普勒超声诊断仪采用Toshiba Aplio400(东芝,日本),线阵探头,频率4~9 MHz,配备SMI成像功能。活组织检查取材器械使用Duo Smart一次性半自动穿刺活检针(德迈特,意大利),型号16 G×10 cm,取样槽1.0 cm或2.0 cm可调。
2.超声检查:检查时嘱患者去枕平卧,头后仰,充分暴露颈部。首先行灰阶超声检查,根据淋巴结位置调节超声探测深度为2.5~4.0 cm,观察病灶部位、大小、形态、边缘、内部回声等。在CDFI模式下观察淋巴结血流情况,调节彩色标尺(2.0~4.0 cm/s)及血流增益(40%~60%),使血流充盈且不外溢。然后切换到SMI模式(标尺0.4~1.0 cm/s)、血流增益(40%~60%),观察同一个淋巴结的血供情况。两次取样框覆盖相同范围,分别记录淋巴结血流有无和血流分布的情况,在此基础上结合灰阶超声图像特征进行分型诊断。以上检查由2名具备5年以上超声诊断经验的医师完成,诊断意见一致即为最终结果;若意见不一致,交由另1名高年资医师分析,共同讨论得出最终结果。
3.超声引导下穿刺与活组织检查:常规消毒、铺巾、局部浸润麻醉后,在超声引导下对有血供的区域进行多方向不同区域穿刺活检。对于有坏死的病灶,在坏死区域和周围区域均留取标本,并明确标记。穿刺取得至少3条长1.0 cm以上的连续饱满的活组织条视为取材成功,交由病理科和检验科进行后续诊断。
4.图像分析与诊断标准:采用岳林先等[6]提出的淋巴结结核超声分型诊断方法,根据超声图像特征将颈部淋巴结结核分为4型:Ⅰ型为急性炎症型,灰阶超声表现为淋巴结增大,形态为椭圆形或类圆形,边界尚清晰,有完整包膜,内部及淋巴结髓质回声均降低;CDFI显示淋巴结内血流丰富,病理表现主要为淋巴细胞增生。Ⅱ型为干酪坏死型,灰阶超声表现为淋巴结增大,呈串珠样分布,相互融合并与皮肤粘连,内部回声较低,髓质回声消失;CDFI显示淋巴结内无血流信号,病理表现主要为凝固性坏死组织。Ⅲ型为寒性脓肿型,灰阶超声表现为淋巴结显著增大,边界欠清晰,形态不规则,内部回声不均匀;CDFI仅显示肿块周边血流,病理表现主要为液化坏死组织。Ⅳ型为愈合钙化型,灰阶超声显示淋巴结萎缩变小,形态呈梭形,边界模糊,内部低回声,少数患者病灶内部可见点片状强回声;CDFI显示内部无血流信号,病理表现主要为纤维组织增生。
四、统计学处理
结 果
一、 灰阶超声表现
淋巴结大小:最小者为16.1 mm×10.1 mm,最大者为45.0 mm×34.9 mm,平均大小为(30.5±10.1) mm×(23.5±7.2) mm。
二、 两种超声技术探测时的血流显示情况
应用CDFI血流模式,78枚淋巴结15枚出现内部血流信号,14枚出现外周血流信号,无混合血流信号出现,血流显示率为37.2%(29/78);应用SMI血流模式,19枚出现内部血流信号,22枚出现外周血流信号,6枚出现混合血流信号,血流显示率为60.3%(47/78),两组血流显示率差异有统计学意义(χ2=16.056,P=0.000)。见表1。
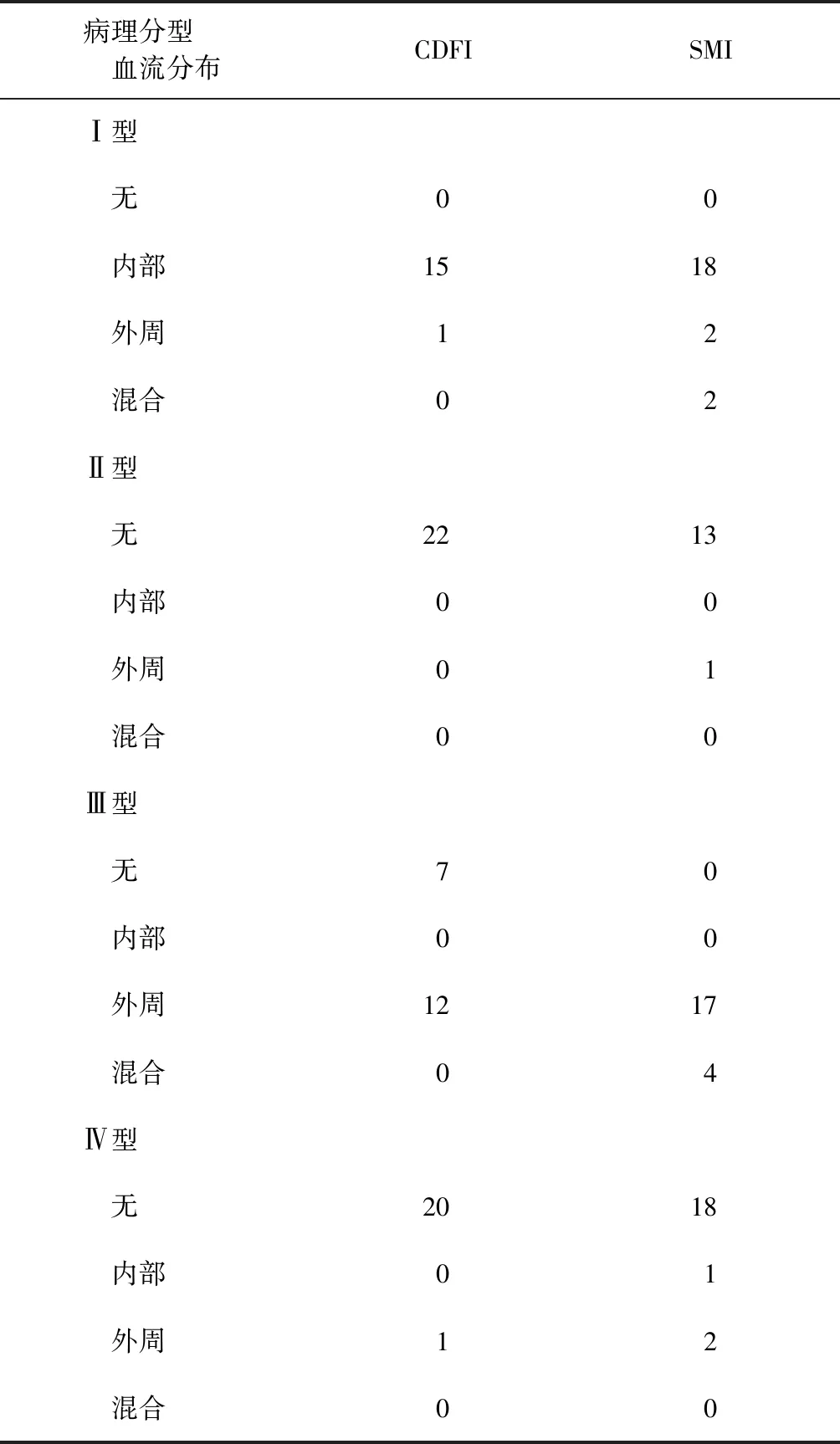
表1 30例78枚不同病理分型患者在两种超声技术检查时的颈部淋巴结结核血流显示情况(枚)
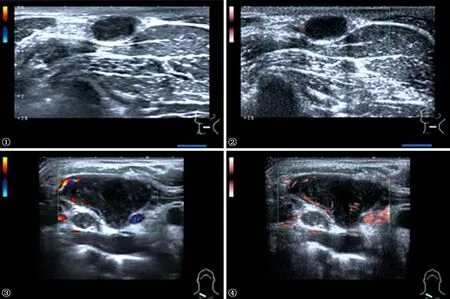
图1,2 患者,女,21岁。因“外院确诊肺结核并发颈部淋巴结结核”,于2018年3月18日来上海市肺科医院就诊,次日在超声科行颈部淋巴结超声检查,发现左侧颈部淋巴结肿大。图1为CDFI探测模式,显示未见血流信号;图2为SMI探测模式,显示可见外周型血流信号 图3,4 患者,男,31岁。因“右侧颈部扪及肿块2个月余”,于2018年4月11日来上海市肺科医院就诊,次日在超声科行颈部淋巴结超声检查,发现右侧锁骨上数个肿大淋巴结。图3为CDFI探测模式,显示外周型血流信号;图4为SMI探测模式,显示混合型血流信号
三、 78枚颈部淋巴结CDFI分型与SMI分型的比较
灰阶超声+CDFI分型结果为:Ⅰ型16枚(20.5%),Ⅱ型22枚(28.2%),Ⅲ型19枚(24.4%),Ⅳ型21枚(26.9%);灰阶超声+SMI分型结果为:Ⅰ型22枚(28.2%),Ⅱ型14枚(17.9%),Ⅲ型21枚(26.9%),Ⅳ型21枚(26.9%)。两种技术对颈部淋巴结结核的分型结果差异有统计学意义(χ2=8.000,P=0.018)。典型患者在两种超声技术探测下的血流信号见图1~4。
四、 一致性分析
78枚肿大淋巴结的病理检查结果:以淋巴细胞、肉芽肿性病变为主25枚(对应超声Ⅰ型),以凝固性坏死组织为主13枚(对应超声Ⅱ型),以坏死组织及肉芽肿性病变为主20枚(对应超声Ⅲ型),以纤维组织增生为主20枚(对应超声Ⅳ型)。
灰阶超声+SMI分型结果与病理结果对比,具有极好的一致性(Kappa=0.948),符合率达96.2%(75/78)。
灰阶超声+CDFI分型结果与病理结果对比,也有很好的一致性(Kappa=0.830),符合率为87.2%(68/78),见表2。
讨 论
淋巴结结核为发病率最高的肺外结核,占肺外结核的80.0%~90.0%[7],其中颈部淋巴结结核占65.0%~85.5%[8]。大部分淋巴结结核累及多个淋巴结,发病时淋巴结肿大,在超声下可见淋巴结结构的破坏以及干酪样坏死等[9]。杨高怡等[10]研究认为,淋巴结结核病理分3型:干酪型、增殖型、混合型。根据演变过程,淋巴结结核可分为4个病理阶段:第一阶段为单核细胞及淋巴细胞增生,形成结核性肉芽肿,病灶主要由上皮细胞及淋巴细胞构成;第二阶段为淋巴结干酪样坏死物质形成期等;第三阶段为淋巴结包膜破坏、相互融合并与周围组织粘连,活动受限,主要为淋巴结内外结核性肉芽肿及慢性非特异性炎性反应;第四阶段为淋巴结内干酪样坏死,组织液化,形成脓肿等。
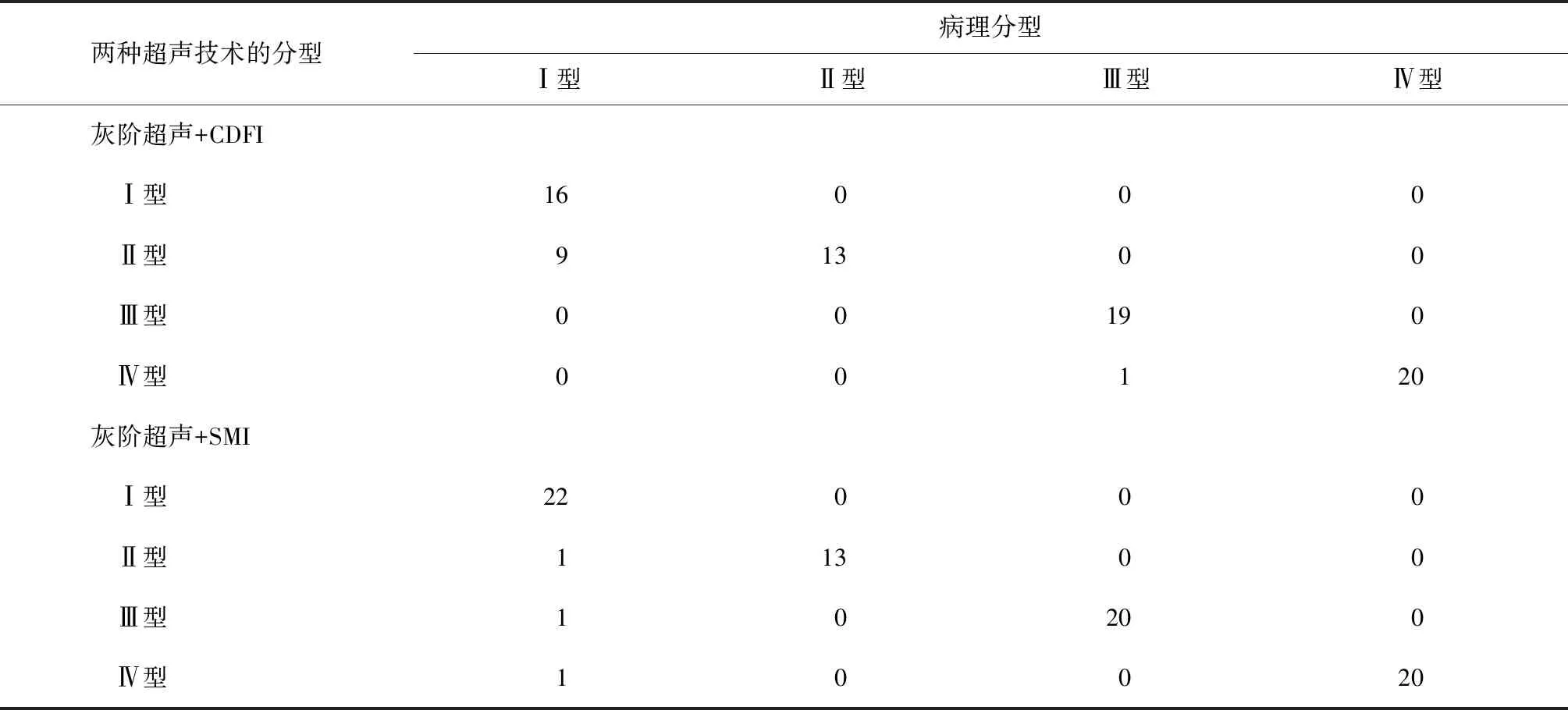
表2 30例78枚肿大淋巴结两种超声技术的分型与病理分型结果对照(枚)
既往结合高频探头及CDFI技术的常规超声检查被广泛应用于浅表淋巴结结核的诊断、鉴别诊断及疗效评估中,有学者在病理改变的基础上依据超声检测淋巴结大小、数量、形态、边缘、内部回声特点、有无淋巴门及血供情况对淋巴结结核进行分型[6]。这一分型方式以超声图像特征为基础,结合病理学改变做出诊断,尽管与经典的病理分型存在一定的差异,但具有较高的临床实用价值,在预后判断及治疗后的超声随访中具有重要意义。
在这一分型方式中,除灰阶超声对淋巴结大小、回声、淋巴门结构的观察外,血流情况也是进行分型诊断的重要依据,如急性炎症型(Ⅰ型)淋巴结内血流丰富;干酪坏死型(Ⅱ型)淋巴结内没有血流信号;寒性脓肿型(Ⅲ型)仅周围区域出现血流信号;愈合钙化型(Ⅳ型)少数可以有少量血流信号。由于CDFI 是通过运动速度来区分快速血流与缓慢组织运动的,因此对慢速血流的敏感度较低,仅能显示管径>0.2 mm、流速相对较高的血流信号[3],淋巴结内低速血流信息常常被遗漏,因此与最终病理结果还有一定差距。
近年来SMI技术得到发展,通过滤过组织内低速运动的干扰信息并应用自适应技术识别消除组织运动伪像,提取出更多的血流信号,处理后以高分辨率图像的形式显示这些信息[11],呈现更加真实的血流信息,可显示管径>0.1 mm、流速>0.4 cm/s的微小血管。该技术具有高敏感度、高空间分辨率、高时间分辨率的特点,可以使微循环的血流信息显示得更清晰,减少组织运动伪像,降低假阳性率的发生。SMI技术已应用于乳腺、甲状腺、类风湿性关节炎、正中神经、颈动脉斑块等方面[12],在类风湿性关节炎、溃疡性结肠炎、克罗恩病活动性的评估,缺血、坏死的判断,以及监控化疗反应等方面也有一定的应用潜力[13-14]。
由于淋巴结内血管较细,血流速度较慢,发生结核后,正常的血管常常被破坏,因此检测更为困难。有学者应用超声造影技术对淋巴结的微循环灌注进行评价[15],能显著提高微血流的检测能力,较好地显示淋巴结内的血流灌注情况。但超声对比剂为纳米级的微气泡,其检测更侧重于微循环灌注功能,以便对病灶进行良恶性鉴别和引导穿刺活检时准确定位到活性区域。SMI技术更侧重于对微小血管和血流的显示,与病理检测到的微血管具有更高的一致性。同时超声造影技术成本相对较高,技术难度增加,不利于基层单位的应用,无法满足长期多次随访观察的临床需求。
本研究中,使用SMI后较CDFI检测的血流信号明显增多,且与病理结果具有更好的一致性,尤其是对Ⅰ型、Ⅱ型淋巴结结核的分型具有更高的准确性。例如在25枚病理和临床诊断的Ⅰ型淋巴结中,CDFI仅发现16枚有血流信号,而SMI发现22枚有血流信号;对于病理和临床诊断的13例Ⅱ型淋巴结结核,SMI仅1枚出现了假阳性,明显低于CDFI(9枚)。
本研究显示SMI技术可明显提高颈部结核性淋巴结的血流显示率,更精准地指导分型,对淋巴结结核治疗、随访,以及预后评估等具有重要意义。有文献报道, Ⅰ型、Ⅳ型内科治疗治愈率达100%;Ⅱ型外科治疗治愈率与内科治疗组差异虽然无统计学意义,但外科治疗组复发率更低;Ⅲ型外科治疗治愈率、复发率均高于内科治疗组[16]。因此,精准的分型对颈部淋巴结结核的治疗方案选择具有一定的指导意义。另外,杜建等[17]研究发现,肺结核患者如并发有明显的肺部空洞,在进行抗结核药物治疗的过程中,其临床转归会受影响;可能与空洞导致局部肺组织血流动力学改变,进而影响到抗结核药物在病变部位的富集浓度有关。因此推测,颈部结核性淋巴结内存在血流与否与其预后相关。SMI技术的应用对颈部淋巴结结核远期疗效预测具有重要意义,甚至可指导早期治疗方式的选择。
综上所述,SMI能敏感捕捉到低速血流,显著提高颈部结核性淋巴结血流的显示率,可更好地对颈部淋巴结结核进行分型诊断。因其无创、简便易行、可重复检查,更加适用于对颈部淋巴结血供变化进行动态观察,在分型诊断、抗结核药物治疗后预后评估,以及指导临床治疗方案的制定等方面有着良好的应用前景。
本研究纳入的患者例数较少,并且缺乏长期随访,故存在一定的不足,期待今后能够扩大样本量进行更深入的研究。

