胸膜结核瘤常规超声及超声造影的表现特征研究
丛阳 张怡 毕珂 沈梦君 朱惠铭 陈宏伟 王茵
胸膜结核瘤是肺结核病程中局部胸膜发生纤维结缔组织增生、粘连和干酪样坏死,最后被吸收浓缩而成的纤维包裹样干酪性团块[1]。与肺部病变不同,胸膜结核瘤的超声检查不受肺部气体干扰,图像更易获取,操作更为简便,应用与推广也较为容易。但常规超声对干酪样坏死检出率不高,对微血流的显示能力欠佳,具有一定的局限性。超声造影以其实时动态显示微血流灌注的特点被应用于多种疾病的诊断,现已逐步应用于胸膜、肺部病灶的诊断及介入操作[2]。为提高对胸膜结核瘤超声声像图方面的认识,现对同济大学附属上海市肺科医院确诊的胸膜结核瘤患者的超声检查资料进行回顾性分析。
资料和方法
一、资料收集
1. 研究对象:选择2018年1—12月同济大学附属上海市肺科医院结核科收治并确诊的49例胸膜结核瘤患者。
2. 实验室及病理判读结核病的标准:实验室标本抗酸杆菌涂片阳性、结核分枝杆菌培养检查及TB-PCR阳性、GeneXpert MTB/RIF检测阳性;活检组织标本病理检查呈现肺结核病理特征(肉芽肿、干酪样坏死,以及抗酸染色阳性或检出结核分枝杆菌基因片段),以上任一结果阳性即可诊断为结核病。
3. 纳入标准:患者需同时满足(1)~(3)中的每一项。(1)胸部CT扫描或超声检查显示紧贴胸壁突向肺野的软组织肿块影;(2)留有完整的常规超声及超声造影资料;(3)病灶行经皮穿刺活检组织标本或手术切除标本的检查结果提示为结核性病变。
4. 排除标准:(1)对超声对比剂过敏或有较高过敏的可能性;(2)病灶体表投影部位有皮疹、炎症、肿瘤及外伤等;(3)高龄、妊娠,存在严重的心、肝、肾疾病或全身性疾病,以及凝血功能障碍等穿刺活检禁忌证。
5. 基本情况:共49例患者的49个病灶纳入本研究,多发病灶选取最大者观察。其中,男25例,女24例;年龄17~79岁,平均年龄(33.16±15.77)岁,以18~65岁年龄段为主。病灶位于左侧者18例,右侧者31例;35例患者曾有结核性胸膜炎病史;单发胸膜结核瘤38例,多发11例,多数位于右侧胸腔(63.27%,31/49)。见表1。
6. 伦理审查:本研究已通过本院医学伦理委员会审查,编号为K18-144。本组患者检查前均签署知情同意书。
二、仪器和方法
1. 仪器:LOGIQ E9超声诊断仪(美国GE公司),凸阵探头,频率1~6 MHz。配有低机械指数谐波造影成像功能和时间-强度曲线分析软件。
2. 操作方法:在常规超声模式下记录病灶形态、纵横径值、边缘情况、血流分布、有无肺滑动征及钙化等特点,然后行超声造影检查,设置机械指数为0.10,造影增益为20 dB,经肘静脉团注超声对比剂SonoVue(意大利博莱克公司;国药准字J20030117)1.5 ml,即刻使用5 ml生理盐水推注冲管,动态存储图像3 min。

表1 49例胸膜结核瘤患者的一般情况
注a:年龄段分组参照2018年世界卫生组织(WHO)的年龄分组;b:其中包含病灶部位位于双侧者11例
3.图像分析:逐帧分析造影图像,选择病灶内增强特征明显区域、周围正常肺组织及胸壁组织作为感兴趣区,绘制时间-强度曲线获取超声造影定量指标。以上操作由2名具有5年以上工作经验的超声医师完成。
病灶超声造影定性指标:(1)增强模式:包括外周到中心、中心或局部到整体的增强;(2)增强强度:分为低增强、等增强、高增强(与周围正常肺组织增强强度相比);(3)增强形态:包括枯枝状增强(规则或扭曲的线条状增强,形似枯枝)、环状增强(仅病灶外周增强,中心无增强,形似环形或半环形),团块样增强(对比剂分布不均匀,聚集成团)、多中心增强(对比剂呈多中心星点状增强);(4)增强均匀程度:分为均匀、不均匀;(5)有无坏死区及面积大小:无坏死、小面积坏死(无增强区面积<50%)、大面积坏死(无增强区面积>50%)。
超声造影定量指标:(1)病灶开始增强时间:从注入对比剂到病灶开始增强的时间;(2)达峰时间:从对比剂注入到感兴趣区强度达到峰值的时间;(3)曲线下面积:即时间-强度曲线下面积,通过仪器自带的分析软件获得,曲线横坐标为时间(s)、纵坐标为强度(dB),记录了感兴趣区内增强强度随时间变化的过程。
三、统计学处理
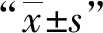
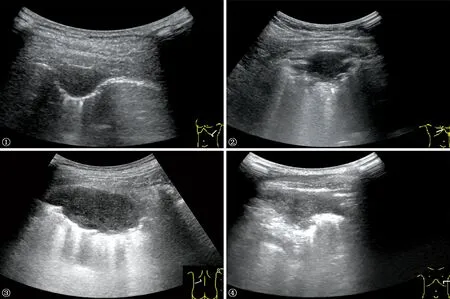
图1 患者,女,43岁。常规超声检查显示胸膜结核瘤呈“D”字形 图2 患者,女,47岁。常规超声检查显示胸膜结核瘤呈不规则形 图3 患者,女,24岁。常规超声检查显示胸膜结核瘤呈类圆形 图4 患者,男,27岁。常规超声检查显示胸膜结核瘤呈不规则形
结 果
一、常规超声表现
本组结核性胸膜瘤表现为以下几种形态:胸膜向肺部凸起的“D”字形、类圆形、不规则形(图1~4),其中以“D”字形居多(71.43%);病灶与胸膜多呈宽基底相交且胸膜增厚,边缘多较光整,多数有肺滑动征(61.22%);病灶横径均值为(35.23±15.27) mm,病灶纵径均值为(23.32±7.33) mm;病灶内可见钙化者占14.29%;病灶内血流多数较稀少(67.35%)。见表2。

表2 胸膜结核瘤常规超声表现
续表2
二、超声造影定性和定量参数
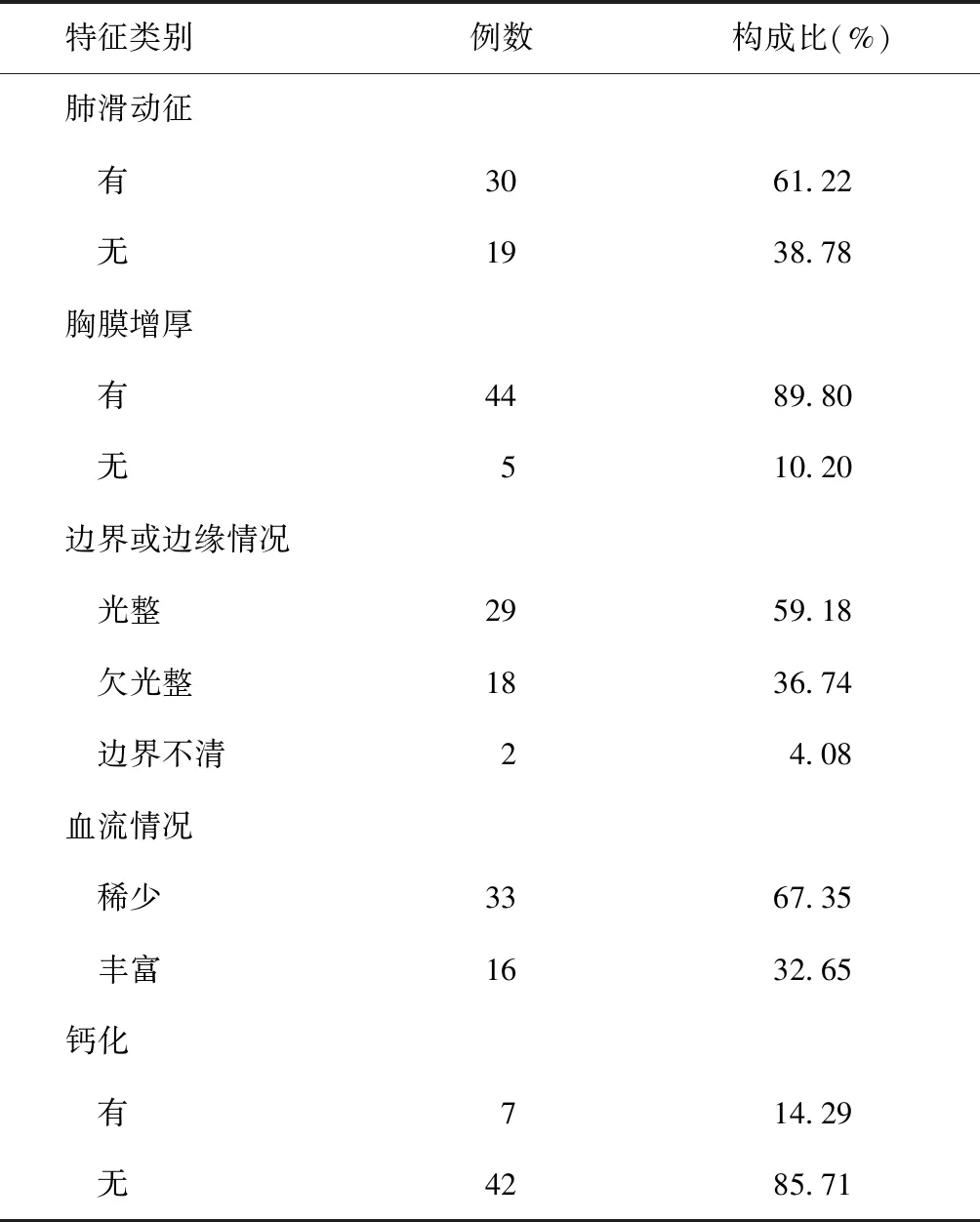
(1)增强模式:由外周向中心灌注占91.84%(45/49),由中心或局部向整体灌注占8.16%(4/49)。(2)增强强度:大多数病灶(93.88%,46/49)呈高增强,部分(4.08%,2/49)呈等增强,少数(2.04%,1/49)呈低增强。(3)增强形态:枯枝状增强占32.65%(16/49),环状增强占30.61%(15/49),团块样增强占22.45%(11/49),多中心增强占14.29%(7/49)。见图5~8。(4)增强均匀程度:达峰时仅少数病灶(18.37%,9/49)呈均匀增强,其余(81.63%,40/49)呈不均匀增强。(5)有无坏死区及面积大小:24.49%(12/49)的病灶无坏死,75.51%(37/49)的病灶可见坏死区(无对比剂充填),其中小面积坏死者32例(65.31%,32/49),大面积坏死者5例(10.20%,5/49)。见图9~12。(6)超声定量参数:分别绘制病灶、正常肺组织、胸壁组织感兴趣时间-强度曲线,并对各项指标进行总体和多重比较,发现病灶开始增强时间、达峰时间、曲线下面积更接近胸壁组织的数值(图13)。其中病灶与正常肺组织的上述定量参数差异均有统计学意义,与胸壁组织的上述定量参数差异均无统计学意义;而正常肺组织与胸壁组织的上述定量参数差异均有统计学意义。见表3。
讨 论
胸膜结核瘤是结核性胸膜炎发生、发展及转归的重要过程之一,该病的成因机制尚未完全清楚,临床易与肺结核球、肺内肿瘤及胸膜间皮瘤等相混淆。本研究有结核性胸膜炎病史者35例(71.43%),且有23例病理证实为结核样改变,可能与结核性胸膜炎发展转归相似[1]。本研究患者发病年龄以18~65岁为主,约占89.80%,与结核病的发病年龄较为一致;病灶多为单发,且多位于右侧胸腔,亦与文献报道一致[3-7]。得益于影像学新技术的发展,辅助检查手段的不断提高,近10余年来关于胸膜结核瘤患者的报道明显增多[8-10]。其中,超声检查用于胸肺部的研究也日益增多,超声检查显示胸膜病变具有独特的优势,可实时动态显示胸膜的运动情况,且胸膜的病灶相对于肺内病灶不易受气体和肋骨遮挡。胸膜的超声检查已被公认为一种有价值的诊断方法,特别是在胸腔积液和胸膜实质性病灶的诊断中[11-12]。
图5 患者,男,17岁。右侧图片为超声造影,显示增强形态为环形;左侧图片为对应的灰阶超声扫描,病灶呈类圆形、均匀低回声区,边界清晰 图6 患者,男,25岁。右侧图片为超声造影,显示增强形态为枯枝样;左侧图片为对应的灰阶超声扫描,病灶呈形态不规则的混合回声区,边界尚清晰 图7 患者,男,78岁。右侧图片为超声造影,显示增强形态为团块样增强;左侧图片为对应的灰阶超声扫描,病灶呈D字形混合回声,边界清晰 图8 患者,女,46岁。右侧图片为超声造影,显示增强形态为多中心样增强;左侧图片为对应的灰阶超声扫描,病灶呈D字形均匀低回声
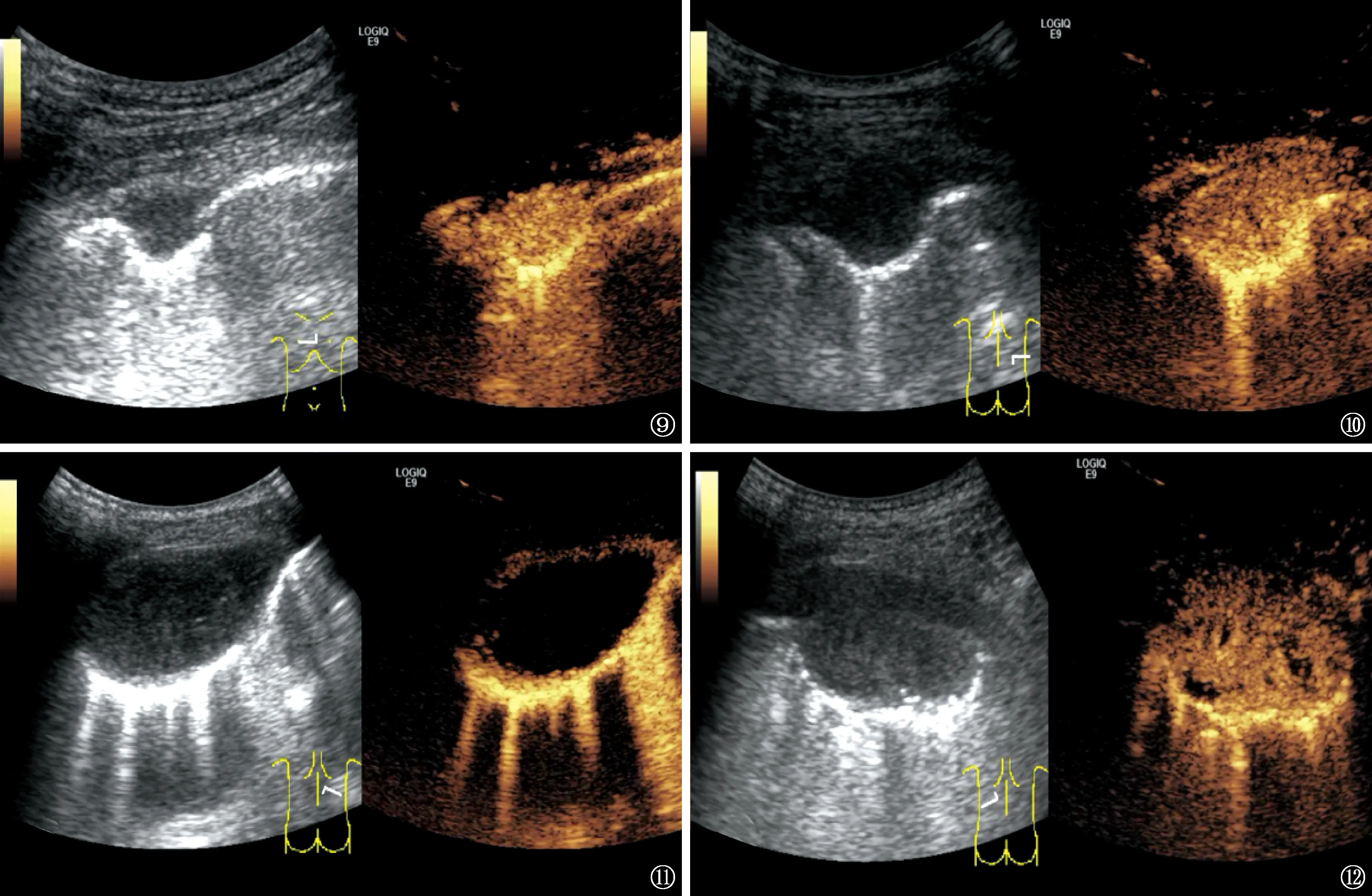
图9 患者,女,47岁。右侧图片为超声造影,显示病灶呈均匀高增强无坏死区;左侧图片为对应的灰阶超声扫描,病灶表现为低回声D字形,边界清晰 图10 患者,男,32岁。右侧图片为超声造影,病灶呈均匀等增强无坏死区;左侧图片为对应的灰阶超声扫描,病灶表现为低回声D字形,边界清晰 图11 患者,男,21岁。右侧图片为超声造影,病灶呈环形增强,内见大面积坏死区;左侧图片为对应的灰阶超声扫描,病灶表现为类圆形低回声,边界清晰 图12 患者,女,24岁。右侧图片为超声造影,显示病灶呈不均匀增强,内可见小面积坏死区;左侧图片为对应的灰阶超声模式,病灶表现为类圆形低回声区,边界清晰
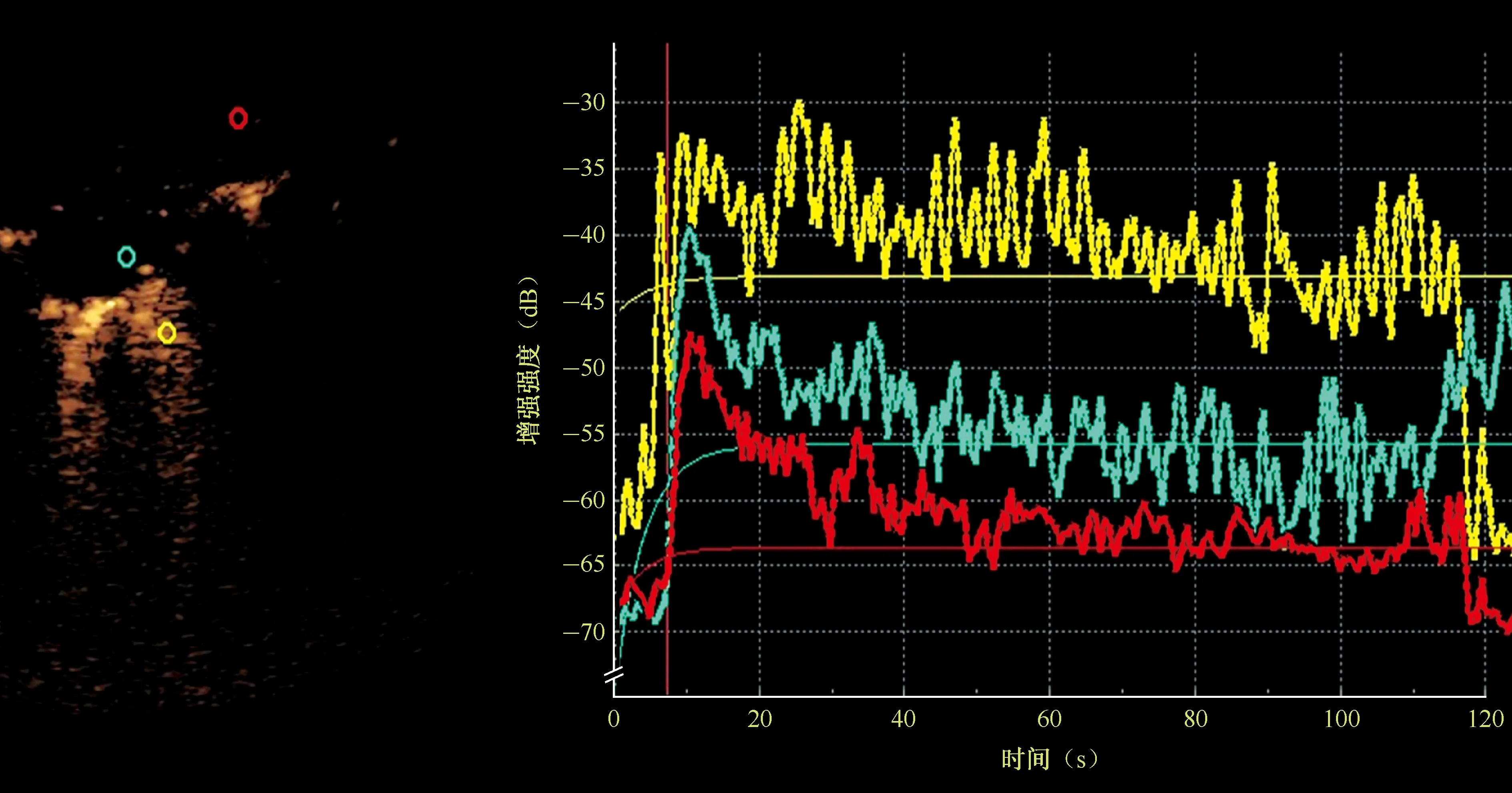
图13 患者,男,17岁。超声造影时间-强度曲线图,图中左侧黄色标识为正常肺组织感兴趣区取点位置,绿色为病灶感兴趣区取点位置,红色为胸壁组织感兴趣区取点位置;右侧为病灶(绿色)、肺(黄色)、胸壁(红色)的时间-强度曲线,可以看出病灶区域和胸膜区域的曲线形态较为接近
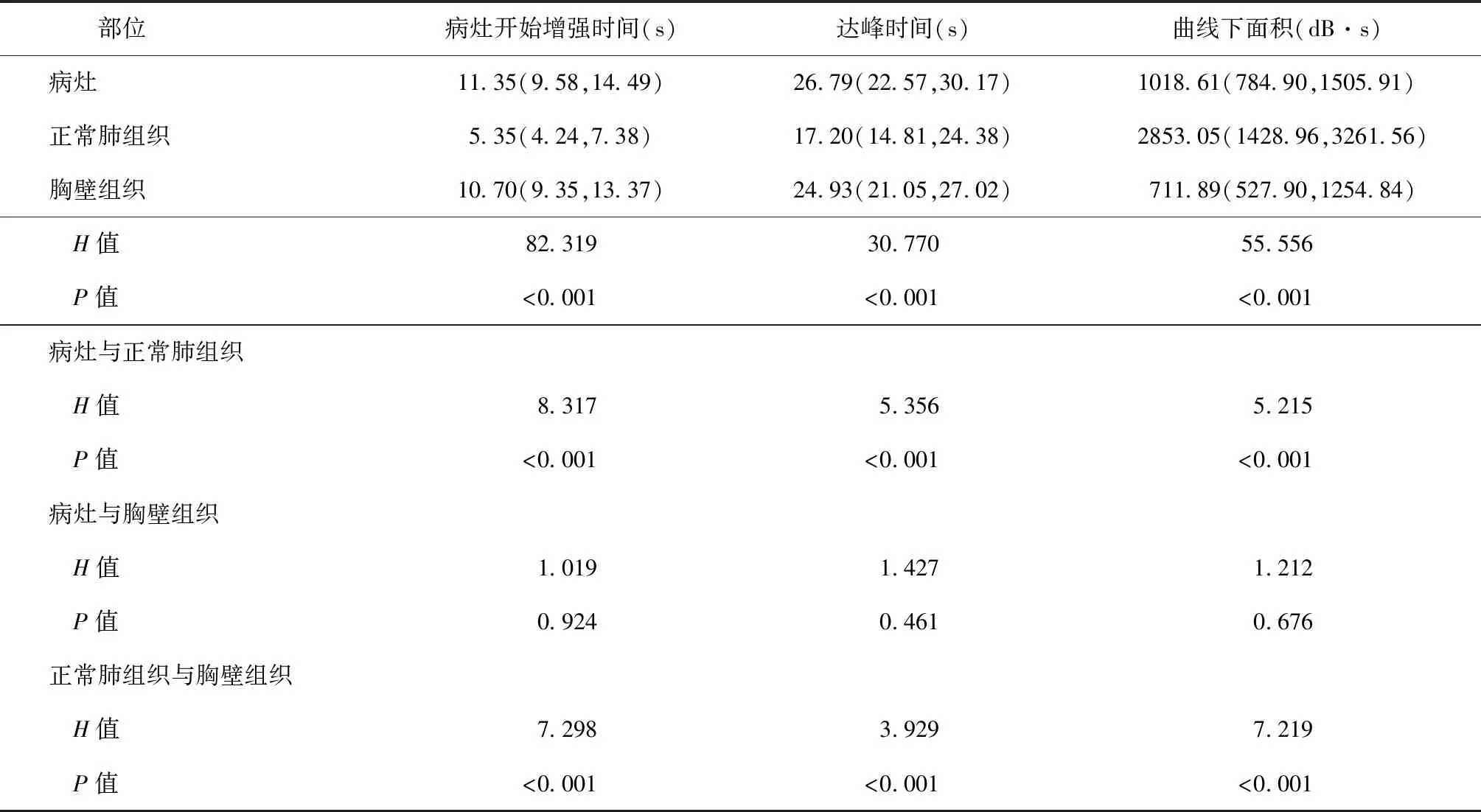
部位病灶开始增强时间(s)达峰时间(s)曲线下面积(dB·s)病灶11.35(9.58,14.49)26.79(22.57,30.17)1018.61(784.90,1505.91)正常肺组织5.35(4.24,7.38)17.20(14.81,24.38)2853.05(1428.96,3261.56)胸壁组织10.70(9.35,13.37)24.93(21.05,27.02)711.89(527.90,1254.84) H值82.319 30.77055.556 P值<0.001 <0.001 <0.001病灶与正常肺组织 H值8.317 5.356 5.215 P值<0.001 <0.001<0.001病灶与胸壁组织 H值1.019 1.427 1.212 P值0.924 0.461 0.676正常肺组织与胸壁组织 H值7.298 3.929 7.219 P值<0.001 <0.001<0.001
注使用Kruskal-WallisH检验对总体进行比较,并在各组间进行两两比较
本研究发现胸膜结核瘤的常规超声表现与CT表现具有一致性[13],即自胸膜向肺部凸起,呈“D”字形、类圆形或不规则形,与胸膜多呈宽基底相交且胸膜增厚,边缘多较光整。同时超声检查相比于CT检查,具有可以实时动态观察局部病灶的优势,本研究显示病灶大多可见壁层胸膜病灶与肺实质间的肺滑动征(61.22%),笔者通过对胸膜病变进行超声检查,发现“肺滑动征”可以直接提示病灶来源于胸膜而非肺脏。这也是肺部病灶和胸膜病灶的一个重要鉴别要点,肺部病灶可随呼吸而滑动,而胸膜病灶未见该现象。
随着超声对比剂的广泛应用及蓬勃发展,超声造影检查已成为一种行之有效、能对病灶的良恶性进行鉴别的诊断技术。有学者运用超声造影技术对胸膜病变进行研究分析,发现增强强度和增强时间等参数有较高的诊断价值,并且超声的对比剂为血池显像剂,能准确反映病灶内部的微循环血流灌注情况,有助于区别病灶内的坏死区域[11, 14-15]。本研究超声造影定量指标中病灶开始增强时间、达峰时间、曲线下面积与正常肺组织比较差异均有统计学意义,而病灶与胸壁组织的上述定量参数差异均无统计学意义,可以认为胸膜结核瘤的血供来源与胸壁组织一致而与正常肺组织不同。 这与病灶的解剖特点密切相关,本研究观察的胸膜结核瘤均起源于壁层胸膜的肋胸膜部分,血供来源与肋间动脉(体循环)和胸壁软组织一致,而正常肺组织的血供来源于肺动脉(肺循环),两者具有根本差异。故可应用超声造影定量指标区分病灶的血供来源,进而确定其是否起源于壁层胸膜,为胸膜结核瘤的诊断提供证据。
本研究发现胸膜结核瘤超声造影后多数呈高增强(93.88%),由外向中心灌注(91.84%),不均匀增强(81.63%),多数可见坏死区(75.51%),且多为小面积坏死(65.31%)。这与曹兵生等[16]对于周围性肺结核瘤的超声造影表现具有一致性。曹兵生等[16]认为周围性肺结核瘤的超声造影多表现为环形增强、不均匀增强和均匀增强,不同的增强表现可能与结核瘤不同的病理病程有关,环形增强是成熟结核瘤的典型表现。笔者研究发现胸膜结核瘤以环状和枯枝状增强形态多见,认为周围性肺结核瘤和胸膜结核瘤均有较长病史,后期病理过程相似,均呈现纤维组织包裹的干酪样球形或团块状病灶,进而在超声造影上表现有一定的一致性,另外临床上有将胸膜结核瘤分为单纯型胸膜结核瘤和复合型胸膜结核瘤的方法,前者指仅限于胸膜的病变,后者为肺与胸膜共患结核瘤。本研究发现有病灶呈现上下同时灌注的模式,可能与此病程发展相关,其胸膜和肺上的结核病灶相互浸润。
超声造影检查可以指导介入穿刺活检的操作:病灶在对比剂团注后增强,说明此区域为实质性部分;病灶区域无增强(无对比剂充填),说明该区域为液化坏死区,进而可以指导超声介入医师准确选择穿刺区域进行穿刺活检操作。另外,超声造影可实时动态观察病灶准确的范围、部位、病灶内血流情况,从而进行胸膜结核瘤的消融指导,且消融不完全时即刻进行补充消融,最终达到完全消融[17]。
本研究存在不足之处为样本量相对较少,对超声造影曲线的定量指标没有进一步分析,以及没有与相关疾病进行对照研究,有待于以后进一步做多中心、大样本的深入研究。
综上所述,常规超声及超声造影可以反映胸膜结核瘤的形态结构及血流微灌注状况,为临床诊断提供一定的参考。通过超声造影发现坏死区,选择病灶内增强区作为活检部位,使得获取病变组织更有效、更直观。

