经典Wnt/β-catenin/TCF7L2信号通路在1型糖尿病心肌病中的作用
邱晓霞,李逸朗,梁关凤,张贵平,罗健东,袁文常,侯 宁
(1. 广州医科大学药学院药理学教研室,广东 广州 511436;2. 广州医科大学附属第五医院检验科,广东 广州 510000)
随着人民生活水平的不断提高,我国糖尿病患者迅速增多,至2016年,糖尿病的全年患病率从3.7%上升到6.6%,并且所有年龄段的糖尿病和糖尿病相关的死亡率分别增加了63.5%和33.3%,糖尿病对于我国人民的威胁已到了不可忽视的地步[1]。糖尿病性心肌病(diabetic cardiomyopathy,DCM)是糖尿病性心脏病的特异性病变,是独立于高血压、冠状动脉疾病的常见糖尿病并发症,其发病机制非常复杂,迄今为止的研究和报道仍未完全阐明。因此,阐明DCM的发病机制,建立有效的治疗方法和手段具有十分重要的意义。
经典的Wnt/β-catenin信号通路作为一条保守的信号传导通路,广泛存在于各生物体中,参与调控细胞增殖、迁移、分化等细胞发育过程[2]。该信号通路的异常调节与各种心脏疾病状况有关,在心脏发育、心肌肥厚、心力衰竭等生理和病理生理进程中起重要作用[3]。TCF7L2作为T细胞因子/淋巴细胞增强子结合因子(T cell factor/lymphocyte enhancer factor,TCF/LEF)家族成员,是经典Wnt/β-catenin信号通路的下游核转录因子之一,参与细胞增殖、分化的调节[4-5]。近来研究发现,TCF7L2基因多态性与糖尿病存在明显关联。TCF7L2参与调节胰岛β细胞分泌功能、细胞增殖与凋亡[6-7];并能调控肝脏糖、脂代谢基因的表达,参与能量代谢稳态调节;特异性敲除肝脏TCF7L2能提高胰岛素敏感性,改善糖耐量,降低肝糖合成[8]。此外,在β-catenin的作用下,TCF7L2与LEF共同调节胰高血糖素原基因的表达,以及胰高血糖素样肽-1(glucagon like peptid-1,GLP-1)的分泌,从而调节机体血糖稳态。但是在糖尿病心脏中,β-catenin/TCF7L2通路的具体作用,目前尚不完全清楚。因此,本研究以C57BL/6小鼠为主要对象,通过腹腔注射链脲佐菌素(streptozocin,STZ)建立1型糖尿病(diabetic mellitus,DM)模型, 明确β-catenin/TCF7L2通路对心肌肥大标志基因心房钠尿肽前体A基因(natriuretic peptide precursor A,Nppa)以及DCM发生、发展中的作用及机制。
1 材料
1.1 实验动物SPF级C57BL/6 ♂小鼠,7~8周龄,体质量(20±4) g,由广州中医药大学实验动物中心提供,生产许可证:SCXK(粤)2013-0034。饲养环境模拟自然昼夜条件,温度(22±3)℃,湿度40%~45%,自由饮水。
1.2 药物与试剂β-catenin转录抑制剂14(inhibitors of β-catenin responsive transcription 14,iCRT14)(MCE公司,批号677331-12-3);STZ(Sigma公司);RIPA裂解液(Cell Signaling Technology公司);蛋白酶与磷酸酶抑制剂(Selleck公司);TCF7L2、β-catenin、活化的β-catenin、GAPDH抗体(Cell Signaling Technology公司);TRIzol(Ambion公司); BCA蛋白试剂盒(Thermo Fisher公司)。
1.3 仪器MDF-381AT型-70 ℃低温冰箱(日本三洋);电子血糖仪(美国SD BIOSENSOR);低温高速离心机(德国Hettich);StepOnePlus Real-Time PCR仪(Applied Biosystems公司);凝胶电泳仪、电泳槽(Bio-Rad公司)。
2 方法
2.1 动物造模与分组7~8周龄C57BL/6小鼠腹腔注射用柠檬酸缓冲液配好的STZ 45 mg·kg-1·d-1,连续注射6 d。正常组给予等量的柠檬酸缓冲液。注射结束3 d后,测量小鼠随机血糖,血糖浓度高于1.67×10-2mol·L-1的小鼠视为造模成功。DM成模4周后,将血糖稳定的小鼠随机分,4组:正常对照组(control,CON)、糖尿病模型组(DM)、iCRT14低、高浓度组(2.5、5.0 mg·kg-1),每组8~10只小鼠。隔天腹腔注射药物1次,连续给药8周。给药期间,正常饮食,自由饮水。
2.2 HE染色各组小鼠麻醉后,摘取心脏,并用PBS洗净残留血液,用4%多聚甲醛浸泡24 h后,脱水浸蜡,制作石蜡切片,切片用苏木精和伊红染色,光镜显微镜下观察分析心肌组织病理学变化。
2.3 免疫组化检测TCF7L2和β-catenin蛋白在细胞中的分布将石蜡切片脱蜡至水后,用柠檬酸抗原修复缓冲液修复抗原。3% BSA均匀覆盖组织,室温封闭30 min,加入一抗4 ℃孵育过夜,同属性二抗室温孵育50 min,DAB显色、苏木精复染细胞核后,脱水封片。
2.4 Western blot检测TCF7L2和β-catenin蛋白表达取各组小鼠左心组织,制备组织匀浆,每20 mg组织加入100~200 μL RIPA裂解液,冰上研磨棒研磨20 s,3次,涡旋匀浆30 s,冰上静置5 min,重复3次,4 ℃、14 000×g离心30 min,取上清,BCA蛋白浓度测定试剂盒测定总蛋白浓度。20~50 μg总蛋白上样量,以浓度为10%的凝胶电泳进行分离,湿法转膜。5%的脱脂奶粉封闭1 h后,与相应一抗4 ℃孵育过夜,0.1% PBS-T溶液洗涤,同属性二抗共孵育,增强型化学发光试剂进行显色,利用灰度分析软件定量分析。
2.5 qPCR检测β-catenin、Tcf7l2、Nppa和c-Myc mRNA表达取各组左心室组织50 mg,均匀粉碎后,按TRIzol提取程序说明书提取组织RNA; 在260 nm吸光值下定量RNA,按TaKaRa逆转录试剂盒操作说明,分两步在42 ℃ 2 min,37 ℃ 15 min,85 ℃ 5 s进行逆转录为cDNA。使用TaKaRa SYBR试剂盒在qPCR仪器上以95 ℃ 1 s、60 ℃ 20 s进行扩增,读取最后扩增数值。引物序列见Tab 1。
2.6 统计学处理采用SPSS 16.0统计软件进行分析,多组间的比较采用单因素方差分析(one-way ANOVA)。
3 结果
3.1 心肌组织结构改变Fig 1的HE染色结果显示,CON组心肌细胞排列整齐,形态清晰;DM组心肌细胞排列紊乱,细胞结构模糊、表面积增大;与DM组相比,iCRT14组随药物剂量增加,细胞排列较整齐,形态逐渐均匀,逐渐趋向于正常细胞。
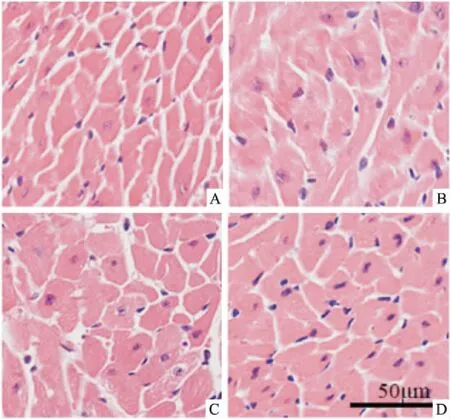
Fig 1 Morphological characteristics of diabeticcardiomyopathy by HE staining(×400)
A:CON;B:DM;C:DM+iCRT14(2.5 mg·kg-1);D:DM+iCRT14(5 mg·kg-1)
3.2 TCF7L2和β-catenin蛋白在心肌中的分布如Fig 2所示,正常组中β-catenin主要分布在心肌细胞连接的闰盘处,TCF7L2则散落分布在少数的心肌细胞核内。DM组中,β-catenin在闰盘和心肌细胞核内均见明显表达,且核内表达明显增多,提示DM时β-catenin入核增多;DM组心肌细胞核中TCF7L2表达明显增多,与β-catenin趋势一致。与DM组对比,给予iCRT14后,心肌细胞核内β-cate-nin表达减少,主要分布在闰盘和细胞质内,细胞核内TCF7L2表达也随之减少。提示1型DM时,TCF7L2和β-catenin在心肌细胞核内表达增多,给予iCRT14能明显抑制两者在细胞核内的表达和结合。


Fig 2 Expression and distribution of TCF7L2 and β-catenin in hearts by immunohistochemistry(×400)
3.3 TCF7L2和β-catenin蛋白表达情况如Fig 3所示,与CON组对比,DM组活化β-catenin、总β-catenin、TCF7L2蛋白表达均明显增多;给予iCRT14能抑制β-catenin、TCF7L2蛋白的表达。该结果与免疫组化结果一致,提示1型DM心脏中β-catenin/TCF7L2信号通路活化,iCRT14能抑制β-catenin入核与TCF7L2结合,同时可抑制TCF7L2蛋白表达。
3.4 Tcf7l2、β-catenin、c-Myc、Nppa mRNA表达变化如Fig 4所示,与CON组相比,DM组Tcf7l2、c-Myc、Nppa mRNA表达上升,给予iCRT14后上述基因的mRNA水平下降,而β-catenin mRNA水平在DM组和iCRT14组有增加和减少的趋势,但差异无统计学意义。
4 讨论
DCM主要表现为心室舒张和收缩功能降低、心肌肥厚、心肌间质纤维化等[9]。深入研究并阐明DCM的分子机制并找出早期的干预靶点,对建立更有效的糖尿病心血管并发症治疗方法具有十分重要的意义。
β-catenin作为经典Wnt通路的核心调控因子,在Wnt信号通路未被激活时,β-catenin在胞质内与腺瘤性结肠息肉病基因蛋白(adenomatous polyposis coli,APC)、轴蛋白(Axin)、糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)、酪蛋白激酶1(casein kinase 1,CK1)等,形成“β-catenin降解复合物”,促进β-catenin进入蛋白酶体降解途径,使胞质内游离β-catenin维持在较低水平。Wnt通路激活后,促进β-catenin自降解复合物解离,减少蛋白酶体降解,使胞质内游离β-catenin稳定积累并进入细胞核内,由于β-catenin不含有DNA结合域,故当其进入细胞核后,需要与核内TCF7L2及其它TCF转录因子相互作用,形成转录激活复合物,激活下游靶基因转录。

Fig 3 Expression of β-catenin and TCF7L2 in
##P<0.01vsCON;**P<0.01vsDM

Fig 4 β-catenin, Tcf7l2, c-Myc and Nppa mRNAexpressions in myocardial tissue of
#P<0.05,##P<0.01vsCON;*P<0.05,**P<0.01vsDM
研究表明,β-catenin在维持血浆葡萄糖的稳态中起着重要的作用。β-catenin转移至细胞核中,与LEF/TCF7L2结合形成异二聚体,激活胰高血糖素原基因等在内的大量基因发生转录,胰高血糖素原基因转录后,经不同的组织特异性加工,在胰岛α细胞表达产生胰高血糖素,使小肠L细胞表达产生胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)和胰高血糖素样肽-2(glucagon-like peptide 2,GLP-2)。其中,由小肠L细胞分泌的GLP-1不仅能刺激胰岛素合成与分泌,抑制胰高血糖素释放,增加外周胰岛素敏感性,还能通过抑制胃排空、增加机体饱胀感来降低血糖[10]。以往的研究显示,DM时高糖可通过激活β-catenin,加剧糖尿病视网膜病[11]。在肾脏中,高糖激活的β-catenin加速糖尿病肾病的病理生理进程[12]。国内也有研究发现,β-catenin的激活参与早期DM心肌损伤[13]。β-catenin/TCFL2信号通路在DCM中扮演何种角色,目前尚不清楚,亟待深入研究。因此,本课题通过建立1型DM小鼠模型,观察持续高血糖状态对心脏β-catenin/TCFL2信号通路的影响。结果发现,12周DM组心肌细胞排列紊乱,表面积增大,心肌肥大标志基因Nppa mRNA表达上调,呈现DCM的病理特征。免疫组化和Western blot结果显示,12周DM组心肌中β-catenin表达明显上调,且入核增多;TCF7L2蛋白表达也随之升高。随后,利用qPCR检测β-catenin/TCFL2通路的经典下游靶基因c-Myc表达。c-Myc是一种常见的原癌基因,主要通过参与细胞周期的调控,促进细胞增殖。已有研究显示,c-Myc过度表达能诱导心肌肥厚。课题组前期研究证实,c-Myc在心力衰竭的人类样本和转基因动物心脏中均表达增高,β-catenin/TCFL2信号通路通过上调c-Myc表达,参与心力衰竭的病程发展[14]。本研究qPCR结果显示,c-Myc mRNA表达在DM组的心脏中也明显增高。上述一系列结果提示,持续的高糖环境能激活心脏Wnt/β-catenin/TCFL2信号通路。
为进一步明确Wnt/β-catenin/TCFL2信号通路活化在DCM中的作用,我们选择新型β-catenin通路抑制剂iCRT14(Thiazolidinedione)处理DM组。iCRT14是最近报道的一种抑制β-catenin/TCF7L2结合的小分子化合物,能抑制β-catenin和TCF7L2的结合,同时还可干扰TCF家族与DNA的结合,抑制下游基因转录[15]。有体内外研究显示,iCRT14通过抑制Wnt/β-catenin信号转导,抑制乳腺癌和前列腺癌细胞增殖。本研究连续给予DM组腹腔注射iCRT14 8周,HE染色结果显示,iCRT14组心肌结构明显改善,细胞排列逐渐整齐,形态均匀,细胞核大小一致。免疫组化和Western blot结果显示,给予iCRT14后,β-catenin核内表达减少,TCF7L2表达降低。qPCR结果显示,c-Myc、Nppa mRNA表达均明显下降,接近CON组。该研究结果表明,iCRT14能阻断β-catenin/TCF7L2结合,抑制该信号通路的活性;同时提示,抑制Wnt/β-catenin/TCF7L2通路能明显改善DCM的病理表征。
综上所述,本课题研究发现,持续的血糖升高能激活心脏Wnt/β-catenin/TCF7L2信号通路,该通路的活化参与DCM的病理生理进程。在后续研究中我们将进一步在细胞水平,探索Wnt/β-catenin/TCF7L2信号通路在DM心肌重构中的具体作用和分子机制,为探索DCM治疗的新靶点提供实验依据。