注射用核糖核酸Ⅱ通过活性氧介导的PI3K/Akt信号通路诱导人白血病细胞KG1a凋亡
郭 珮,李 静,冉建华,陈地龙,4,何 菲,吕晓婷,石雪萍,李海星
(1. 重庆医科大学基础医学院组织细胞工程与干细胞研究室,重庆 400016;2. 重庆市第六人民医院/重庆市职业病防治院药学部,重庆 400060;3. 重庆医科大学基础医学院解剖学教研室,重庆 400016;4. 重庆三峡医药高等专科学校,重庆 404120)
注射用核糖核酸Ⅱ(商品名BP素)具有抗肿瘤和提高免疫功能的作用,是从牛胰腺提取的高纯度、具有生物活性的核糖核酸[1]。前期研究发现,注射用核糖核酸Ⅱ可通过上调p53、调控Bcl-2/Bax的表达、激活caspase-3来诱导人急性骨髓白血病细胞株KG1a细胞凋亡,但未深入探讨p53上、下游的凋亡信号分子在其中的作用[2]。目前,临床上已有采用注射用核糖核酸Ⅱ治疗肝癌、乳腺癌、肺癌等肿瘤的报道,但对白血病的治疗和机制研究甚少[3]。
活性氧(reactive oxygen species,ROS)作为细胞内关键的信号分子,参与了细胞凋亡的启动和执行[4]。在调控细胞凋亡增殖的信号通路中,PI3K/Akt信号通路发挥重要作用,通过激活Akt及其下游靶点p53等,对促进细胞周期进展、增殖、生存和抗凋亡有重要作用[5]。在许多肿瘤细胞的凋亡过程中,ROS与PI3K/Akt信号通路密切相关,且ROS水平与Akt的活化息息相关[6]。本研究旨在研究注射用核糖核酸Ⅱ是否通过ROS介导的PI3K/Akt信号通路,诱导KG1a细胞凋亡,为注射用核糖核酸Ⅱ治疗白血病提供实验基础。
1 材料与方法
1.1 材料
1.1.1细胞株 人急性骨髓白血病细胞株KG1a,购自美国模式培养物集存库(American type culture collection,ATCC)。
1.1.2药品与试剂 注射用核糖核酸Ⅱ(规格50 mg),购自吉林敖东药业集团延吉股份有限公司;RPMI 1640培养基、胎牛血清,购自美国Gibco公司;N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)、BCA蛋白浓度测定试剂盒(增强型)、PMSF(100 nmol·L-1)、SDS-PAGE凝胶配制试剂盒、RIPA裂解液(强),购自碧云天生物技术有限公司;ROS检测试剂盒,以及β-actin、p-PI3K、p-Akt、p-MDM2、p21抗体,购自巴傲得生物科技有限公司;ECL显色剂,购自Milliproe公司;cyclin D1、周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)抗体,购自沈阳万类科技有限公司。
1.1.3仪器 CO2细胞培养箱(美国Forma Scientific公司);凝胶成像仪、电泳仪、ChemiDo-CTMTouch Image Syste 化学发光仪(美国Bio-Rad公司);倒置显微镜(日本Nikon公司);FACS-can型流式细胞仪(Becton Dickinson公司)。
1.2 方法
1.2.1细胞培养 人急性骨髓白血病KG1a细胞培养基体系是90% RPMI 1640培养基、10%胎牛血清和1%青霉素-链霉素溶液混合而成。细胞置于37 ℃、5% CO2孵箱培养,每隔24 h观察细胞状态,每隔2~3 d换液传代。
1.2.2药物的配制 注射用核糖核酸Ⅱ的配制:用500 μL高温消毒后的DEPC水与50 mg注射用核糖核酸Ⅱ粉末充分溶解,将终浓度为100 g·L-1的储存液放于-20 ℃储存。实验前用含10%胎牛血清的RPMI 1640培养基稀释到所需浓度。NAC的配制:称取0.163 19 g NAC,用1 mL PBS充分混匀,配制成1 mol·L-1NAC溶液,-20 ℃储存,实验前再用细胞培养液稀释至10 mmol·L-1备用。
1.2.3流式细胞术(flow cytometry,FCM)检测细胞周期 取培养的对数生长期KG1a细胞,细胞浓度调整为1×109·L-1,接种于6孔板。第一组实验分组:Control组常规培养;实验组在培养液中加入终浓度为100、150、200 mg·L-1的注射用核糖核酸Ⅱ。第二组实验分组:Control组:为常规培养;药物组:注射用核糖核酸Ⅱ浓度为150 mg·L-1;NAC对照组:用浓度为10 mmol的NAC溶液预处理细胞30 min,再给予浓度为150 mg·L-1的注射用核糖核酸Ⅱ。在37 ℃、5% CO2饱和湿度下继续培养24 h,收集各组细胞,用预冷pH 7.2的PBS液漂洗细胞2次,4 ℃、1 000×g离心5 min。弃上清,加70%乙醇固定过夜,送检。每组样本测定3×104个细胞,上流式细胞仪检测,然后采用CellQuest软件分析得出细胞凋亡周期,实验重复3次。
1.2.4FCM检测细胞内ROS 取10 μL DCFH-DA用PBS液稀释至10 mL,充分混匀避光备用。实验分组培养后,收集各组细胞,用预冷的PBS液漂洗2次,4 ℃、1 000×g离心5 min。阴性对照组不加稀释液;Control组和加药组培养均加入1 mL稀释液,孵育箱避光反应30 min,每5 min混匀1次至反应完全。最后用PBS洗涤4次,以除去细胞外荧光剂。用200 μL PBS重悬细胞,流式细胞仪分析荧光强度,收集数据,实验重复3次。
1.2.5Western blot检测 实验分组同“1.2.3”,加药分组培养后,收集各组细胞,用预冷的PBS漂洗细胞2次,4 ℃、1 000×g离心5 min。将细胞裂解液、1% PMSF冰上混匀,加100 μL至细胞中,置于冰上10 min,然后涡旋混匀,重复3次,4 ℃、12 000×g离心15 min,取上清液即为所提细胞总蛋白,BCA法检测各组蛋白浓度。按每孔50 μg上样,SDS-PAGE凝胶电泳,转膜,5% BSA溶液37 ℃封闭2 h,一抗孵育过夜(p-PI3K、p-Akt、p-MDM2、p21、cyclin D1、CDK4、p53均为1 ∶1 000稀释, β-actin为1 ∶10 000稀释),TBST洗膜3次,每次15 min,二抗(1 ∶10 000)37 ℃孵育30 min,TBST洗膜3次,每次15 min,ECL发光液孵育,曝光,使用配套软件检测各条带灰度值。

2 结果
2.1 注射用核糖核酸Ⅱ阻滞KG1a细胞在G0/G1期Fig 1的FCM结果显示,注射用核糖核酸Ⅱ(100、150、200 mg·L-1)作用KG1a细胞后,随药物浓度的增高,G0/G1期细胞比例增加,而G2/M期、S期比例则逐渐减少,差异具有统计学意义(P<0.05)。提示注射用核糖核酸Ⅱ抑制急性骨髓白血病KG1a细胞的增殖活性与其阻滞细胞周期有关。
2.2 注射用核糖核酸Ⅱ对KG1a胞内ROS的影响如Fig 2所示,注射用核糖核酸Ⅱ(100、150、200 mg·L-1)作用KG1a细胞后,KG1a细胞的荧光强度与对照组相比明显升高(P<0.05)。提示注射用核糖核酸Ⅱ作用KG1a细胞24 h后,以浓度依赖方式增加KG1a细胞内ROS含量。
2.3 注射用核糖核酸Ⅱ对PI3K/Akt信号通路相关蛋白的影响KG1a细胞经注射用核糖核酸Ⅱ(100、150、200 mg·L-1)诱导24 h后,提取细胞总蛋白进行电泳分析。Fig 3的Western blot结果显示,p-PI3K、p-Akt、p-MDM2、cyclin D1和CDK4蛋白表达水平随注射用核糖核酸Ⅱ浓度的增高而下调,而p21蛋白表达水平逐渐增高,与对照组相比,差异有统计学意义(P<0.05)。提示注射用核糖核酸Ⅱ可能通过调控PI3K/Akt信号通路,阻滞KG1a细胞在G0/G1期,诱导KG1a细胞凋亡。
2.4 NAC和注射用核糖核酸Ⅱ对KG1a细胞周期的影响为进一步研究ROS是否介导注射用核糖核酸Ⅱ对KG1a细胞周期的阻滞作用,用NAC和注射用核糖核酸Ⅱ作用之后,检测KG1a细胞周期的改变。如Fig 4所示,与单独使用注射用核糖核酸Ⅱ组相比,NAC组G0/G1期细胞比例减少,而G2/M期、S期比例则增加。NAC组和单独药物组G0/G1期比例分别为37.69%和46.11%,与对照组28.98%相比,差异具有统计学意义(P<0.05)。提示ROS介导了注射用核糖核酸Ⅱ阻滞KG1a细胞周期。
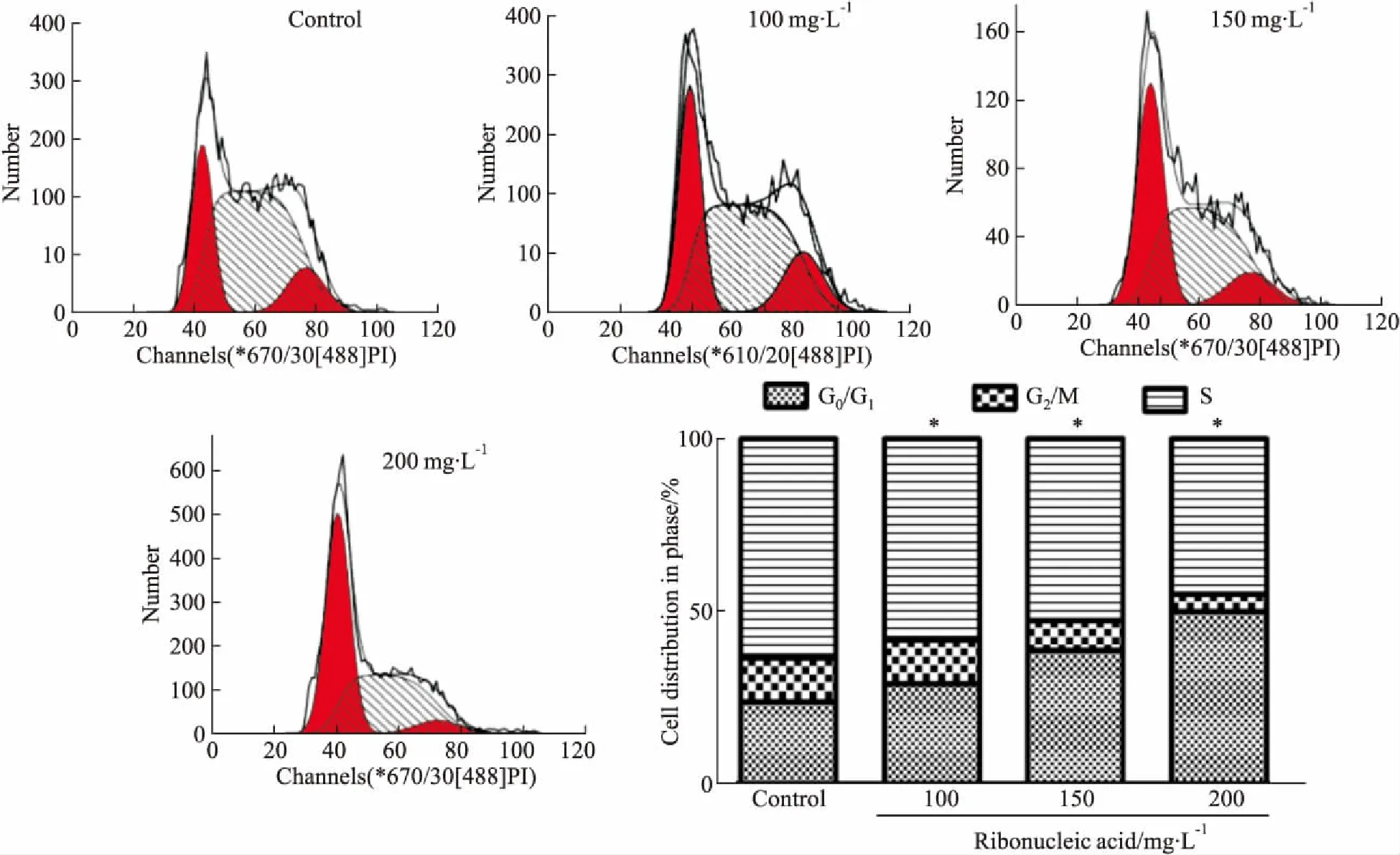
Fig 1 Effect of ribonucleic acid Ⅱ on cell cycle of KG1a
*P<0.05vscontrol

Fig 2 Inhibitory effect of ribonucleic acid Ⅱ on intracellular ROS in KG1a
*P<0.05vscontrol

Fig 3 Effect of ribonucleic acid Ⅱ on PI3K/Akt signaling pathway in KG1a *P<0.05 vs control
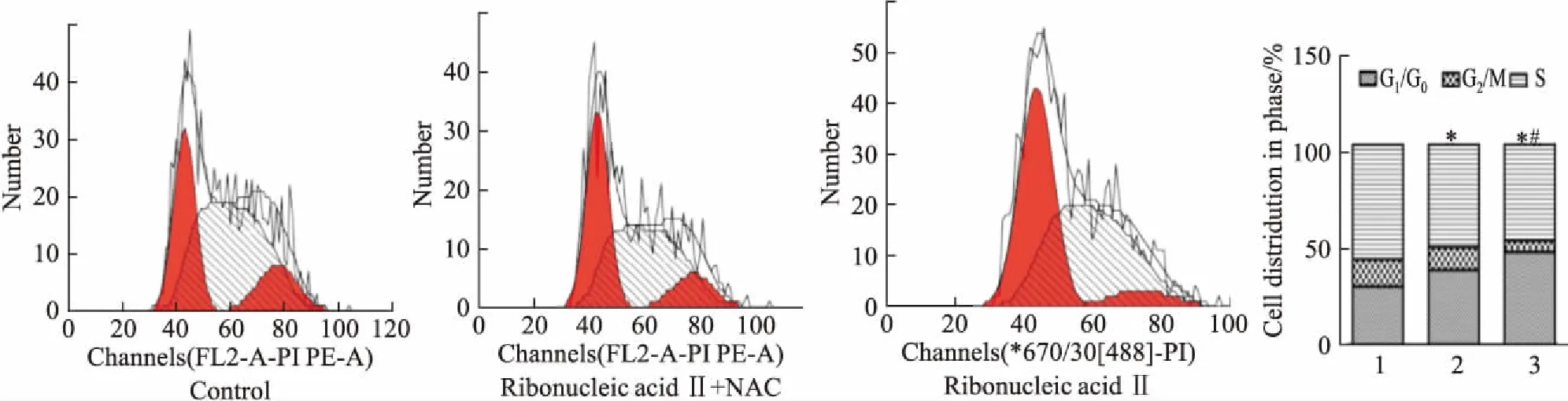
Fig 4 Effect of ribonucleic acid Ⅱ and NAC on cell cycle of KG1a
1:Control;2:Ribonucleic acid Ⅱ+NAC;3:Ribonucleic acid Ⅱ.*P<0.05vscontrol;#P<0.05vsribonucleic acid Ⅱ+NAC
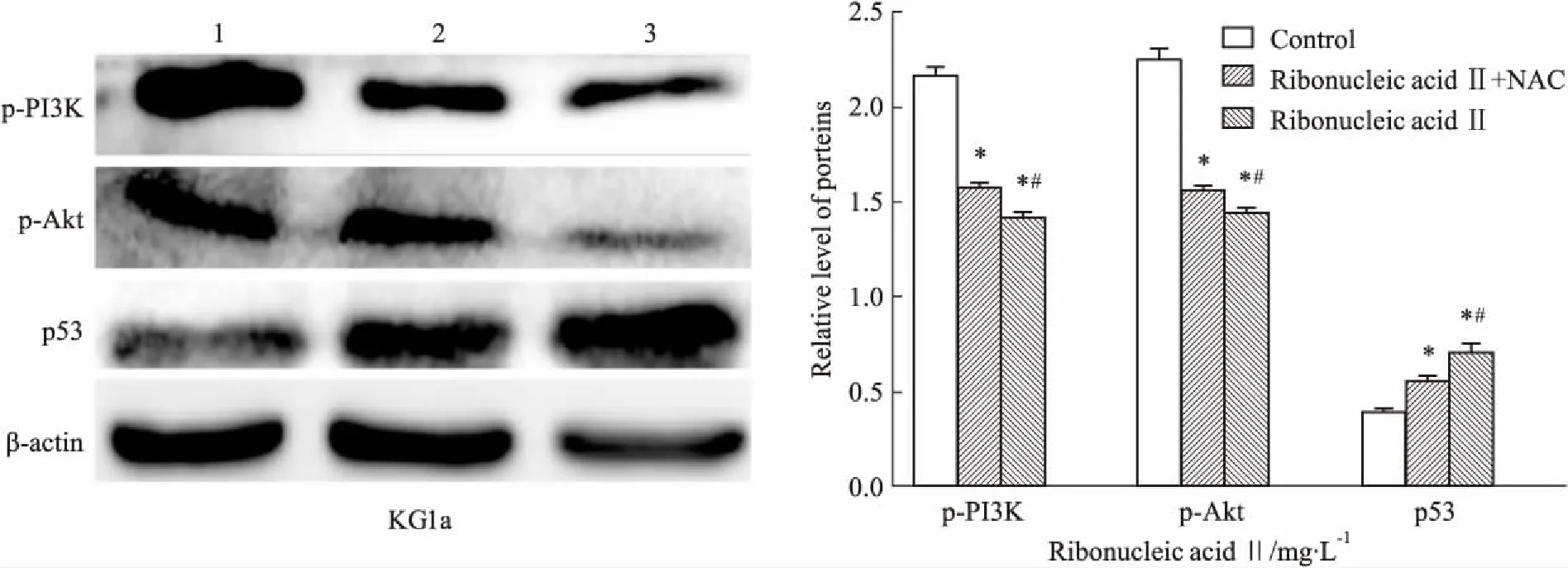
Fig 5 Effect of ribonucleic acid Ⅱ and NAC on protein expressions in KG1a
1:Control; 2:Ribonucleic acid Ⅱ+NAC; 3:Ribonucleic acid Ⅱ.*P<0.05vscontrol;#P<0.05vsribonucleic acid Ⅱ+NAC
2.5 NAC和注射用核糖核酸Ⅱ对KG1a细胞p-PI3K/p-Akt、p53表达的影响进一步研究PI3K/Akt信号通路与ROS的关系,首先用抗氧化剂NAC预处理细胞30 min,再用150 mg·L-1注射用核糖核酸Ⅱ作用后,检测p-PI3K/p-Akt与p53蛋白表达的变化。Fig 5的Western blot结果显示,药物组磷酸化PI3K/Akt蛋白明显减少,而与药物组相比,NAC组磷酸化PI3K/Akt蛋白水平上升;p53蛋白表达水平在药物组明显上调,而在NAC组p53蛋白水平的上调不如药物组明显;但两组与对照组相比,磷酸化PI3K/Akt及p53表达水平变化差异均具有统计学意义(P<0.05)。药物组与NAC组蛋白表达差异也具有统计学意义(P<0.05)。提示注射用核糖核酸Ⅱ诱导KG1a细胞凋亡过程中PI3K/Akt的活化、p53与ROS密切相关。
3 讨论
白血病是恶性克隆性白细胞增殖异常、分化障碍、凋亡受阻和正常造血受抑制为特性的恶性造血系统疾病[7]。大量研究表明,白血病发病机制非常复杂,与抑癌基因失活、易位所引起的癌基因激活、染色体断裂等多种因素相关[8]。众多研究表明,刺激和诱导肿瘤细胞凋亡已成为治疗肿瘤的新方向,前期研究也证实,注射用核糖核酸Ⅱ通过诱导人急慢性白血病细胞凋亡,来达到抑制其增殖的作用。
注射用核糖核酸Ⅱ是免疫核糖核酸的成员之一,具有提高细胞免疫功能和抗肿瘤的作用。研究证明,注射用核糖核酸Ⅱ通过抑制肿瘤细胞DNA复制,特异性地抑制和杀伤肿瘤细胞,保护正常细胞的功能,从而诱导肿瘤细胞死亡[9]。前期工作证实,注射用核糖核酸Ⅱ能够通过上调p53,诱导人急慢性白血病细胞凋亡[2],为探究其具体机制指引了新的方向。
注射用核糖核酸Ⅱ通过调控p53基因,影响Bcl-2/Bax,促进人白血病细胞的凋亡。细胞的恶性增殖很可能由周期调控异常引起,p53在细胞周期中调节G1和G2/M期校正点的检测,与转录激活息息相关;其下游基因p21可与cyclin-CDK复合物结合,引起G1期的阻滞,从而导致细胞增殖障碍。cyclin D1是细胞周期G1期向S期过渡的重要调控点,cyclin D1可通过结合并激活G1期特有的周期蛋白性激酶CDK4,促进细胞增殖。同时p21作为周期蛋白依赖性激酶抑制子,抑制CDK的活性,过表达p21引起细胞周期阻滞在G1期[10]。FCM结果显示,注射用核糖核酸Ⅱ阻滞KG1a细胞周期在G0/G1期,并与ROS密切相关;Western blot结果显示,注射用核糖核酸Ⅱ作用后,cylin D1、CDK4的表达明显下调,同时p21表达升高,与细胞周期阻滞于G0/G1期一致。表明注射用核糖核酸Ⅱ通过下调cylin D1、CDK4及上调p21来调节细胞周期,从而抑制KG1a细胞增殖。注射用核糖核酸Ⅱ通过p53调控p21,引起G1期的阻滞,导致KG1a细胞凋亡,诱导G1周期阻滞,与其他类型肿瘤被诱导凋亡机制相一致[11]。
前期研究证实了注射用核糖核酸Ⅱ对人急慢性白血病细胞具有增殖抑制和诱导凋亡作用,与p53所在的凋亡信号通路存在密切联系[2]。p53可在DNA受损后,以维持基因组稳定来参与DNA的修复过程。较小的DNA损伤可导致细胞周期的阻滞,较严重的DNA损伤可导致细胞凋亡[12]。众多关键的周期调控蛋白参与细胞凋亡的机制,p53调控p21引起周期阻滞,从而参与细胞凋亡的过程,提示p53协调的机制存在细胞周期和细胞凋亡。前期研究与本研究的FCM、Western blot结果均显示,p53调控周期与凋亡的协调机制在注射用核糖核酸Ⅱ诱导KG1a凋亡中占重要角色。PI3K是一个非常复杂的原癌基因家族,而PI3K本身就含有丝氨酸/苏氨酸(Ser/Thr)激酶和磷脂酰肌醇激酶的活性。PI3K介导的信号通路在众多恶性肿瘤的发生、发展、转移中具有重要作用,而p53基因在其中极为重要[13]。Akt是通过磷酸肌醇被募集到质膜而被激活的一种蛋白丝氨酸/苏氨酸激酶,在细胞存活和凋亡中起重要作用,它能直接磷酸化多种转录因子,抑制抑凋亡基因(如Bcl-2家族)的表达和增强抗凋亡基因(如p53等)的表达。PI3K/Akt信号通路下游的MDM2泛素连接酶能抑制p53,进而促进p53的降解或失活[14]。Western blot结果显示,注射用核糖核酸Ⅱ作用后,p-PI3K、p-Akt和p-MDM2的表达明显下调,同时p21表达升高。表明注射用核糖核酸Ⅱ通过下调磷酸化的PI3K/Akt,调控p53及其下游凋亡和周期相关蛋白的表达,从而诱导KG1a细胞的凋亡。
大量研究表明,紫外线、离子辐射、抗肿瘤药物等,都能刺激形成内源性ROS,在细胞凋亡过程中起重要作用。有研究报道,ROS可通过氧化还原修饰来影响细胞信号转导系统,并可影响Bax、Bcl-2、p53等基因的表达[6]。许多抗肿瘤药物诱导肿瘤细胞DNA片段化来诱导凋亡,均与引发胞内ROS改变相关。例如ROS轻度升高可促进细胞增殖,中度ROS水平升高反而诱导细胞凋亡,更高ROS则直接导致细胞坏死[15]。本研究用注射用核糖核酸Ⅱ处理KG1a细胞,细胞内ROS明显上升,且呈浓度依赖性。研究发现,ROS的释放可使Akt去磷酸化,从而使Akt及下游靶标失活,通过内源性途径引发细胞的凋亡[7]。注射用核糖核酸Ⅱ的抗肿瘤作用与DNA损伤有关,而DNA损伤与细胞凋亡中p53和cyclin-D1都紧密相关。因此,PI3K/Akt信号通路和ROS的关系是否与注射用核糖核酸Ⅱ对白血病细胞的增殖抑制作用相关,值得深入研究。在加抗氧化剂NAC后,注射用核糖核酸Ⅱ对G0/G1期的阻滞作用明显低于注射用核糖核酸Ⅱ组,且Western blot结果显示,p-PI3K和p-Akt表达较只用注射用核糖核酸Ⅱ处理组的表达明显上升,p53的蛋白表达水平明显下降。这些结果提示,注射用核糖核酸Ⅱ诱导KG1a细胞凋亡与ROS、PI3K/Akt信号通路有关。
综上所述,在注射用核糖核酸Ⅱ诱导人白血病KG1a细胞凋亡过程中,与ROS介导的PI3K/Akt信号通路密切相关。注射用核糖核酸Ⅱ是否还通过其他通路和方式诱导人白血病细胞凋亡还有待进一步探讨。