DERL1对人乳腺癌细胞ZR-75-1迁移和侵袭的影响
胡 露,李洪忠,万敬员
(1. 重庆医科大学药学院,重庆 400016;2. 重庆医科大学附属第一医院分子肿瘤学与表观遗传学实验室,重庆 400016)
乳腺癌是影响全世界女性健康最常见的恶性肿瘤之一,据最新统计,其发病率在全世界女性肿瘤疾病中列第一位[1]。虽然现临床上可以采用外科手术结合放射性疗法、化学疗法以及靶向治疗等,在一定程度上有效地控制早期乳腺癌,但是难治性乳腺癌,特别是转移性乳腺癌的预后却不容乐观。因此,探讨乳腺癌发生转移的分子机制显得尤其关键。
DERL1(Der1-like domain family,member 1)是一种与内质网(endoplasmic reticulum,ER)降解相关的蛋白,其参与ER中错误折叠的蛋白质的释放过程,并将该蛋白质逆转运到细胞质中[2]。DERL1在非小细胞型肺癌[3]、结肠癌[4]和乳腺癌[5]中过度表达,并发挥重要作用。Wang等[5]研究表明,DERL1表达与腋窝淋巴结转移之间有明显关联,表明DERL1可能参与侵袭性肿瘤生长或转移,但其对乳腺癌侵袭和转移的作用还研究甚少。本研究通过将DERL1过表达及干扰质粒转入人乳腺癌ZR-75-1细胞,探讨DERL1对ZR-75-1细胞迁移和侵袭能力的影响及其相关机制。
1 材料与方法
1.1 材料
1.1.1细胞株 人乳腺癌细胞ZR-75-1,来源于美国ATCC细胞库,用含10%胎牛血清的RPMI 1640完全培养基,培养于37 ℃、5% CO2的细胞培养箱中,取对数生长期,生长状态良好的细胞用于后续实验。
1.1.2试剂 脂质体转染试剂Lipofectamine 2 000,购自美国Invitrogen;DERL1过表达(DERL1)及干扰(DERL1 siRNA)质粒,购自赛业生物科技有限公司;胎牛血清,购自以色列BI公司;RPMI 640培养基,购自美国HyClone公司;DERL1、E-cadherin、β-actin引物序列,均由生工生物工程有限公司合成;TRIzol、实时荧光定量PCR试剂盒,购于日本TaKaRa公司;兔抗人DERL1抗体,购自美国Novus公司;兔抗人钙黏附蛋白E(E-cadherin)抗体,购自美国CST公司;荧光二抗羊抗兔IgG,购自美国Invitrogen。
1.1.3仪器 FORMA311型CO2细胞培养箱、PLF-276型-80 ℃低温冰箱、MIRO 21R型高速低温离心机(美国Thermo公司);SW-CJ-2FD型超净工作台(苏州安泰空气技术有限公司);CFX型定量PCR仪(美国Bio-Rad公司);Eclipse Ti型荧光倒置显微镜(日本Nikon公司)。
1.2 方法
1.2.1细胞干预分组 细胞分4组:(1)DERL1过表达对照组(control-1):转入DERL1过表达对照质粒;(2)DERL1过表达组(DERL1):转入DERL1过表达质粒;(3)DERL1干扰对照组(control-2):转入DERL1干扰对照质粒;(4)DERL1干扰组(si-DERL1):转入DERL1干扰质粒。
1.2.2细胞干预(质粒转染) 待细胞密度在6孔板中处于80%-90%后,按Lipofectamine 2000试剂说明书进行转染操作。6 h后换为含10%胎牛血清的RPMI 1640完全培养基,于CO2细胞培养箱中继续培养48 h后,用于后续实验。
1.2.3细胞划痕愈合实验 取各组细胞分别制成单细胞悬液,接种于6孔板中,置于CO2细胞培养箱中,待细胞长满后,每孔用无菌牙签划一道粗细均匀的竖痕,于倒置显微镜下采集细胞0 h时划痕的初始状态照片后,放回CO2细胞培养箱中,24 h后,再次拍摄各组细胞划痕状态。用ImageJ软件计算划痕面积,与相应对照组进行组间比较。细胞迁移率/%=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.2.4Transwell实验 用无血清RPMI 1640培养基将各组细胞制备成单细胞悬液后,分别以1×105个/孔加入铺有基质胶的Transwell小室(置于24孔板)中。每个小室下层的孔中加入含10%胎牛血清的RPMI 1640完全培养基,于CO2细胞培养箱培养48 h后,取出小室,用结晶紫染色后,用棉签轻轻擦去上室中未迁移的细胞,于倒置显微镜下对膜底细胞随机采集图片,随后用ImageJ软件计算侵袭细胞数。
1.2.5实时荧光定量PCR检测 用TRIzol提取不同干预组细胞总RNA,根据反转录试剂盒说明书,按20 μL体系反转录RNA生成cDNA。进一步以获得的cDNA为模板,对相应的目的基因进行qPCR扩增。E-cadherin上游引物:5′-CGAGAGCTACACGTTCACGG-3′,下游引物:5′-GGGTGTCGAGGGAAAAATAGG-3′;β-actin上游引物:5′-CATGTACGTTGCTATCCAGGC-3′,下游引物:5′-CTCCTTAATGTCACGCACGAT-3′;DERL1上游引物5′-TCGGACATCGGAGACTGGTT-3′,下游引物:5′-GGCAGTGATTGGCCTCCAAA-3′。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。采用2-ΔΔCt法表示相对表达量。
1.2.6细胞免疫荧光实验 将各组细胞分别接种于24孔板中,置CO2细胞培养箱中24 h后,取出用95%乙醇固定1 h,随后用0.05% Triton X-100通透20 min,PBS洗涤后,加入E-cadherin一抗(1 ∶100),4 ℃过夜;PBS清洗后,加入羊抗兔荧光标记二抗避光孵育1 h,PBS洗涤3次后,与DAPI避光孵育15 min,然后用PBS洗涤3次,在荧光倒置显微镜下观察、拍照。
1.2.7统计学分析 用SPSS 13.0软件包进行统计处理,两组间比较使用t检验。
2 结果
2.1 质粒干预后细胞中DERL1的表达水平qPCR检测结果显示(Fig 1),与相应对照组相比,DERL1过表达质粒能使ZR-75-1细胞中DERL1的mRNA水平明显升高(P<0.01),DERL1干扰质粒能使ZR-75-1细胞中DERL1的mRNA水平明显降低(P<0.01),表明DERL1过表达及干扰质粒成功转入细胞中,可用于后续实验。
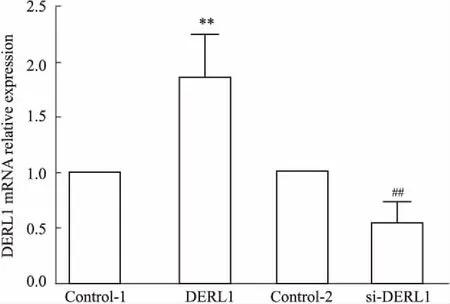
Fig 1 Expression of DERL1 in each group of
**P<0.01vscontrol-1;##P<0.01vscontrol-2.
2.2 DERL1对ZR-75-1迁移能力的影响Fig 2的划痕愈合实验结果显示,24 h时,与相应对照组相比,DERL1过表达组ZR-75-1细胞迁移率明显升高(P<0.05);DERL1干扰组细胞的迁移率明显降低(P<0.05)。表明DERL1对 ZR-75-1细胞迁移有促进作用。
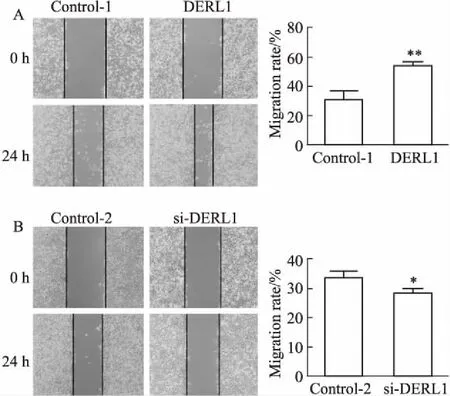
Fig 2 Effect of DERL1 overexpression (A) and DERL1 interference (B) on migration of ZR-75-1 cells (× 100)
*P<0.05,**P<0.01vscontrol.
2.3 DERL1对ZR-75-1侵袭能力的影响Fig 3的Transwell结果显示,48 h后,DERL1过表达组穿膜细胞数较对照组明显增多(P<0.05),DERL1干扰组穿膜细胞较对照组明显减少(P<0.05)。表明DERL1可促进 ZR-75-1细胞的侵袭。
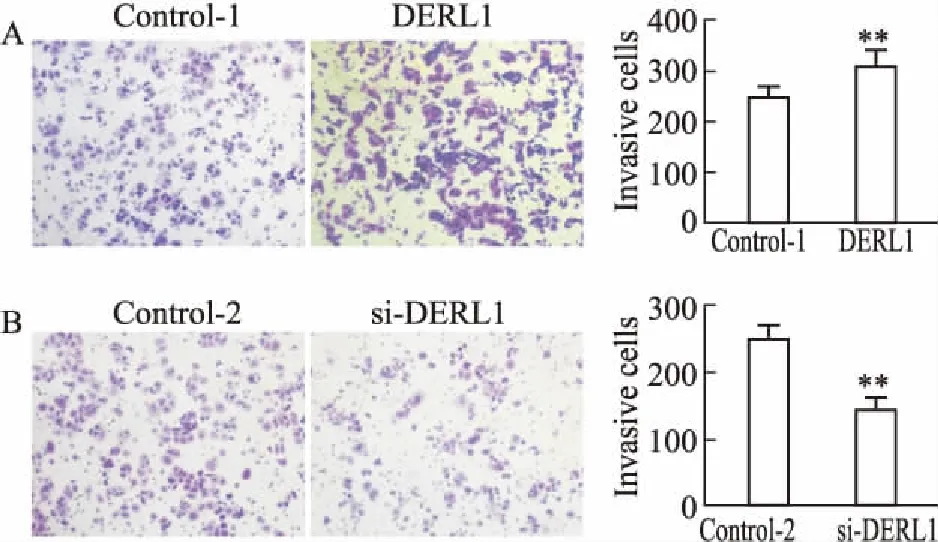
Fig 3 Effect of DERL1 overexpression (A) and DERL1 interference (B) on invasion of ZR-75-1 cells (×100)
**P<0.01vscontrol.
2.4 DERL1对ZR-75-1细胞形态的影响为了说明DERL1对ZR-75-1细胞的形态是否具有影响,本实验观察了用DERL1过表达及干扰质粒转染ZR-75-1细胞48 h后,细胞的形态变化。如Fig 4所示,与对照组相比,DERL1过表达组细胞形态由紧密排列的鹅卵石状变为排列松散的纺锤形间质样,转入DERL1干扰质粒后,细胞变回紧密排列的鹅卵石状。提示DERL1可能促进ZR-75-1细胞的形态发生上皮间质转化。
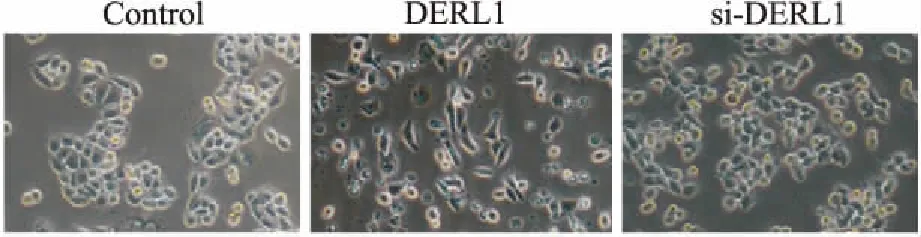
Fig 4 Effect of DERL1 on cell morphous of ZR-75-1 cells(×100)
2.5 DERL1对ZR-75-1细胞中E-cadherin mRNA和蛋白表达的影响qPCR和细胞免疫荧光结果显示(Fig 5),DERL1过表达组中E-cadherin mRNA和蛋白水平低于相应对照组(P<0.05);DERL1干扰组中E-cadherin mRNA和蛋白表达高于相应对照组(P<0.05)。表明DERL1能抑制ZR-75-1细胞中E-cadherin mRNA和蛋白的表达水平。
3 讨论
DERL1是蛋白编码基因,由该基因编码的蛋白质DERL1是derlin家族的成员,该家族成员参与ER错误折叠蛋白质的错位,并介导蛋白质从ER腔逆转移到胞质中[6-7]。ER的主要功能是合成、折叠、运输以及修饰分泌蛋白和跨膜蛋白,当细胞处于缺氧、营养物质缺乏和细胞毒物作用等情况时,内质网腔内出现错误折叠蛋白或未折叠蛋白过度堆积、固醇等水平失调而启动内质网应激。在ER应激的早期阶段,细胞生长得到促进。然而,如果这些不利的刺激持续存在,延长的ER应激将诱导细胞凋亡。Wang等[5]研究表明,DERL1在乳腺癌中高表达,且DERL1可保护乳腺癌细胞免受内质网应激诱导的细胞凋亡,细胞凋亡是肿瘤转移级联中的限速过程,这可能赋予癌细胞转移特性。Pi等[8]发现,DERL1在头颈部鳞状细胞癌(squamous cell carcinoma of the head and neck,SCCHN)的组织和细胞中表达升高,且DERL1的表达与颈淋巴结转移、复发和临床分期明显相关,在SCCHN细胞中,敲低DERL1的表达可促进细胞凋亡,抑制细胞的增殖和转移。Wu等[9]研究表明,膀胱癌组织和细胞中DERL1均高表达,具有DERL1阳性表达的患者的总存活率低于阴性表达的患者,并且发现在膀胱癌细胞中,干扰DERL1的表达可以逆转上皮间质转化(epithelial-mesenchymal transition,EMT)进展,抑制细胞的迁移和侵袭。

Fig 5 Effect of DERL1 on expression of E-cadherin mRNA and protein in ZR-75-1 cells
为探究DERL1对人乳腺癌细胞迁移和侵袭的影响,本实验用DERL1过表达及干扰质粒,对人乳腺癌细胞ZR-75-1中DERL1的表达进行干预后,检测各组细胞的迁移和侵袭能力。结果显示,与对照组相比,DERL1过表达可明显增加ZR-75-1细胞迁移率和侵袭细胞数目,DERL1表达降低后,细胞的迁移率和侵袭细胞数均明显降低,表明DERL1能促进人乳腺癌细胞ZR-75-1的迁移和侵袭。
肿瘤细胞可通过细胞外基质降解、新生血管生成和免疫逃避等机制,发生侵袭和转移,其中EMT发挥十分重要的作用。EMT是指紧密连接的上皮细胞在某些生理或病理条件下,细胞间的连接与极性丧失,转化为纺锤形样间质细胞的生物学过程,其在胚胎发育、组织重建和器官纤维化中十分关键。后研究发现,上皮细胞通过EMT可获得降解细胞外基质、抵抗细胞凋亡、进行迁移与侵袭等间质表型的能力,表明其在肿瘤侵袭转移的发生、发展中作用关键[10]。EMT的发生涉及多种分子机制,其中E-cadherin是一种钙依赖性的跨膜蛋白,细胞间黏附、细胞上皮表型的丧失与E-cadherin表达的降低有关[11-12],其表达的降低被认为是EMT发生的标志[13]。Markiewicz等[14]研究发现,与E-cadherin表达正常的乳腺癌患者相比,E-cadherin缺失的患者具有更高比例的间质型的肿瘤细胞。Yu等[12]研究显示,E-cadherin在上皮细胞癌中发挥着抑制癌细胞迁移和侵袭的作用。Pi等[8]和Wu等[9]研究发现,在SCCHN细胞和膀胱癌细胞中,抑制DERL1的表达后,两种细胞中E-cadherin的表达水平均明显上调。
为探究DERL1促进乳腺癌细胞迁移和侵袭的分子机制,本实验观察了ZR-75-1细胞转染DERL1过表达及干扰质粒后的形态变化,并检测了各实验组中E-cadherin mRNA和蛋白的表达情况。结果显示,与对照组相比,DERL1过表达组细胞形态由鹅卵石形上皮样转化为纺锤形间质样,细胞中E-cadherin mRNA和蛋白的表达量明显下降;干扰DERL1的表达后,细胞形态由纺锤样转变回紧密排列的鹅卵石状上皮样,且细胞中E-cadherin mRNA和蛋白的表达量明显上升。由此推测,DERL1可能通过下调E-cadherin的表达水平,促进乳腺癌细胞的EMT,从而促进乳腺癌细胞的迁移和侵袭。但是DERL1下调E-cadherin的信号通路机制有待进一步研究。
(致谢:本实验于重庆医科大学生化与分子药理重点实验室完成,特别感谢李海琳和曾颖靓的帮助。)
——一道江苏高考题的奥秘解读和拓展