芍药苷促进糖尿病创面愈合
房志锐,陈 璐,李春晓,宋 敏,张璐莎,Joel Wake Coffie,张丽媛,马璐璐,王 虹
(1. 方剂学教育部重点实验室,天津市中药药理学重点实验室,天津中医药大学中医药研究院,天津 301617;2. 天津中医药大学中西医结合学院,天津 301617)
糖尿病溃疡(diabetes ulcers,DU)是由难愈性创面愈合引起的常见的糖尿病血管并发症,其中因糖尿病导致截肢的患者中,并发DU的患者所占比例为84%[1-2]。有研究表明,清热药在DU总体药物类别中所占比例为34%,成为所占比例最高的一类药物,也成为治疗DU的首选药物。其中,清热凉血药在清热药中出现频数最高,赤芍在清热凉血药中占大于30%的比例,使用频率与玄参并列最高。赤芍,味苦,性微寒,归肝经,具有清热凉血、散瘀止痛之功。《本草求真》载,“赤芍有散瘀行血之意,能于血中活滞,故凡腹痛坚积,血瘕疝痹,经闭目赤,因于积热而成者,用此则能凉血逐瘀”。可见,赤芍除具有清热凉血之功外,尚兼有活血散瘀之效[3-4]。芍药苷(paeoniflorin,PA)是赤芍重要的药效物质基础[5],研究表明,其具有免疫调节、抗肿瘤、抗氧化、抗炎、缓解皮损症状等作用,且不良反应少[6-8]。但关于PA对糖尿病创面愈合的作用尚未见报道。本研究旨在通过建立糖尿病小鼠全层皮肤切除夹板模型,探讨PA对糖尿病创面愈合的作用及其作用机制。
1 材料
1.1 细胞株人脐静脉内皮细胞株HUVECs、小鼠成纤维细胞株NIH/3T3,均购自美国菌种保藏中心(ATCC)。
1.2 实验动物36只SPF级健康♂糖尿病(BKS.Cg-Dock7m+/+Lepr db /JNju,db/db)小鼠,12只SPF级健康♂野生型(C57BL/6JNju,db/+)小鼠,8~12周龄,均由南京大学南京生物医学研究所提供,许可证号:SCXK(苏)2015-0001。实验动物于天津市中国医学科学院生物医学放射工程研究所动物房中分笼饲养,自由进食,饲养温度(22~25) ℃,相对湿度40%~60%。
1.3 药物与试剂PA,购于成都德斯特生物科技有限公司,货号DST170103-070,HPLC≥98%;内皮细胞培养基-2(endothelial cell growth medium-2,EGM-2)(货号:CC-4147)、胎牛血清(fatal bovine serum,FBS)(货号:CC-3156),均购于瑞士Lonza公司;DMEM购于Biological Industrie公司;三溴乙醇(Avertin)、二甲基亚砜(DMSO),均购于美国Sigma公司;注射用凝集素Lectin I、羊抗鼠Lectin I一抗、二抗DyLight®594抗羊IgG (H+L),均购自美国Vector公司;BrdU细胞增殖检测试剂盒(货号:11647229001),购自瑞士Roche公司。
1.4 仪器细胞恒温培养箱(美国Thermo公司);倒置相差显微镜(日本Nikon公司);小型台式离心机(美国Beckman公司);多功能酶标仪(美国Molecula Device公司);IncuCyte Zoom(美国ESSEN公司);7500实时定量PCR仪(美国Applied Biosystems公司)。
2 方法
2.1 细胞培养HUVECs培养所用培养基为EGM完全培养液,基础培养基为EBM,加入5%的FBS,4 ℃存放。NIH/3T3成纤维细胞培养所用基础培养基为DMEM,加入含10%的FBS、1%双抗。细胞置于37 ℃、5% CO2的孵箱中培养,融合至80%~90%时进行传代。
2.2 细胞活力分析采用MTS法进行细胞活力分析。细胞融合至80%时,以2.5×103个细胞每孔接种于96孔板中。置于37 ℃、5% CO2的孵箱中培养12 h后,细胞分组,分为对照组(DMSO组,含0.1% DMSO),给药组(分别加入终浓度为0.625、1.25、2.5、5、10、20、40、80 μmol·L-1的PA),每组6个复孔。给药后24 h,每孔加入20 μL MTS。2 h后,于酶标仪波长490 nm测吸光度OD值。
2.3 细胞增殖能力分析采用BrdU掺入法进行细胞增殖能力分析。细胞融合至80%时,以2.5×103个细胞/孔接种于96孔板中。置于37 ℃、5% CO2孵箱中培养12 h后,细胞分组同“2.2”,每组6个复孔。给药后24 h,根据BrdU细胞增殖检测试剂盒说明书进行后续步骤,每个样品孔的吸光度由酶标仪在370 nm处测量,吸光度值直接与DNA合成量相关,从而与增殖细胞的数量相关。
2.4 细胞迁移能力分析采用划痕法检测迁移能力。细胞融合至80%时,以1×104个细胞/孔接种于96孔板中。置于37 ℃、5% CO2孵箱中培养12 h后,将细胞分为对照组(DMSO组,含0.1% DMSO)和给药组(加入终浓度为5、10、20、40 μmol·L-1的PA)。放入IncuCyte中进行细胞划痕实验。用96孔细胞划痕器做细胞横向划痕,PBS缓冲液清洗除去划痕时掉落的细胞碎片;按照分组加入对应的培养基,在倒置显微镜40×下拍照记录0 h;细胞放回培养箱继续培养24 h,再次进行拍照记录;通过相差显微镜记录划痕之后细胞迁移,通过内皮细胞的划痕面积(间隙宽度)的平均长度来确定迁移程度,计算公式:24 h迁移率/%=(A0 h-A24 h)/A0 h×100%,式中A代表划痕面积。
2.5 细胞成管能力分析采用基质胶成管方法检测细胞体外成管能力。Matrigel基质胶包被预冷的96孔板后,放入37 ℃、5% CO2培养箱中孵育1 h。HUVECs细胞分为对照组(DMSO组,含0.1% DMSO)、给药组(加入终浓度为10 μmol·L-1的PA)和VEGFA组(加入终浓度为0.1 mg·L-1的VEGFA),以2×104个细胞/孔接种于基质胶预先包被的96孔板中。37 ℃、5% CO2培养18 h后倒置显微镜拍照,使用ImageJ软件分析成管结构的节点数。
2.6 qPCR检测Ⅲ型胶原(Collagen Ⅲ)、纤维连接蛋白(Fibronectin)、α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)mRNA的表达NIH-3T3细胞融合至80%时,以2×105个细胞/孔接种于12孔板中。将细胞分为对照组(DMSO组,含0.1% DMSO)和给药组(分别加入终浓度为1×10-5、2×10-5、4×10-5mol·L-1的PA)。给药48 h后,使用TRIzol提取细胞RNA,逆转录合成cDNA,进行qPCR,检测Collagen Ⅲ、Fibronectin、α-SMA mRNA的表达。Collagen Ⅲ 正向引物:5′-ACGTAAGCACTGGTGGACAG-3′,反向引物:5′-AGCTGCACATCAACGACATC-3′;Fibronectin正向引物:5′-CTACCCTGCAGCCTCTGCGC-3′,反向引物:5′-CCTCCCTGGCTCGGTCG-3′;α-SMA正向引物:5′-CCACCGCAAATGCTTCTAAGT-3′,反向引物:5′-GGCAGGAATGATTTGGAAAGG-3′。每组设置3个复孔,与对照组比较后,取2-ΔΔCt值进行数据统计,分析相对表达量。
2.7 α-SMA细胞免疫荧光染色NIH-3T3细胞以5×104个/孔接种于12孔板中,将细胞分为对照组(DMSO组,含0.1% DMSO)和给药组(含终浓度为10 μmol·L-1的PA),每组设3个复孔,培养48 h后,对NIH-3T3细胞进行α-SMA细胞免疫荧光染色实验。倒置荧光显微镜(×200)观察染色的细胞,每孔观察6个随机视野,拍照并计数染色阳性的细胞。
2.8 糖尿病小鼠全层皮肤切除夹板模型的建立根据文献方法,建立糖尿病小鼠全层皮肤切除夹板模型[9]。以15 g·L-1Avertin(16.5 mL·kg-1) 经腹腔注射对小鼠行全身麻醉后取俯卧位,去除小鼠背部被毛。在小鼠背部中线使用生物活检器向下按压,制备直径为6 mm的圆形全层皮肤切除伤口。用医用黏合剂将硅胶夹板固定在伤口周围,并以5-0缝合线缝合,然后将小鼠置于37 ℃电热毯上直至苏醒。在伤口处点涂庆大霉素后,用3M伤口敷料覆盖伤口,每2 d更换1次。
2.9 实验分组与给药按照随机双盲的方法将糖尿病创面愈合模型小鼠分为3组:db/+模型组、db/db模型组、db/db芍药苷组(db/db模型组+PA 10 mg·kg-1·d-1),每组10只。db/+模型组与db/db模型组,灌胃羧甲基纤维素钠(CMC-Na)10 mL·kg-1,给药组灌胃PA,每天1次,连续给药16 d后取材。
2.10 HE和Masson染色观察创面组织形态学变化连续给药16 d后,取小鼠创面皮肤组织,4%多聚甲醛溶液固定,取石蜡组织切片进行HE和Masson染色,于光镜下观察创面皮肤组织形态学改变。
2.11 免疫荧光法检测血管新生取石蜡组织切片进行免疫荧光染色。荧光计数:随机选取5个不同的糖尿病创面皮肤组织横切面视野,以PS软件(Photoshop 5)计数每个视野内毛细血管数量,血管新生以lectin+阳性细胞数表示。

3 结果
3.1 PA对糖尿病小鼠创面愈合及一般指标的影响造模后16 d,与正常组相比,糖尿病小鼠各组各时间点创面愈合率均明显减慢;正常组小鼠创面大多数接近完全愈合;而模型组糖尿病鼠仍有27%的未愈合创面,给药组糖尿病小鼠创面愈合率达到81%,且造模后8 d开始,愈合率在各时间点均高于模型组,明显促进创面愈合,并持续到观察终点(P<0.05),见Fig 1A、1B。皮肤创伤后,各组间基础体质量和血糖均无差异(Fig 2)。提示药物干预对糖尿病小鼠体重和血糖没有明显影响。
3.2 PA对糖尿病小鼠创面周围组织形态学的影响采用HE染色对造模后16 d小鼠创面组织新生肉芽组织进行分析。如Fig 1C所示,给药组的新生肉芽组织厚度较厚,且表皮结构连续完整,可见大量的成纤维细胞增殖,胶原纤维生成较多,且排列较整齐。模型组肉芽组织厚度较薄,表皮结构不完整,仅有少量胶原纤维形成,并且排列较紊乱。Masson染色可将胶原蛋白染成深蓝色,蓝色越深代表胶原蛋白含量越多,可用于评价伤口处胶原沉积情况。PA组糖尿病小鼠伤口组织所染蓝色深,创面胶原纤维排列整齐;模型组糖尿病小鼠伤口组织呈浅蓝色,胶原稀疏,排列无序(Fig 1D)。
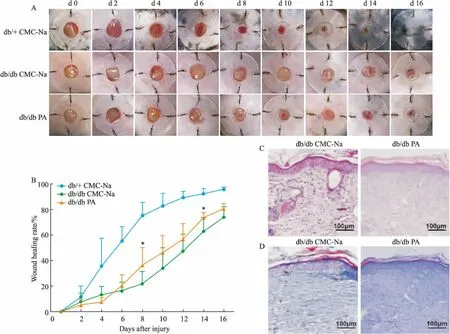
Fig 1 Effect of paeoniflorin on rate of wound healing and wound histomorphology in diabetic mice n=6)
A: The situation of wound healing in each group of diabetic mice at every two days; B: Quantification by the rate of wound healing of diabetic mice at each time point; C: The wound tissues of diabetic mice were stained with HE 16 days after surgery; D: The wound tissues of diabetic mice were stained with Masson16 days after surgery.*P<0.05 vs db/db model.
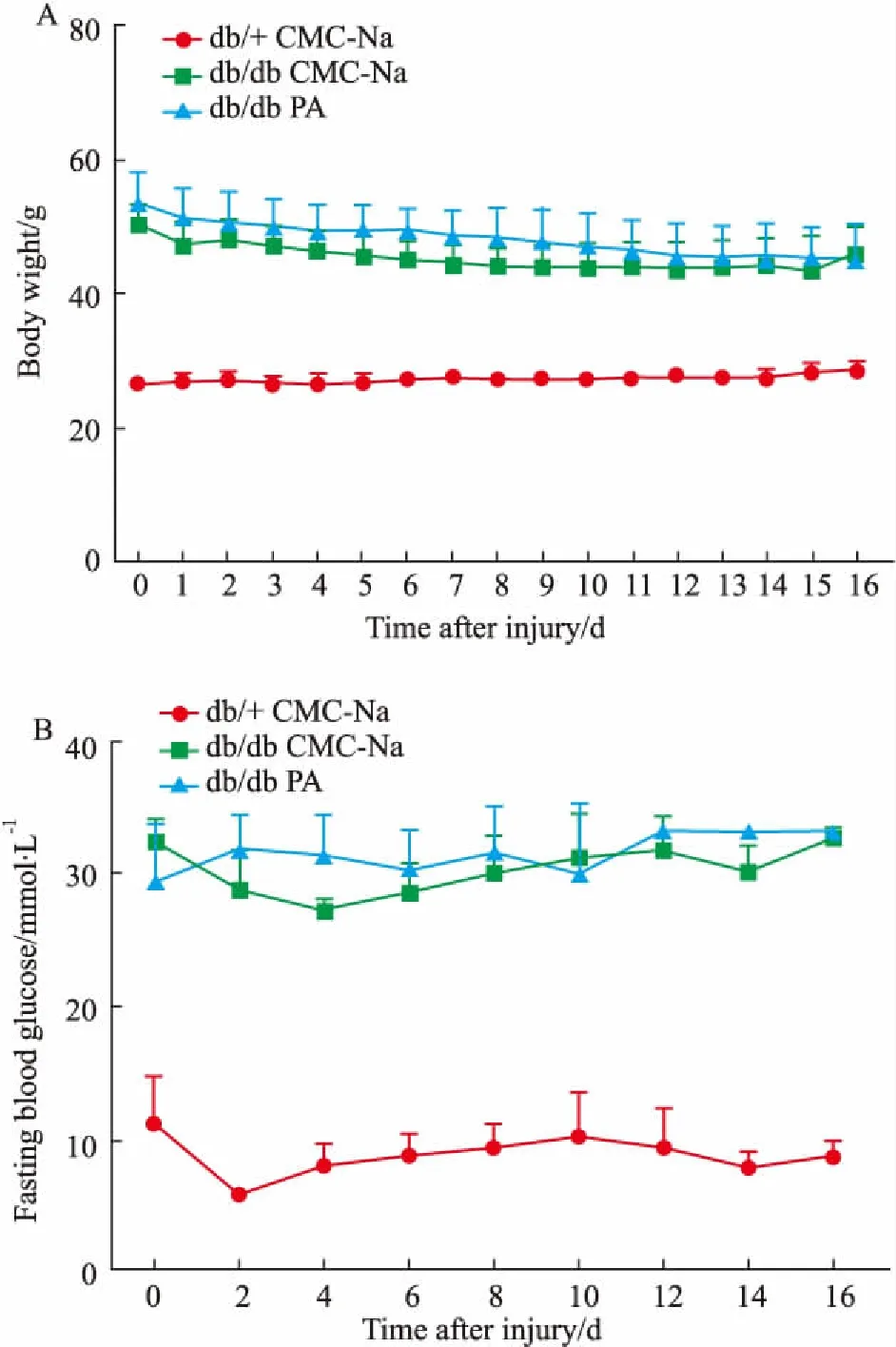
Fig 2 Effect of paeoniflorin on general indicators of diabetic mice n= 6)
A: The weight of each group of diabetic mice at each time point; B: The blood glucose of each group of diabetic mice at each time point, compared with model group.
3.3 PA对糖尿病小鼠创面组织周围血管和毛细血管密度的影响给药16 d,采集创面组织周围血管的图像(Fig 3A),PA治疗的毛细血管密度比CMC-Na治疗更为明显;倒置荧光显微镜下拍照观察Lectin+细胞的分布和数量,以PS软件计数每个视野内红色荧光蛋白数量来评价毛细血管密度。糖尿病小鼠创面周围组织Lectin+免疫荧光结果显示(Fig 3C),与模型组相比,PA治疗组Lectin+红色荧光表达更强、数量更多。结果显示(Fig 3B),给药16 d PA治疗组Lectin+细胞数目相比模型组明显增多(P<0.01)
3.4 PA对HUVECs增殖、迁移、成管能力的影响采用HUVECs探究PA对细胞增殖、迁移和成管能力的影响。首先通过MTS和BrdU标记实验,检测不同浓度的PA对HUVECs增殖能力的影响,实验结果显示(Fig 4A、4B),与对照组相比,各组细胞活性和增殖能力均无显著性差异。提示PA干预对HUVECs增殖能力没有明显影响。其次,利用细胞划痕实验检测PA对HUVECs迁移的影响,结果显示(Fig 4C、4D),加药6 h后PA(10 μmol·L-1)组能够明显缩小细胞划痕的宽度,与模型组相比,PA可以增强HUVECs迁移,促进细胞划痕愈合(P<0.01)。体外Matrigel成管结果显示(Fig 4E),PA(10 μmol·L-1)诱导HUVECs体外成管节点明显增多,与对照组相比,PA可以增强HUVECs成管能力(P<0.01)。
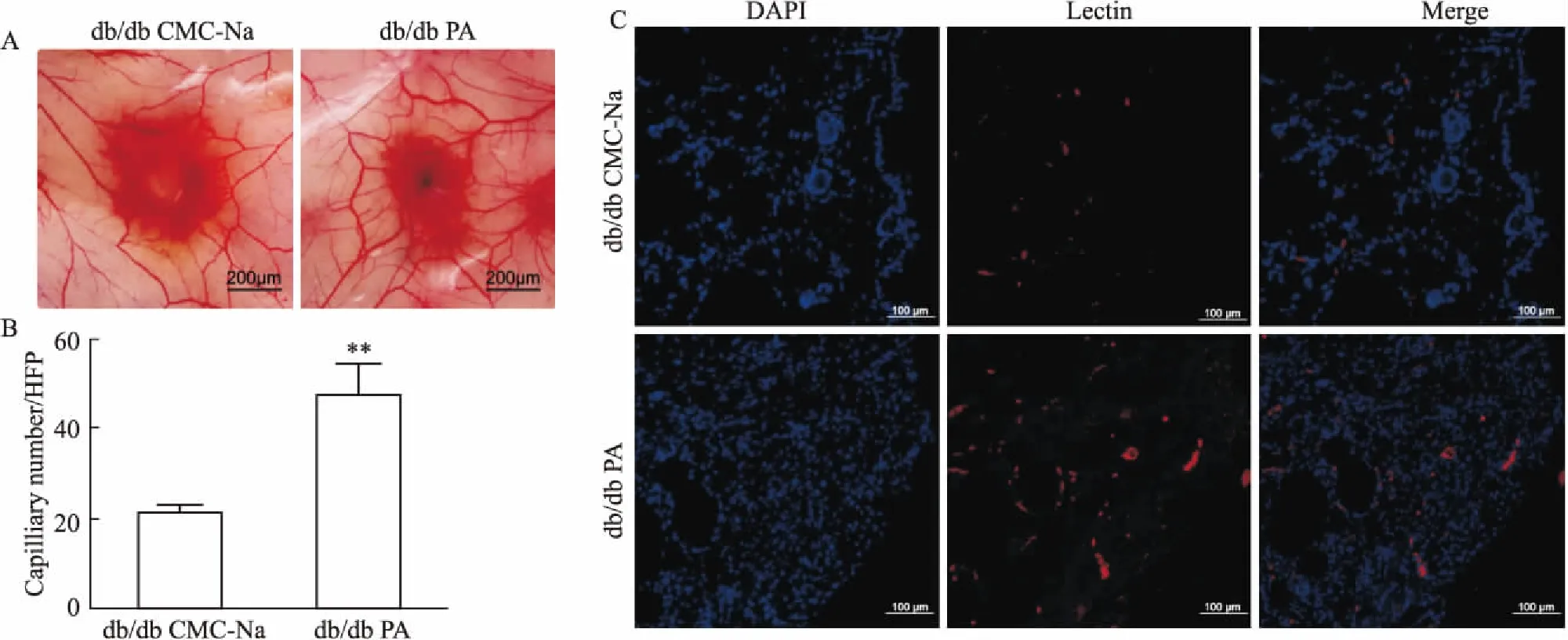
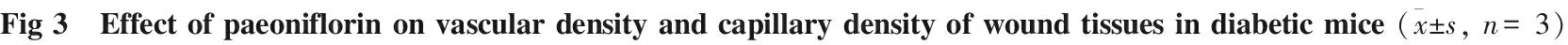
A: The image of the density of blood vessels around the wound tissues in diabetic mice; B: Quantification of Lectin immunofluorescence staining; C: Lectin immunofluorescence staining showed capillary density analysis of wound tissues in diabetic mice.**P<0.01vsdb/db model.

Fig 4 Effect of paeoniflorin on capacity of proliferation, migration and tube formation in HUVECs n=3)
A: MTS method was used to detect the effect of paeoniflorin on HUVEC activity; B: BrdU method was applied to detect the effect of paeoniflorin on HUVEC proliferation; C. The cell scratch test of HUVECs (×200); D: Quantitation of C; E: Matrigel analysis of the capacity of tube formation in HUVECs; F: Quantitation of E.**P<0.01vscontrol group.
3.5 PA对成纤维细胞增殖、迁移、分化和分泌能力的影响采用NIH/3T3成纤维细胞,探究PA对细胞增殖、迁移、分化和分泌能力的影响。通过MTS和BrdU标记实验,检测不同浓度的PA对NIH/3T3细胞增殖能力的影响,结果显示(Fig 5A、5B),与对照组相比,PA组细胞活性无差异,PA组细胞增殖能力明显增加(P<0.05)。利用细胞划痕实验检测PA对NIH/3T3细胞迁移的影响,结果显示(Fig 5C、5D),与模型组相比,PA(20 μmol·L-1)组能够明显缩小加药10 h后细胞划痕的宽度,可以增强成纤维细胞迁移,促进细胞划痕愈合(P<0.01)。
Collagen Ⅲ、Fibronectin是细胞外基质(extracellular matrix,ECM)的主要成分,本研究通过qPCR方法检测PA加药处理48 h后NIH/3T3中Collagen Ⅲ、Fibronectin的表达水平。结果显示(Fig 6A、6B),PA干预48 h后,Collagen Ⅲ mRNA的表达明显增加(P<0.01),Fibronectin mRNA的表达无差异。提示PA具有促进NIH/3T3细胞Collagen Ⅲ表达的作用。
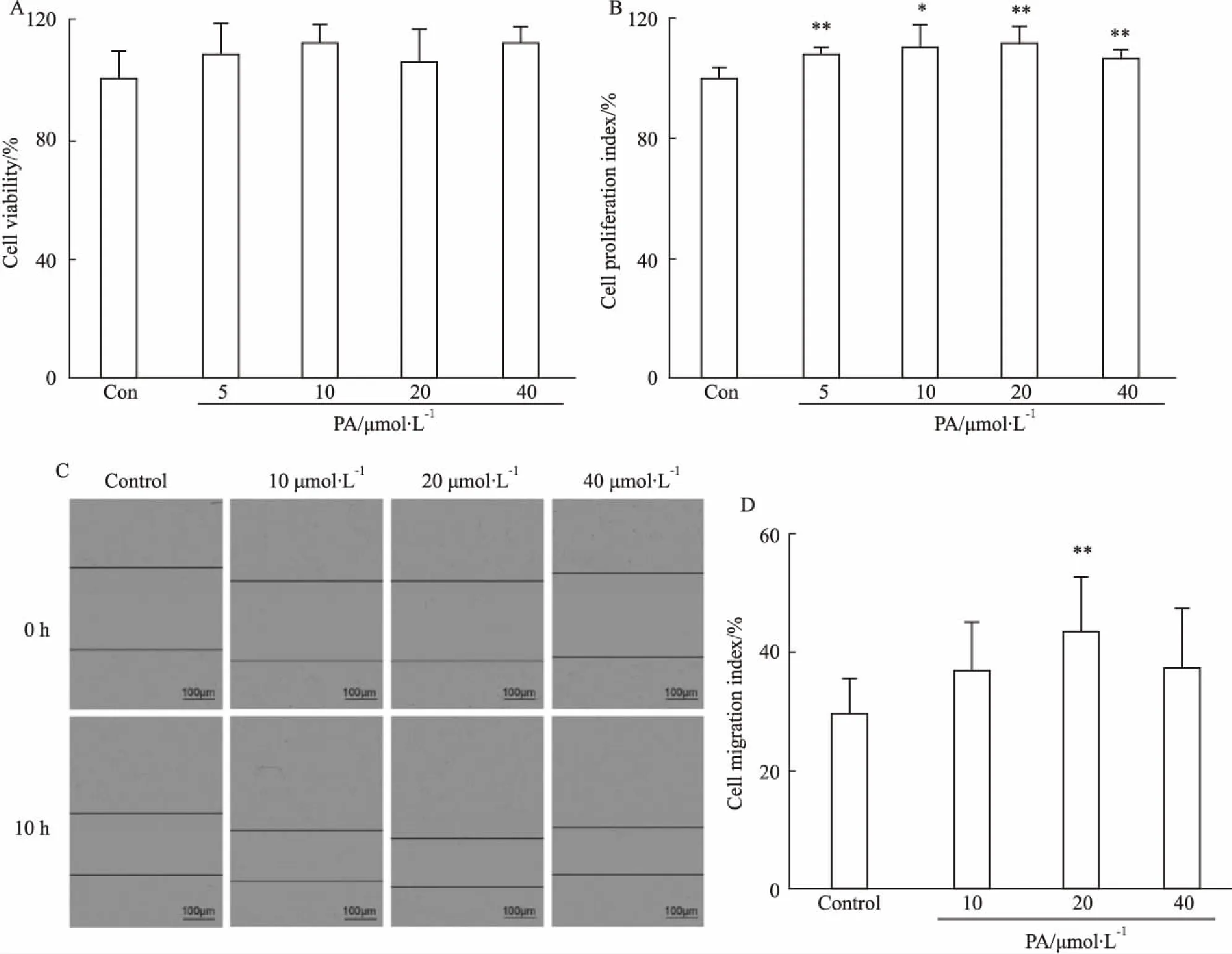
Fig 5 Effect of paeoniflorin on capacity of proliferation and migration in NIH/3T3 n=6)
A: MTS method was used to detect the effect of paeoniflorin on NIH/3T3 activity; B: BrdU method was applied to detect the effect of paeoniflorin on NIH/3T3 proliferation; C: The cell scratch test of NIH/3T3 (×200); D: Quantitation of C.*P<0.05,**P<0.01vscontrol group.
α-SMA是肌成纤维细胞的重要标志,肌成纤维细胞由成纤维细胞转化而来,在组织器官的损伤、修复和重塑过程中具有重要作用。实验结果显示(Fig 6C、6D),PA能提高α-SMA的表达量和荧光强度。提示PA能够提高成纤维细胞的转化能力,促进创面损伤修复。
4 讨论
本实验结果发现,PA可以促进糖尿病小鼠创面愈合,促进肉芽组织增厚、胶原沉积和增加组织毛细血管密度,提示PA能够通过促进创面组织ECM的沉积和血管新生,为组织修复提供良好的基础。体外实验结果提示,PA促进糖尿病小鼠创面愈合,可能是通过提高HUVECs迁移和成管能力,提高成纤维细胞增殖、迁移、分泌和向肌成纤维细胞转化的能力来实现。
糖尿病引起的一系列血管、神经和代谢异常,使得糖尿病皮肤较正常皮肤更易受到损伤,糖尿病伤口愈合缓慢,组织难以得到有效修复。血管新生受损,组织损伤局部供血不足是糖尿病伤口难愈合的主要表现之一[10-11]。新生血管可改善伤口处微循环,为损伤修复提供必要的氧气和营养,在糖尿病创面愈合过程中发挥重要作用。本研究表明,PA明显增加糖尿病小鼠创面处血管新生数目。体外实验也进一步证实,PA无明显促进内皮细胞增殖的作用,但可以明显促进内皮细胞的迁移和成管,提示PA具有很强的促血管生成作用。
肉芽组织形成是创面修复增殖期的主要阶段,成纤维细胞是其主要组成细胞。在创面愈合过程中,成纤维细胞向能够分泌大量的胶原且表达α-SMA的肌成纤维细胞转化。肌成纤维细胞具有收缩作用,可以加速创面收缩,在创面修复过程中起着更为重要的作用[12]。糖尿病下的高糖环境、糖基化终末产物、氧化应激等,均可阻碍创面肌成纤维细胞的形成,从而影响肉芽组织的生成和创面的愈合[13-14]。本研究表明,PA可以提高成纤维细胞增殖和迁移的能力,促进肌成纤维细胞标志α-SMA的表达,提示PA可以促进成纤维细胞向肌成纤维细胞转化,加速创面收缩。成纤维细胞是创面重塑过程中的主要修复细胞,能够通过快速增殖和合成胶原等,促进皮肤损伤修复。有研究表明,糖尿病环境下,皮肤组织中成纤维细胞增殖减弱,进而影响创面ECM合成,创面愈合迟缓[14]。本实验结果表明,PA可以升高ECM相关基因的表达,提示PA能促进ECM的沉积。
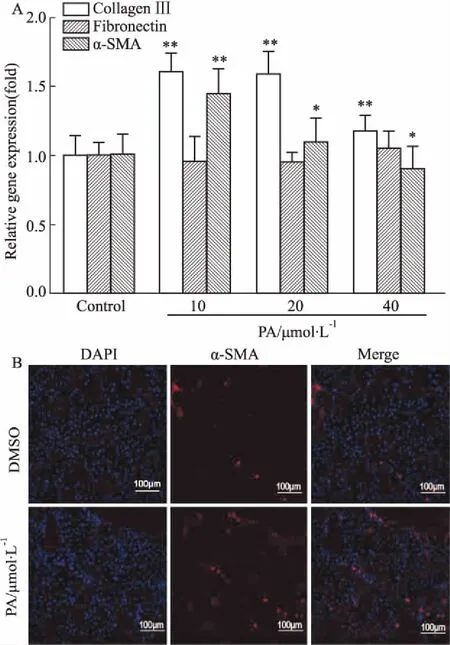
Fig 6 Effect of paeoniflorin on expression of collagen Ⅲ, fibronectin and α-SMA in fibroblasts n=3)
A: qPCR assay for the effect of paeoniflorin on the expression of collagen Ⅲ, fibronectin, α-SMA mRNA in NIH/3T3.*P<0.05,**P<0.01vscontrol group; B: Fluorescent protein intensity of α-SMA(×200).
综上所述,PA可以通过促进糖尿病小鼠创面血管新生和肉芽组织形成,加快糖尿病小鼠创面愈合速度,并提高愈合质量,起到了创面损伤修复的效果,为PA的临床应用提供了新的实验依据,也为糖尿病创面愈合治疗提供了新的思路。