miR-1910-3p在肝细胞癌中通过靶向β-1,4-半乳糖基转移酶3发挥肿瘤抑制作用
倪俊声,郑浩,黄智平,陶元平,周伟平
miR-1910-3p在肝细胞癌中通过靶向β-1,4-半乳糖基转移酶3发挥肿瘤抑制作用
倪俊声*,郑浩*,黄智平,陶元平,周伟平
200433 上海,海军军医大学第三附属医院肝外三科(倪俊声、郑浩、陶元平、周伟平);510010 广东,广州军区广州总医院肝胆外科(黄智平)
研究miR-1910-3p 在肝细胞癌(HCC)中的表达和功能。
qRT-PCR 检测在 68 个 HCC 组织中 miR-1910-3p 的表达情况。MTT 试验确定 miR-1910-3p 在 HCC 进展中的生物学作用。采用生物信息学分析、Western blot 和双荧光素酶报告试验确定 miR-1910-3p 抑制 HCC 细胞增殖的分子机制。
miR-1910-3p 在 HCC 中表达下调。统计学分析显示,miR-1910-3p 的低表达与肿瘤大小(= 0.031)、静脉浸润(= 0.014)、TNM 分期(= 0.048)显著相关。此外,miR-1910-3p 低表达的 HCC 患者总体生存率和无瘤生存率均较差(= 0.003,= 0.041)。MTT 试验显示,miR-1910-3p 抑制 HCC 细胞增殖。生物信息学工具、荧光素酶报告试验、qRT-PCR、Western blot 等检测结果表明 β-1,4-半乳糖基转移酶 3(B4GALT3)是 HCC 细胞中 miR-1910-3p 的下游靶点。
miR-1910-3p 通过直接靶向 B4GALT3 抑制 HCC 细胞的增殖。
癌,肝细胞; β-1,4-半乳糖基转移酶 3; miR-1910-3p
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌,具有较高的发病率和死亡率[1-2]。肝细胞癌通常发生在有乙型、丙型肝炎合并肝硬化或有肝癌家族史的人群[3-4]。目前,肝细胞癌的病因和确切的分子机制尚不完全清楚[5–6]。因此,迫切需要进一步研究肝细胞癌的发病机制和寻找有效的 HCC 治疗策略。
microRNAs(miRNAs)是一类无编码蛋白能力的非编码RNAs[7-8]。研究报道证实,多种 miRNAs 在 HCC 的发生和进展中发挥着重要作用[9]。例如,miR-23b 作为一种致癌基因,通过靶向 ST7L 促进 HCC 的进展[10];miR-370 通过下调 PIM1 表达抑制 HCC 的发生和发展[11]。然而,miR-1910-3p 在 HCC 中确切的表达和功能尚不清楚。
1 材料与方法
1.1 材料
1.1.1 组织样本 68 例经组织病理证实的 HCC 组织样本和对应癌旁非肿瘤组织样本来自于 2010 年 6 月 – 2012 年 12 月间在海军军医大学第三附属医院接受手术治疗的 HCC 患者。所有患者术前均未接受化疗或放疗。所有的样本均储存于–80 ℃。本研究得到了海军军医大学第三附属医院伦理委员会的批准且所有患者签署知情同意书。
1.1.2 细胞 人正常肝细胞系 LO2 和 5 株 HCC 细胞系 HepG2、Hep3B、Huh7、SMMC-7721、MHCC-97H 购于中国科学院细胞库。所有细胞都孵育在含 10% 胎牛血清的 DMEM 培养基中,于 37 ℃、5% CO2条件下培养。
1.1.3 主要仪器和试剂 胎牛血清购自美国 Gibco 公司;DMEM 培养基和lipofectamine2000 购自美国 Invitrogen 公司;miR-1910-3p 抑制剂、miR-1910-3p 模拟物、β-1,4-半乳糖基转移酶 3(B4GALT3)克隆、B4GALT3 siRNA 和报告基因均购自上海吉马生物制药有限公司;一抗B4GALT3和GAPDH 购自美国Abcam 公司。
1.2 方法
1.2.1 细胞转染 转染前将细胞种植于培养板中。当细胞密度接近 70% 时,将 miR-1910-3p抑制剂、miR-1910-3p 模拟物、B4GALT3 克隆、B4GALT3 siRNAs 和 Lipofectamine2000 相应的对照物进行转染。根据产品说明书进行所有实验的操作。
1.2.2 qRT-PCR 检测 具体实验操作过程依照参考文献[12],U6 和 GAPDH 分别为 miR-1910-3p 和 B4GALT3 内参基因。用 2-∆∆CT法分析 miR-1910-3p 和 B4GALT3 的相对表达情况。
引物序列如下:miR-1910-3p 上游5' TCCGCT TGTTCGGACCGTG 3',miR-1910-3p 下游5' AAC AATACCGCCTAGGGC 3';U6 上游5' CTCGCTTC GGCAGCACA 3',U6 下游5' ACGCTTCACGAAT TTGCGT 3';B4GALT3 上游5' CGAGATCAGGGA CCGACATTT 3',B4GALT3 下游5' GATCGTTCT GGACAGTAGGGC 3';GAPDH 上游5' AGCCAC ATCGCTCAGACAC 3',GAPDH 下游5' GCCCAA TACGACCAAATCC 3'。
1.2.3 MTT 试验 具体实验操作过程依照参考文献[12]。
1.2.4 荧光素酶报告基因试验 具体实验操作过程依照参考文献[12]和试剂说明书进行。
1.2.5 Western blot 具体实验操作过程依照参考文献[12]。
1.3 统计学处理
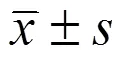
miR-1910-3p相对表达量Relative miR-1910-3pexpression15 10 5 0 HCC01HCC02HCC03HCC04HCC05HCC06HCC07HCC08HCC09HCC10HCC11HCC12HCC13HCC14HCC15HCC16HCC17HCC18HCC19HCC20HCC21HCC22HCC23HCC24HCC25HCC26HCC27HCC28HCC29HCC30HCC31HCC32HCC33HCC34
Figure 1 miR-1910-3p is down-regulated in HCC tissues [A: qRT-PCR was conducted to explore the expression of miR-1910-3p in HCC tissues (n = 68) and adjacent non-tumor tissues (n = 68); B: Overall survival; C: Disease-free survival]
2 结果
2.1 在 HCC 组织中 miR-1910-3p 表达下调
qRT-PCR 数据显示,与对应的癌旁非肿瘤组织相比,miR-1910-3p 在 HCC 肿瘤中明显表达下调(图 1A)。表明在 HCC 中,miR-1910-3p 表达下调且可能作为 HCC 的肿瘤抑制因子。
2.2 miR-1910-3p 表达下调在 HCC 中的临床意义
为了探讨 miR-1910-3p 表达下调在 HCC 中的临床意义,基于 miR-1910-3p 在 HCC 组织中的中位表达量,我们将 68 例患者分为两组(低表达组 n = 33,高表达组 n = 35)。如表 1 所示,卡方检验结果表明,miR-1910-3p 低表达与肿瘤大小(= 0.031)、静脉浸润(= 0.014)、TNM 分期(= 0.048)显著相关。此外,低表达的 miR-1910-3p患者的总体生存率(= 0.003,图 1B)和无瘤生存率(= 0.041,图 1C)均较差。因此,我们认为 miR-1910-3p 是一种很有潜力的 HCC 诊断和预后的指标。
2.3 miR-1910-3p 抑制 HCC 细胞增殖
为了探讨 miR-1910-3p 对 HCC 细胞增殖的影响,首先检测了 miR-1910-3p 在HCC 细胞中的表达情况。结果显示 miR-1910-3p 在 HCC 细胞系中的表达明显低于人正常肝细胞 LO2(图 2A)。随后,将 miR-1910-3p 抑制剂和模拟物分别转染至 Hep3B 和 MHCC-97H 细胞中并且通过 qRT-PCR 验证转染效率,MHCC-97H-miR-1910-3p 细胞中miR-1910-3p 表达显著升高(图2B),而Hep3B-anti-miR-1910-3p 细胞中miR-1910-3p 表达显著降低(图2C)。
MTT 试验结果表明过表达 miR-1910-3p 可以抑制 MHCC-97H 细胞的增殖能力(图 2D)。另一方面,降低 miR-1910-3p 表达可促进 Hep3B 细胞的增殖能力(图 2E)。以上结果提示 miR-1910-3p 可抑制 HCC 细胞的增殖能力。
2.4 B4GALT3 是 miR-1910-3p 的下游靶点
为了探讨 miR-1910-3p 抑制 HCC 细胞增殖的潜在分子学机制,利用在线软件 TargetScan 7.2 预测 miR-1910-3p 的潜在结合靶点,提示 miR-1910-3p 可与 B4GALT3 的 3'-UTR 结合(图 3A)。过表达 miR-1910-3p 降低了 MHCC-97H 细胞系中的 B4GALT3-wt-3'-UTR 的荧光活力,而对 B4GALT3-mut-3'-UTR 没有任何影响(图 3B)。此外,Western blot 和 qRT-PCR 结果显示过表达 miR-1910-3p 降低了 MHCC-97H 中 B4GALT3蛋白和 mRNA 的表达;而 miR-1910-3p 抑制剂可以增加 Hep3B 中 B4GALT3 蛋白和 mRNA 的表达(图 3C 和 3D)。随后,我们检测了 miR-1910-3p 高、低表达的 HCC 组织中 B4GALT3 的 mRNA 表达。qRT-PCR 数据提示在 miR-1910-3p 高表达的 HCC 组织中,B4GALT3 表达显著降低(图 3E)。以上结果提示,在 HCC 中 miR-1910-3p 可靶向 B4GALT3 的 3'-UTR 抑制其表达。
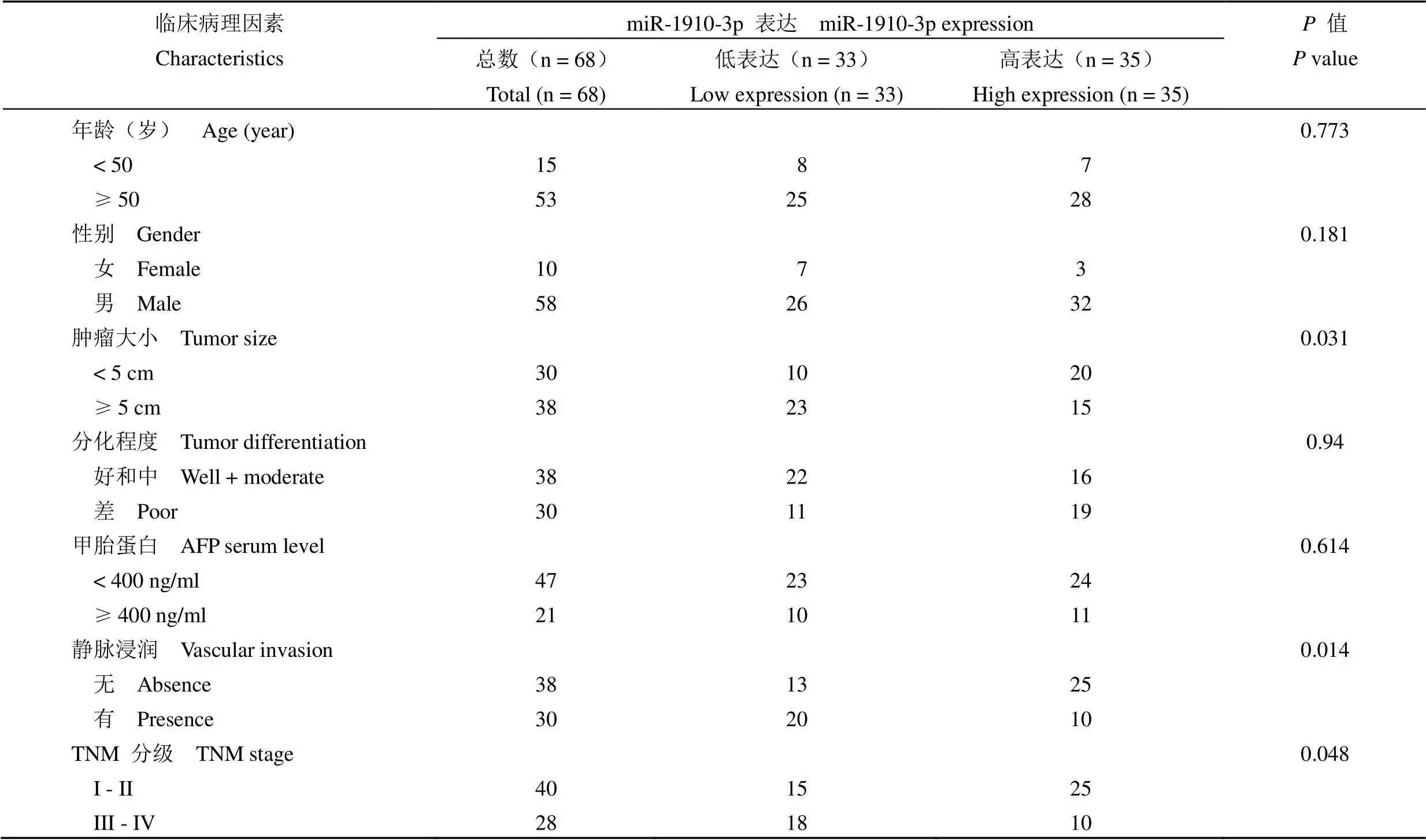
表 1 68 例 HCC 患者的 miR-1910-3p 表达与临床病理因素相关

miR-1910-3p的相对表达量Relative miR-1910-3pexpression1.5 1.0 0.5 0 LO2 Hep3B HepG2 Huh7 SMMC-7721 MHCC-97HA
Figure 2 miR-1910-3p suppresses proliferation of HCC cells (A: qRT-PCR revealed that the expression of miR-1910-3p was notably decreased in HCC cell lines; B: miR-1910-3p mimics significantly increased the expression of miR-1910-3p in MHCC-97H cells; C: miR-1910-3p inhibitors significantly decreased the expression of miR-1910-3p in Hep3B cells; D: MTT assay indicated that miR-1910-3p mimics notably suppressed viability of MHCC-97H cells; E: MTT assay indicated that miR-1910-3p inhibitors markedly enhanced viability of Hep3B cells;*< 0.05,***< 0.001)
3 讨论
miRNAs 的异常表达与 HCC 的发生和发展密切相关[8-9],并可作为 HCC 诊断、预后和治疗靶点的潜在和有价值的生物标志物和预后指标[9]。本研究中,发现 miR-1910-3p 在 HCC 组织和细胞系中均明显下调表达。随后,探讨 miR-1910-3p 在 HCC 中的临床意义。首先,分析了 miR-1910-3p 与临床病理特征的关系。结果显示 miR-1910-3p 低表达与肿瘤大小、静脉浸润、TNM 分期显著相关。接下来,探讨了 miR-1910-3p 对 HCC 患者预后的影响,发现 miR-1910-3p 低表达的 HCC 患者总体生存率和无瘤生存率较差。这些结果表明 miR-1910-3p 在 HCC 中是一种有价值的肿瘤标志物且可能在 HCC 发展中起到抑癌作用。功能试验结果表明过表达 miR-1910-3p 可抑制 HCC 细胞增殖能力,而下调 miR-1910-3p 的表达则相反。由此,我们认为 miR-1910-3p 在 HCC 中具有肿瘤抑制作用。

A相对荧光素酶活性(%)Relative Luciferase activity (%)150 100 50 0 MHCC-97H Hep3B B4GALT3 GAPDH miR-NC miR-1910-3p miR-NC miR-1910-3p miR-NC miR-1910-3p miR-NC anti-miR-1910-3pC Wt MutB
Figure 3 B4GALT3 is a downstream target of miR-1910-3p in HCC cells [A: Results from bioinformatics tools (TargetScan 7.2) revealed that 3′-UTR of B4GALT3 had the bind site for miR-1910-3p; B: Luciferase reporter assay revealed that miR-1910-3p mimics repressed the fluorescence activity of B4GALT3-wt-3′UTR, while miR-1910-3p inhibitors enhanced the fluorescence activity of B4GALT3-wt-3′UTR. The alteration of miR-1910-3p expression had no effect on B4GALT3-mut-3′UTR; Western blot (C) and qRT-PCR (D) revealed that the expression of B4GALT3 protein and mRNA in MHCC-97H was significantly decreased by miR-1910-3p mimics, while miR-1910-3p inhibitors notably increased B4GALT3 expression in Hep3B cells; E: The expression of B4GALT3 mRNA was significantly lower in high miR-1910-3p HCC tissues;*< 0.05,**< 0.01,***< 0.001]
有研究报道称 miRNAs 可通过抑制转录或促进靶点 mRNAs 的降解来影响肿瘤的发生和进展[10-11]。利用在线软件(http://www.targetscan.org/ vert_72/),我们重点关注了在 HCC 进展中发挥重要调控作用的 B4GALT3 蛋白[13]。B4GALT 家族由 B4GAL1 ~ 7 组成,在糖基化中发挥着重要作用。异常糖基化已被证实与细胞生长、转化、分化、黏附、转移和肿瘤免疫监测在内的多种致癌特性相关[14]。B4GALTs 的作用主要是将半乳糖从尿苷二磷酸半乳糖转移到 N-乙酰氨基葡萄糖以形成重聚-N-乙酰氨基乳糖。据报道,重聚-N-乙酰氨基乳糖链主要由 N-多糖、O-多糖、糖脂、糖胺聚糖链组成。在本研究中,我们发现 B4GALT3 是miR-1910-3p 直接作用靶点,这些结果为 B4GALT3在 HCC 发生和进展的分子学机制研究提供了新的思路。
综上所述,本研究发现 HCC 中 miR-1910-3p 异常低表达并且与肿瘤大小、静脉浸润、TNM 分期和预后差密切相关。功能上,miR-1910-3p 通过抑制 HCC 细胞的增殖而发挥抗癌的作用。机制上,B4GALT3 是 HCC 细胞中 miR-1910-3p 新的作用靶点。总之,miR-1910-3p 可能是一个新的潜在的 HCC 肿瘤标志物、预后指标和治疗靶点。
[1] Jiang K, Al-Diffhala S, Centeno BA. Primary liver cancers-part 1: histopathology, differential diagnoses, and risk stratification. Cancer Control, 2018, 25(1):1073274817744625.
[2] Jiang K, Centeno BA. Primary liver cancers, part 2: progression pathways and carcinogenesis. Cancer Control, 2018, 25(1): 1073274817744658.
[3] Hamed MA, Ali SA. Non-viral factors contributing to hepatocellular carcinoma. World J Hepatol, 2013, 5(6):311-322.
[4] Fujiwara N, Friedman SL, Goossens N, et al. Risk factors and prevention of hepatocellular carcinoma in the era of precision medicine. J Hepatol, 2018, 68(3):526-549.
[5] Perumpail BJ, Khan MA, Yoo ER, et al. Clinical epidemiology and disease burden of nonalcoholic fatty liver disease. World J Gastroenterol, 2017, 23(47):8263-8276.
[6] Tunissiolli NM, Castanhole-Nunes MMU, Biselli-Chicote PM, et al. Hepatocellular carcinoma: a comprehensive review of biomarkers, clinical aspects, and therapy. Asian Pac J Cancer Prev, 2017, 18(4): 863-872.
[7] Sartorius K, Sartorius B, Winkler C, et al. The biological and diagnostic role of miRNA’s in hepatocellular carcinoma. Front Biosci (Landmark Ed), 2018, (23):1701-1720.
[8] Slaby O, Laga R, Sedlacek O. Therapeutic targeting of non-coding RNAs in cancer. Biochem J, 2017, 474(24):4219-4251.
[9] Xu J, Li J, Zheng TH, et al. MicroRNAs in the occurrence and development of primary hepatocellular carcinoma. Adv Clin Exp Med, 2016, 25(5):971-975.
[10] Zhuang L, Wang X, Wang Z, et al. MicroRNA-23b functions as an oncogene and activates AKT/GSK3β/β-catenin signaling by targeting ST7L in hepatocellular carcinoma. Cell Death Dis, 2017, 8(5):e2804.
[11] Pan XP, Wang HX, Tong DM, et al. miRNA-370 acts as a tumor suppressor via the downregulation of PIM1 in hepatocellular carcinoma. Eur Rev Med Pharmacol Sci, 2017, 21(6):1254-1263.
[12] Huang Y, Ni R, Wang J. Knockdown of lncRNA DLX6-AS1 inhibits cell proliferation, migration and invasion while promotes apoptosis by downregulating PRR11 expression and upregulating miR-144 in non-small cell lung cancer. Biomed Pharmacother, 2019, 109:1851- 1859.
[13] Guo S, Sato T, Shirane K, et al. Galactosylation of N-linked oligosaccharides by human beta-1,4-galactosyltransferases I, II, III, IV, V, and VI expressed in Sf-9 cells. Glycobiology, 2001, 11(10):813- 820.
[14] Brockhausen I. Pathways of O-glycan biosynthesis in cancer cells. Biochim Biophys Acta, 1999, 1473(1):67-95.
miR-1910-3p functions as a tumor suppressor via targeting beta-1,4-galactosyltransferase 3 in hepatocellular carcinoma
NI Jun-sheng, ZHENG Hao, HUANG Zhi-ping, TAO Yuan-ping, ZHOU Wei-ping
Third Department of Hepatic Surgery, Third Affiliated Hospital, Naval Military Medical University, Shanghai 200433, China (NI Jun-sheng, ZHENG Hao, TAO Yuan-ping, ZHOU Wei-ping); Department of Hepatobiliary Surgery, General Hospital of Guangzhou Military Command of PLA, Guangdong 510010, China (HUANG Zhi-ping)
Previous studies revealed that microRNAs (miRNAs) play a critical role in the occurrence and progression of hepatocellular carcinoma (HCC). However, the exact expression and functions of miR-1910-3p in HCC are still uncovered.
miR-1910-3p was validated in an independent validation sample cohort of 68 HCC tissues. Functional assays and MTT assay were used to determine the oppressor role of miR-1910-3p in human HCC progression. Furthermore, bioinformatics analysis, Western blot and dual-luciferase reporter assay were used to determine the mechanism by which miR-1910-3p suppresses the proliferation of HCC cells.
Here, we reported that miR-1910-3p was downregulated in HCC. Clinically, statistical analysis showed that miR-1910-3p expression was significantly associated with tumor size (= 0.031), venous infiltration (=0.014), and TNM stage (=0.048). In addition, HCC patients with lower miR-1910-3p expression had worse overall survival and disease-free survival (= 0.003,= 0.041). Functionally, MTT assay revealed that miR-1910-3p inhibited the proliferation of HCC cells. Furthermore, bioinformatics tools, luciferase reporter assay, real-time PCR, and Western blot showed that B4GALT3 was a downstream target of miR-1910-3p in HCC cells. In addition, rescue experiments indicated that B4GALT3 mediated the effects of miR-1910-3p on the proliferation of HCC cells.
We conclude that miR-1910-3p suppresses the proliferation of HCC cells via directly targeting B4GALT3. miR-1910-3p may be a potential prognosis indicator and therapeutic target for HCC.
Carcinoma, hepatocellular; beta-1,4-galactosyltransferase 3; miR-1910-3p
ZHOU Wei-ping, Email: ehphwp@163.com
10.3969/j.issn.1673-713X.2019.04.006
国家自然科学基金面上项目(81471038);上海市卫生和计划生育委员会科研课题青年项目(20154Y0083);上海市卫计委青年基金(20164Y0189);国家自然科学基金创新研究群体(81521091)
周伟平,Email:ehphwp@163.com
2018-12-18
*同为第一作者

