常规超声联合超声造影在胸膜下肺结核与细菌性肺炎鉴别诊断中的价值
武楷文 毕珂 张怡 沈梦君 丛阳 王茵
肺结核起病隐匿,病程较长,临床表现不典型,通常表现的咳嗽、咳痰、高热、寒颤等症状与细菌性肺炎相似[1]。典型的肺结核可以通过CT扫描或X线摄影等影像学检查明确诊断,但不典型肺结核影像学表现多样,结节、实变常易与细菌性肺炎相混淆,造成诊断困难[2-3]。既往由于超声波在肺脏表面形成全反射,无法对深部病灶成像,因此超声不作为常规肺部病变的检查方法。但近年来的研究表明,罹患肺结核时,肺组织发生渗出、增生和坏死并大多累及胸膜,90%以上患者的肺内病灶能很好地进行超声显像[4]。细菌性肺炎病变多累及终末支气管和肺泡,常常形成贴近胸膜的实变病灶,也能很好地显像[5]。这些研究与发现使超声技术在肺部疾病诊断中的应用成为可能[6],尤其是超声造影提供的血流灌注信息能为良恶性肺部疾病的鉴别提供重要依据[7]。本研究搜集了于同济大学附属上海市肺科医院就诊、超声可以清晰显示的胸膜下肺结核和细菌性肺炎病灶,对其常规超声和超声造影的表现进行整理和分析,探讨两种胸膜下疾病的超声表现特征,以期为肺结核与细菌性肺炎的鉴别诊断提供新的影像学依据。
资料和方法
一、研究对象
搜集2019年1—5月于上海市肺科医院确诊并在超声科行常规超声及超声造影检查的贴壁胸膜下肺结核或细菌性肺炎患者共51例,其中确诊为肺结核(结核组)的患者35例,男19例,女16例,中位年龄为51.00(34.50,59.50)岁。确诊为细菌性肺炎(肺炎组)的患者16例,男11例,女5例,中位年龄为60.50(56.75,71.75)岁;病原学检查确诊为金黄色葡萄球菌源性5例、肺炎链球菌源性8例、铜绿假单胞杆菌源性2例、肺炎克雷伯菌源性1例。本研究已取得上海市肺科医院伦理委员会批准(编号K18-144),两组患者检查前均签署知情同意书。
二、纳入和排除标准
1.纳入标准:(1)贴壁胸膜下肺病灶,超声可清晰显示,且超声造影图像清晰完整者;(2)结核组患者经痰涂片或培养显示结核分枝杆菌阳性,经病理学检测到干酪样坏死伴抗酸杆菌阳性、结核分枝杆菌基因检测阳性,或经诊断性抗结核药物治疗明确为肺结核的患者;(3)肺炎组患者临床症状典型,痰培养连续2次分离出相同病原菌,或痰菌定量培养病原菌数≥106菌落形成单位(CFU)/ml而确诊为细菌性肺炎的患者;(4)在充分了解超声造影的获益和风险的基础上,同意接受检查并签署知情同意书者。
2.排除标准:(1)对超声对比剂过敏,或有较高过敏风险者;(2)患有肿瘤或严重心肺功能、肝肾功能障碍者。
三、方法

图1 细菌性肺炎患者。2019年2月14日在上海市肺科医院进行超声检查,显示胸膜下楔形低回声病灶,病灶深部与正常含气肺组织形成高回声的“碎片征” 图2 肺结核患者。2019年4月4日在上海市肺科医院进行超声检查,显示胸膜下类圆形低回声病灶,病灶深部与周围肺组织边界较清晰,后方高回声的“瀑布征” 图3 肺结核患者。2019年4月20日在上海市肺科医院进行超声检查,显示胸膜下不规则低回声病灶,病灶深部与周围肺组织边界清晰,可见“碎片征”
常规超声扫查对两组患者的病灶进行评估(当有多个病灶时选取体积最大的),记录病灶大小、位置、形态、内部及后方回声。之后调节仪器至超声造影模式,机械指数为0.10,造影增益20 dB,经肘静脉团注超声对比剂1.5 ml后用5 ml生理盐水冲管,连续、动态采集3 min图像。观察并记录病灶的开始增强、达峰和消退情况,坏死区发生率及特征。选择正常肺组织和病灶最早增强区域为感兴趣区,使用仪器自带程序绘制时间-强度曲线,分析并记录正常肺组织和病灶的开始增强时间、病灶增强达峰时间、增强强度减半时间,以及60 s、120 s、180 s时的增强强度,并计算两者的开始增强时间差(病灶开始增强时间-正常肺组织开始增强时间)。其中病灶与正常肺组织的超声造影开始增强时间差参照Bai等[8]提出的标准,即≥2.5 s为暗增强,<2.5 s为早增强。图像分析由2名具有5年以上超声及超声造影诊断经验的医师共同完成,并将结果交予上级医师复核。
四、 仪器与药品
采用LOGIQ E9超声诊断仪(美国General Electric 公司),凸阵探头,频率1~6 MHz。超声对比剂为注射用六氟化硫微泡(SonoVue,意大利Bracco 公司,国药准字J20030117)。
五、 统计学处理
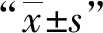
结 果
一、常规超声表现
结核组35例患者胸膜下肺结核病灶中,左肺14个,右肺21个;大小平均(4.12±1.48) cm;28例呈楔形(80.00%,28/35),5例呈类圆形(14.29%,5/35),2例呈不规则形(5.71%,2/35)。肺炎组16例细菌性肺炎病灶中,左肺9个,右肺7个;大小平均(4.30±1.54) cm;10例呈楔形(62.50%,10/16),6例呈类圆形(37.50%,6/16),两组间形态差异无统计学意义(χ2=4.109,P=0.128)。
两组患者中,病灶深部与后方含气肺组织间均可观察到高回声。其中边缘不规则、形态杂乱、层叠出现、后方伴彗星尾征的小碎片样高回声,即“碎片征”,在结核组中出现11例(31.43%,11/35),肺炎组中出现13例(81.25%,13/16),两组间差异有统计学意义(χ2=10.940,P=0.001);边缘规整、后方伴彗星尾征的高回声,即“瀑布征”,在结核组中出现22例(62.86%,22/35),肺炎组中出现3例(18.75%,3/16),两组间差异有统计学意义(χ2=8.548,P=0.003)。两组患者的典型超声图像见图1~3。所有患者在操作中均未发生不良反应。
二、超声造影表现
1.增强模式:肺炎组15例(93.75%)病灶表现为从肺门向胸膜表面逐级分支的离心型增强模式,1例(6.25%)表现为局部向整体的增强模式。结核组中25例(71.43%)表现为离心型增强模式,6例(17.14%)表现为从外周向中心蔓延的向心型增强模式,4例(11.43%)表现为离心型和向心型均有的增强方式,两组间差异无统计学意义(χ2=7.456,P=0.059)。
2.造影开始增强时间:参照病灶与正常肺组织的超声造影开始增强时间差的标准,结核组和肺炎组病灶几乎均为早增强,分别占94.29%(33/35)、93.75%(15/16),仅少数患者为晚增强,分别占5.71%(2/35)、6.25%(1/16),两组间差异无统计学意义(Fisher精确概率检验,P>0.05)。
3.坏死区表现:结核组共有29例(82.86%)病灶出现无增强区,提示存在坏死区;肺炎组中共5例(31.25%)病灶存在坏死区,两组间差异有统计学意义(χ2=13.160,P=0.000)。在坏死区形态方面,结核组中15例(51.72%,15/29)表现为病灶内多个不相互连续的筛孔样坏死,11例(37.93%)表现为形态规则、内壁规整的大片状坏死(单个坏死区面积>病灶整体面积的20.00%),3例(10.35%,3/29)表现为病灶内部几乎全坏死仅残存活性边缘呈环状增强。肺炎组中,1例(1/5)表现为形态规则、内壁规整的大片状坏死,4例(4/5)表现为形态规则、内壁规整的小片状坏死(单个坏死区面积≤病灶整体面积的20.00%,两组间差异有统计学意义(χ2=26.692,P=0.000)。典型的常规超声、超声造影图像及穿刺活检病理图见图4~13。两组患者在正常肺组织开始增强时间、病灶开始增强时间、病灶与正常肺组织开始增强时间差、病灶增强强度减半时间、病灶增强峰值强度,以及病灶60 s、120 s、180 s增强强度的指标差异均无统计学意义(表1)。
讨 论
由于气体是超声波的强反射介质,充满气体的肺部是超声检查的 “禁区”。 既往超声不作为常规肺部病变的检查方法。但近年来的研究表明,肺结核因其特有的病理改变导致正常肺含气结构受到破坏,肺组织发生渗出、增生和坏死并大多累及胸膜,90%以上患者的肺内病灶能很好地进行超声显像,形成特有的超声图像,包括肺实变、肺不张、空洞、钙化、胸膜下结节、胸膜增厚和胸腔积液等。Agostinis等[4]报道了在其研究的60例肺结核患者中,所有患者超声检查均发现了阳性改变,其中胸膜下结节的发现率最高(96.67%),其次是肺实变、胸腔积液等;细菌性肺炎常由病原体经支气管或血行播散,引起细支气管、终末支气管和肺泡的炎症,又可经肺泡间孔向周围扩散,而形成贴壁胸膜下肺病灶,为超声应用于肺部疾病诊断打下了基础[9-10]。
随着肺部超声的推广与应用,有学者提出常规超声联合超声造影可以作为胸膜下肺部病变的诊断方法[4, 11]。与CT扫描相比较,超声无电离辐射,可反复进行,超声造影还可以实时动态观察病变部位的血流灌注情况,获取更多的诊断信息[12]。有研究应用超声造影技术对肺部病变的良恶性进行鉴别,取得了一定的成果[5, 8],但对良性病变不同类型疾病间鉴别诊断的研究较少,而肺结核作为一种重要的特异性肺部感染备受关注。
有文献表明,超声造影可以通过病灶与正常肺组织的开始增强时间差区别病灶血供来源,从而对肺部病变的良恶性进行鉴别[8, 13];但良性病变的血供则主要来源于肺动脉,开始增强时间与正常肺组织几乎无差别,这为鉴别诊断带来了困难。本研究中两组病灶的开始增强时间、强度及病灶-肺组织开始增强时间差的差异均无统计学意义,与既往研究结果相符合[5, 14],再次证明仅依据超声造影的病灶开始增强时间无法进一步鉴别良性病变的种类。
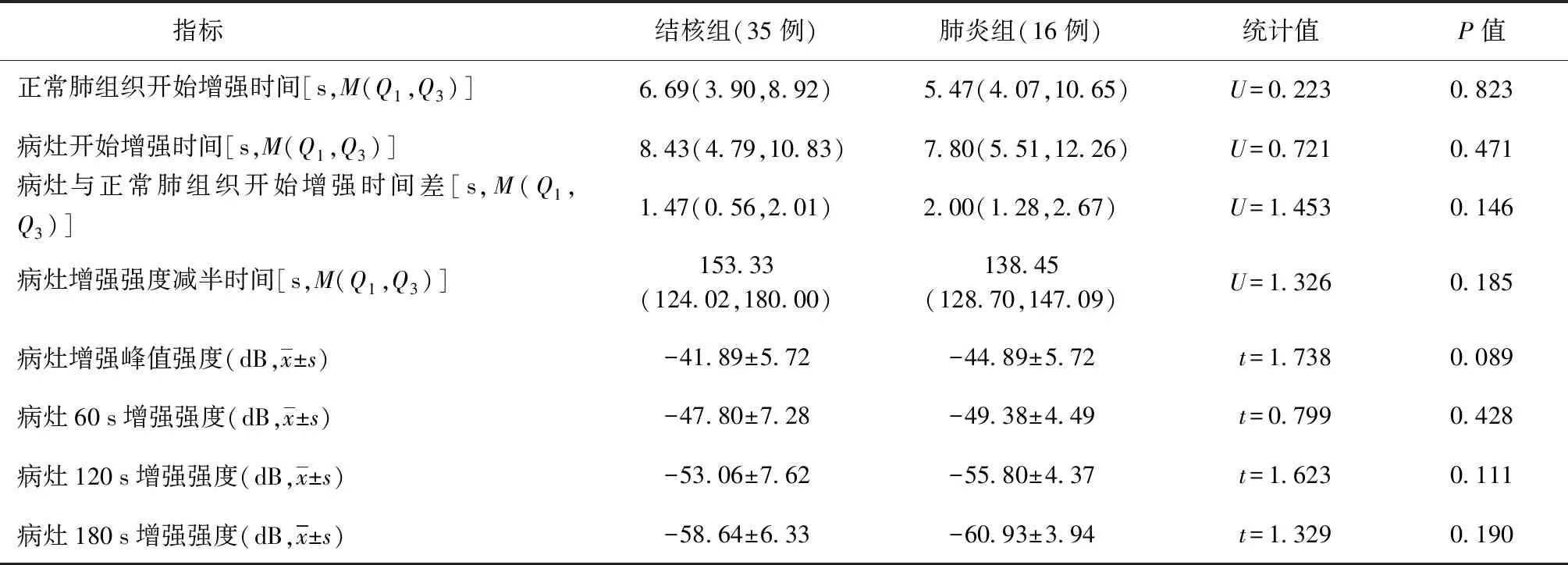
表1 胸膜下肺结核及细菌性肺炎超声造影各项定量指标在两组患者间的比较
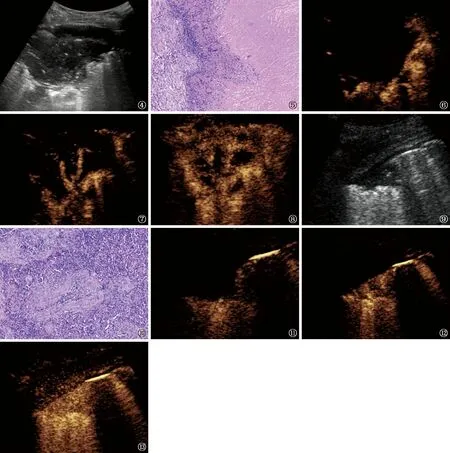
图4~8 浸润性肺结核患者。图4为2019年4月2日在上海市肺科医院进行超声检查,显示胸膜下类圆形病灶,内部呈不均匀低回声,病灶深部与正常含气肺组织形成高回声“碎片征”;图5为2019年4月5日病理报告:镜下可见大片干酪样坏死,伴肉芽肿性炎,疑为结核病(HE ×100);图6~8为当日超声造影图像,显示注射对比剂后5 s周围正常肺组织开始增强,6 s后病灶由肺门向胸膜表面逐级分支增强,呈“枯枝样”,20 s达峰时病灶呈不均匀高增强,内见多个坏死灶,呈“筛孔样”改变 图9~13 肺炎链球菌性肺炎患者。图9为2019年2月22日在上海市肺科医院进行超声检查,显示胸膜下楔形低回声病灶,病灶后方与正常含气肺组织形成高回声“碎片征”;图10为2019年2月27日病理报告:镜下细支气管充血水肿,细支气管、周围肺泡腔内充满渗出物,疑为细菌性肺炎(HE ×100);图11~13为当日超声造影图像,显示注射对比剂后6 s周围正常肺组织开始增强,8 s后病灶开始从肺门向胸膜呈离心样增强,25 s达峰时病灶呈均匀高增强,无坏死区域
本研究结果表明,病灶深部与正常肺组织间的回声特征、坏死区发生率和坏死区表现等特征对疾病的诊断具有一定的指导意义。与恶性病变的膨胀性、侵袭性生长方式不同,良性感染性病变呈炎性浸润性生长,利用细支气管等天然管道逐渐扩散,故形成的病灶形态多为楔形,与支气管树形状相符。但由于细菌性肺炎的发病较急,病程较快,侵及范围较大,又常常利用肺泡间孔进行横向扩散,因此病灶与后方含气肺组织交界处常有未完全发生渗出实变的过渡带,其间可见多发的边缘不规则、形态杂乱、层叠出现、后方伴彗星尾征的小碎片样高回声,即“碎片征”。而肺结核病灶的进展多呈慢性病程,除浸润性的楔形病灶外还偶有类圆形的膨胀性生长表现,这与其病理改变如肉芽肿增生等相关,因此其病灶深部与正常肺组织间除“碎片征”外,还可观察到边缘规整、后方伴彗星尾征的 “瀑布征”高回声。病灶深部与周围肺组织间的回声改变等细微特征,对鉴别诊断可起到一定的作用。
在增强模式方面,结核病灶除了良性病变共有的从肺门向胸膜表面逐级分支的离心型增强模式外,还有部分表现为从外周向中心蔓延的向心型增强模式。这一模式多见于类圆形病灶,长期慢性的炎性增生诱导了新生血管形成是这一现象的主要原因,其中胸壁血管向肺部病灶的逆向供血多见。这些新生血管多表现为晚增强[15],与新生血管的来源不同、结构异常、迂曲走行且管径较细有关,因此其增强与正常肺组织增强的同步性减低。
当结核病灶增强强度达到峰值时,坏死区的形态可以得到充分显示。初期表现为多发的、散在分布的、不连续的筛孔样和小片状坏死区[16],与结核病灶初期的渗出性病理改变相关。随着病程延长,病灶坏死区逐渐扩大、融合,形成大片状坏死,病灶内仅存主干血管,表现为 “残存血管征”[14]。当坏死区继续扩大,主干血管也被破坏后,就形成了仅残留活性边缘的环状增强。相比之下细菌性肺炎的坏死灶较少,范围也较小,这与其感染渗出的病理特征有关;另外,细菌感染的临床表现较为明显,可以得到较早的诊断和治疗,减少了发生大片坏死的概率。
综上所述,肺结核常规超声可见病灶后方的“瀑布征”,超声造影显示坏死发生率高,且主要表现为筛孔样及大片状坏死区,可出现残存血管征、环状增强等特征表现;细菌性肺炎常规超声显示病灶后方多呈“碎片征”,超声造影显示坏死发生率低,坏死区域较小且形态较规则,可为两者的鉴别诊断提供依据。
本研究样本量较小,且未与CT表现进行细致的对比分析,因此观点的准确性尚需扩大样本量做进一步论证。另外,本研究肺炎组仅1例肺炎克雷伯杆菌性肺炎患者超声造影表现为晚增强,与其他良性病灶显著不同,值得进一步研究分析。
志谢:感谢海军军医大学卫生统计学教研室对本文统计学方法的指导。

