微生物发酵法制备富含γ-氨基丁酸的桑叶复合粉
陈佩珊 陈芳艳
微生物发酵法制备富含γ-氨基丁酸的桑叶复合粉
陈佩珊陈芳艳
(华南农业大学动物科学学院广东广州510642)
γ-氨基丁酸(γ-aminobutyricacid,GABA)具有神经传递、降血压、利尿和镇定等生理功能。为了开发富含GABA的桑叶产品,文章在实验室中从桑叶分离筛选到的植物乳植菌SG-5作为发酵菌种,应用于桑叶GABA的发酵富集,以桑叶为主要原料,开展四因素三水平的正交实验,得到最优配方和最优发件条件:最佳配方组合为葡萄糖2 %、蛋白胨8 %、K2HPO42.0 %和L-谷氨酸钠 1.5 %,各配方成分影响主次顺序从大到小依次为葡萄糖>蛋白胨>K2HPO4>L-谷氨酸钠;最优发酵条件为温度为30 ℃,发酵时间36 h,接种量5%,初始含水量60%,各发酵条件影响主次顺序从大到小依次为培养温度、接种量、初始含水量、培养时间。在此最优条件下获得发酵桑叶粉的 GABA含量为31.46 mg/g,蛋白质含量为1.93 mg/g,总糖含量为34.13 mg/g,pH值为5.69。
桑叶粉;γ-氨基丁酸;植物乳杆菌;固态发酵培养
γ-氨基丁酸(γ-aminobutyricacid,GABA)是哺乳动物神经中枢的一种抑制性递质,具有调节血压、促使精神安定、促进脑部血流等作用[1~4]。1959年,Elliott和Hobbiger通过实验证明静脉注射GABA可以使血压下降[5]。而DianaM. 等人的研究结果表明通过饮食富含GABA的功能食品亦可降低和预防高血压[6]。天然的GABA存在于蔬菜和水果等植物当中,但是其含量很低,直接在食品中添加人工合成的GABA,不属于天然产物,应用有条件限制[7~9]。通过微生物发酵的方法来提高食品中GABA的含量是一种有效的途径。可以发酵生产GABA的微生物有细菌、真菌和酵母[10~12 ]。这些菌能产生谷氨酸脱羧酶(GAD),并催化谷氨酸合成GABA。其中乳酸细菌是人和动物胃肠道中正常菌群,不仅具有抗菌、降低胆固醇、抑癌和增强免疫力等重要生物学功能,还可赋予食品特殊的风味,是具有安全性的食品微生物[13]。
桑叶是桑科植物的叶子,桑树在我国种植广泛,生命力极强,资源丰富。桑叶主要作为养蚕,它也是传统的中草药。桑叶作为药食两用资源的记载如《神农本草》《本草纲目》《中华人民共和国药典》均有详细的资料。20 世纪以来,我国及国际上对桑树等药物的有效成分进行大量的研究,明确其活性成分化学结构和药用功能等如黄酮类、多糖类、甾醇类、生物碱等,对这些活性物质治疗糖尿病、高血脂、高血压的疗效进行了深入的研究[14~18 ]。随着医学及相关科学的发展,桑树资源的医用价值也得到进一步拓展。本课题组研究桑叶的过程中发现桑嫩叶的GABA含量较高。在此基础上分离纯化出GABA并且用于灌胃高血压模型鼠,结果表明对高血压大鼠起到降低血压的作用。
为了提高桑嫩叶中GABA含量,达到开发降血压功能保健食品的目的,本研究将从桑叶中筛选分离出高产GABA杆物乳酸菌SG-5应用于桑叶粉的固态发酵的研究,以期低成本获得富含GABA桑叶粉,为今后开发预防和控制高血压的桑叶药食产品提供原料,拓展桑叶在医药卫生、保健食品等领域的新用途。
1 材料与方法
1.1 实验材料
材料:桑叶千目粉;试验菌株:SG-5菌株,从桑叶中分离纯化得到;试剂:GABA标准品购于Sigma公司,色谱纯;MRS培养基;LaCl3,Na2CO3,NaHCO3,KOH等均为市售分析纯。
1.2 实验方法
1.2.1 菌株的活化及扩大培养
取出冷冻的菌种,解冻后,挑取菌于MRS固体培养基上进行划线,于37 ℃恒温培养箱中培养24 h。24 h后MRS固体培养基上长出许多白色菌落,重复2次划线,出现单个菌落。挑取单菌落接入装有10 mLMRS液体培养基的离心管中,于37 ℃恒温培养箱中震荡培养8 h。8 h后离心管底部出现白色混浊,摇匀,按2 %接种量接入50 mLMRS培养基中于37 ℃恒温培养箱中培养8 h至混浊。7~8 h时菌体处于最活跃的状态,故选择接种种龄为7~8 h的SG-5菌加入桑叶粉中进行固态发酵实验。
1.2.2 固态发酵培养基配方
配制固态发酵培养基,以桑叶粉为基质,选择葡萄糖作为碳源,蛋白胨作为氮源,添加K2HPO4和L-谷氨酸钠作为生长因子。以发酵产物中GABA的含量为指标,研究葡萄糖添加量、蛋白胨添加量、K2HPO4和L-谷氨酸钠4个主要因素对固体发酵的影响,进行四因素三水平L9(34)正交试验确定最佳培养基配方。按正交试验设计表1安排实验。以10 g培养基为例,2 %葡萄糖即称量0.2 g葡萄糖加入到培养基中。

表1 正交试验设计
1.2.3 固态发酵条件的确定
发酵条件主要研究初始含水量、菌体接种量、发酵时间和发酵温度对固体发酵的影响,以产GABA的含量为指标,进行四因素三水平L9(34)正交试验确定固体发酵培养的最佳条件。按正交试验设计表2安排实验。
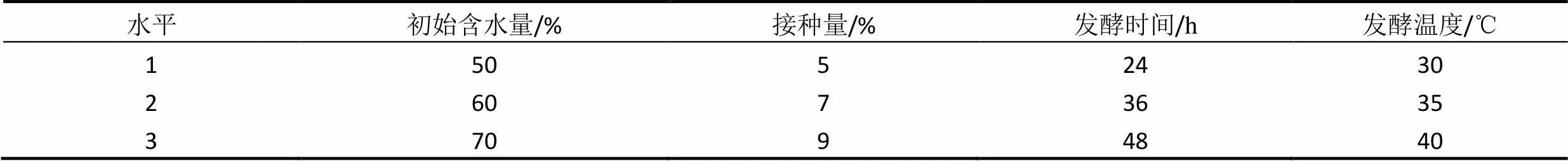
表2 正交试验设计
1.2.4 Berthelot比色法测定GABA的含量
参照陈恒文等的检测方法,以不同浓度的GABA标准样品绘制标准曲线[19]。得到回归方程为y=0.2283 x+0.0072 ,R2=0.9952 。
称取1 g样品,放入50 mL三角瓶中,加入20 mL无菌蒸馏水和适量玻璃珠,在37 ℃恒温培养箱中震荡2 h,转速约为170~220 r/min。将震荡后的浑浊液以8 000 r/min的转速离心10 min,取上清液,测定样品中GABA的含量。
1.2.5 蛋白质含量测定
蛋白质含量的测定按Bradford的方法[20]。以不同浓度的牛血清白蛋白标准样品绘制标准曲线,得到标准曲线公式y=0.8243 x-0.001 ,R2=0.9932 。
称取1 g经过干燥后的样品,加入蒸馏水9 mL,以170 ~190 r/min震荡30 min,过滤取滤液测定蛋白质的含量。
1.2.6 总糖含量的测定
采用蒽酮比色法测定总糖含量[21]。以不同浓度的葡萄糖标准品绘制标准曲线,到标准曲线公式y=0.3178 x+0.0046 ,R2=0.9947 。
称取1 g干燥后样品,加入1.25 % HCL 100 mL,沸水浴2h,过滤取滤液用蒸馏水定容至100 mL备用,加I2-KI以防变色,取滤液测定总糖的含量。
1.2.7 pH值测定
取样品1 g,加蒸馏水9 mL,于摇床上175 r/min震荡30 min,过滤取滤液,用pH仪测定滤液pH值。
2 结果与分析
2.1 确定培养基配方
研究葡萄糖添加量、蛋白胨添加量、K2HPO4和L-谷氨酸钠4个主要因素对固体发酵的影响,每个因素设3个水平,进行四因素三水平L9(34)正交试验,共9组试验号。以发酵产物产GABA的量为指标,实验结果见表3,对结果进行方差分析见表4~表6,确定最佳培养基配方。

表3 培养基配方优化正交实验结果
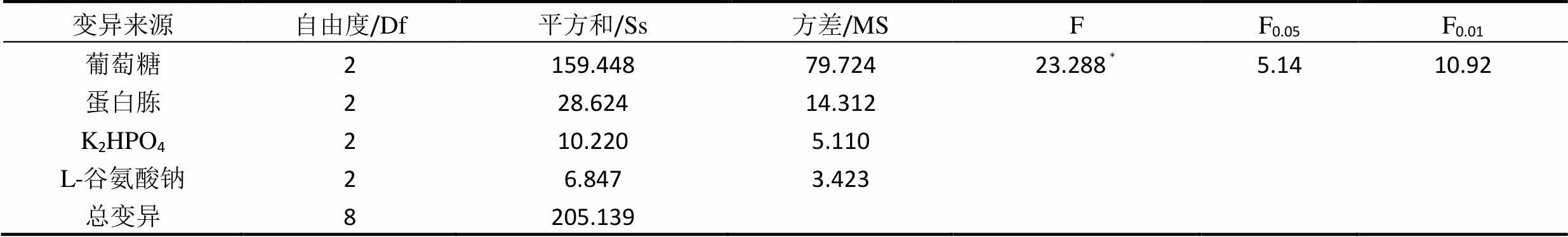
表4 不同配方添加量对GABA产量影响的方差分析

表5 用邓肯氏新复极差法测定葡萄糖添加量显著性梯形表

表6 各成分添加量对GABA产量影响分析
正交试验结果(表4)表明,影响桑叶粉固态发酵配方的主次顺序从大到小依次为葡萄糖添加量、蛋白胨添加量、K2HPO4和L-谷氨酸钠。葡萄糖添加量对GABA产量的影响最为显著,其影响为(见表5):三个水平中葡萄糖增加量与GABA产量成反比。当葡萄糖添加量为2 %时,GABA产量最高,且明显大于添加量为6 %和10 %,葡萄糖添加量2 %时GABA产量的平均值是添加量10 %时的三倍。其次,表6可见蛋白胨添加量对GABA产量的影响也较大,与葡萄糖添加量相反,随着蛋白胨的增加,GABA产量也越来越高。K2HPO4添加量的影响次于蛋白胨添加量,最佳添加量为2.0 %。L-谷氨酸钠添加量的影响最小,添加量在0.5 %和1.0 %时GABA产量并无多大差别。
分析结果得出培养条件的最佳组合为葡萄糖添加量2 %、蛋白胨添加量8 %、K2HPO42.0 %和 L-谷氨酸钠 1.5 %。
2.2 确定发酵条件
研究葡萄糖添加量、蛋白胨添加量、K2HPO4和L-谷氨酸钠4个主要因素对固体发酵的影响,每个因素设3个水平,进行四因素三水平L9(34)正交试验,共9组试验号。以发酵产物产GABA的量为指标,得到实验结果(表7)并进行方差分析,确定固体发酵培养的最佳条件。

表7 发酵条件优化正交试验结果

表8 不同发酵条件对GABA产量影响的方差分析
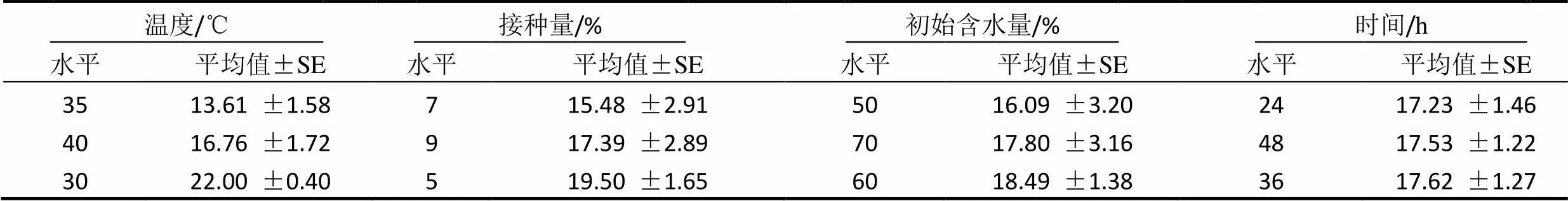
表9 不同发酵条件对GABA产量影响的分析
正交试验(表8)结果表明,四个因素中,对影响桑叶粉固态发酵条件最大的是发酵温度、接种量、初始含水量、发酵时间。表9可见,当发酵温度设定为30 ℃时,GABA产量明显比发酵温度设定为35 ℃和40 ℃时高,30 ℃的GABA平均产量几乎是35 ℃时的两倍。其次,接种量对GABA产量的影响也较大,接种量与GABA平均产量不成线性关系。接种量为5 %时,GABA产量最高。初始含水量的影响次于接种量,最佳添加量为60.0 %。发酵时间的影响GABA产量最不显著,GABA产量平均值差别不大。
分析结果得出固态培养基配方的最佳组合:发酵温度为30 ℃,发酵时间为36 h,接种量5 %,初始含水量60 %。
2.3 发酵产物主要成分及pH值测定
发酵后的桑叶粉细粉末呈棕绿色,较松软,散发出发酵酸菜的气味,而发酵液气味较清香。对富含 γ-氨基丁酸桑叶粉发酵产物中的主要成分进行测定,测出在最佳配方及最佳培养条件下产GABA的量为31.46 mg/g,而未发酵桑叶粉产 GABA的量为2.77 mg/g,最佳条件下GABA的产量比未发酵前提高了近11 倍。发酵产品蛋白质含量为1.93 mg/g,总糖含量为34.13 mg/g,发酵产品的pH为5.69 。
3 讨论与结论
自从出现微生物发酵法生产GABA,最常用的菌种有乳酸菌和大肠杆菌,通常利用乳酸菌生产较安全,大肠杆菌通常与基因工程相结合进行改造,生产GABA有一定的风险;其次为酵母菌、曲霉菌等[22]。据研究,以酵母菌为菌株,在对其发酵特性的研究基础上,菌株的 GABA质量浓度为指标开展研究,培养基配方优化后,菌株的 GABA质量浓度提高了近 4 倍,达到 3.63 g/L[23]。李科等发现植物乳杆菌 UL-4显示出良好的耐酸耐胆盐特性;在肠道具备一定的粘附和定植能力;菌株有良好的抑菌特性,尤其是金黄色葡萄球菌,抑菌圈达到15.77 mm;UL-4还具备对胆固醇和甘油三酯的降解能力,降解率分别为 73.23%和 19.11%[24]。可用来开发功能性的食品。本实验以实验室分离到的SG-5植物乳杆菌株发酵桑叶粉,探讨发酵条件对GABA产量的影响。
满足菌体生长的培养基需具备碳源,氮源以及生长因子,选择了葡萄糖和蛋白胨作为碳源,氮源,以便SG-5菌株产生更多GABA。足够量的K2HPO4无机盐可保证菌体正常的生长代谢,L-谷氨酸钠是发酵过程中GABA生成的底物,也可为菌体生长提供氮源。添加少量L-谷氨酸钠,发酵液中GABA也随之增长。这几种物质的含量并不是越多越好,当添加的量超过菌体所需,就会起反效果,抑制菌体生长影响产量。固态发酵时,GABA含量随着菌体的生长进行合成。菌体生长对初始含水量需求较高,含水量低不适合菌体的生长。当菌体进入生长平衡期,发酵产物GABA会被菌体自身利用而导致含量降低。发酵温度及接种量控制不好则影响菌体的生长,从而影响GABA的产量。
最佳发酵配方为:以桑叶粉为基质,葡萄糖添加量2 %、蛋白胨添加量8 %、K2HPO42.0 % 和L-谷氨酸钠1.5 %。最优培养温度为30 ℃,培养时间为36 h,接种量5 %,初始含水量60 % 时。在最佳配方和最佳发酵条件下桑叶 GABA的产量为31.46 mg/g,而未发酵桑叶粉 GABA含量为2.77 mg/g,最佳条件下GABA的产量比未发酵前提高了近11倍。发酵产品蛋白质含量为1.93 mg/g,总糖含量为34.13 mg/g,发酵产品的pH为5.69。
[1]Nakagawa T,Yokozawa T,Kim HJ,et al.Protective effects of gammaaminobutyric acid in rats with streptozotocin-induced diabetes[J].J Nutr Sci Vitaminol,2005,51:278–282.
[2]Watanabe H,Suzuki A,Goto M,et al.Tissue-specificestrogenic and non-estrogenic effects of axenoestrogen,nonylphenol[J].J Mol Endocrinol,2004,33:243–252.
[3]Chih Y K,Hong-Ting V L,Guo J T.Gamma-aminobutyricacid production in black soybean milk by Lactobacillus brevis FPA 3709 and the antidepressant effect of the fermented product on a forced swimming rat model[J].Process Biochem,2013,48:559–568.
[4]Pouliot-Mathieu K,Gardner-Fortier C,Lemieux S,etal.Effect of cheese containing gamma-aminobutyric acidproducing lactic acid bacteria on blood pressure in men[J].PharmaNutrition ,2013,1:141–148.
[5]Elliott KAC,Hobbiger F.Gamma aminobutyricacid:circulatory and respiratory effects in different species; reinvestigation of the anti-strychnine action inmice[J].Journal of Physiology,1959;146:70–84.
[6]Marina D,Alba T ,Joan Q ,et al.Spanish cheese screening and selection of lactic acid bacteria with high gamma-aminobutyricacid production[J].LWT - Food Sci Technol,2014,56:351-355
[7] Kim J Y.,Lee M Y.,Ji G E.,et al.Production of gammaaminobutyricacid in black raspberry juice during fermentation by Lactobacillusbrevis GABA100[J].Int J Food Microbiol,2009,130(1),12-16
[8] Li H,Cao Y.Lactic acid bacterial cell factories for gammaaminobutyricacid[J].Amino Acids,2010,39(5):1107-1116.
[9] Li H,Qiu T,Huang G,et al.Production of gammaaminobutyricacid by Lactobacillus brevis NCL912 using fedbatch fermentation[J].Microbiology Cell Factories,2010(9):85.
[10] Hudec J,Kobida L,Canigova M,et al.Production of gamma-aminobutyric acid by microorganisms from different food sources[J].J Sci Food and Agri,2015,95(6),1190-1198.
[11] Kono I,Himeno K.Changes in gamma-aminobutyric acid content during beni-koji making[J].Biosci Biotech Bioch,2000,64(3),617-619.
[12] Hao R,Schmit J C.Cloning of the gene for glutamate decarboxylase and its expression during conidiation in Neurospora crassa[J].Biochemi J,1993,293(3):735-738.
[13]湛剑龙,胡萍,陈韵,等.功能性乳酸菌的应用研究[J].食品安全质量检测学报,2014,5(4):1002-1009.
[14]Zhang Y,Ren C,Lu G,ea al.Anti-diabetic effect of mulberry leaf polysaccharide by inhibiting pancreatic islet cell apoptosis and ameliorating insulin secretory capacity in diabetic rats[J].Int Immunopharmaco,2014,22:248-257.
[15]Park E,Lee S,Lee J,et al.Anti-inflammatory activity of mulberry leaf extract through inhibition of NF-jB[J].J funct foods,2013,5:178-186.
[16]Vichasilp C,Nakagawa K,Sookwong P,et al.Development of high 1-deoxynojirimycin (DNJ) content mulberry tea and use of response surface methodology to optimize tea-making conditions for highest DNJ extraction[J].LWT - Food Sci Technol,2012,45:226-232.
[17]Shin S,Seo H,Park H,et al.Effects of mulberry leaf extract on blood glucose and serum lipid profiles in patients with type 2 diabetes mellitus:A systematic review[J].Eur J Integr Med,2016,8:602–608.
[18]Ali A,Ali M.Isolation and structure elucidation of a new linoleiyl glycoside and flavones from the stem bark of Morus alba L.[J].Future J Phar Sci,2016,2:82-86.
[19]冀宪领,盖英萍,陈恒文,等.桑叶中γ- 氨基丁酸含量的测定及其影响因素的研究[J].蚕业科学,2007,33(2):176-180.
[20]Bradford M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[21]毕颖.蒽酮比色法测定大豆乳清废水中总糖含量[J].大豆科技,2006,(3):24-25.
[22]王志超,杨平平,王燕,等.微生物发酵法生产γ-氨基丁酸的研究进展[J].中国调味品,2015,40(11):115-119,127.
[23]胡艳宇,赵红梅,王锦茹,等.新型γ-氨基丁酸发酵培养基配方优化[J].中兽医医药杂志,2016,35(05):40-41.
[24]李科,俞兰秀,刘小雨,等.γ-氨基丁酸改善睡眠作用机制的研究进展[J/OL].食品工业科技.http://kns.cnki.net/kcms/detail/11.1759.TS.20190306.1640.090.html.
10.3969/j.issn.2095-1205.2019.05.01
广东省科技计划项目(2017A020208044);国家农业部公益性行业(农业)科研专项(201403064)。
陈佩珊(1994-),女,广西玉林人,2015级蚕学本科生。
陈芳艳,博士,副教授,硕士导师。
S888.2
B
2095-1205(2019)05-01-05

