三角褐指藻GPAT生物信息学及表达差异分析
尹 航 袁岚瑛 俞 凯 章 丽 石 慧 王何瑜 龚一富,∗
(1宁波大学海洋学院,浙江宁波 315832;2宁波大学法学院,浙江宁波 315211)
生物柴油是从动植物油脂、废弃油脂等可再生能源中提取的一种环境友好型燃料,因其具有性能良好、燃烧持续时间长、颗粒物排放量低等优点而引起人们的广泛关注[1]。三角褐指藻( Phaeodactylum tricornutum)为硅藻门的单细胞真核生物[2],因其生长速度快、光合作用强且油脂含量高(约占细胞干重的20%~30%)可作为一种良好的生物柴油原料[3]。
藻类植物和种子植物中的油脂主要以三脂酰甘油(triacylgilcerol, TAG)的形式存在,因此藻体中TAG 的含量与藻体的含油量密切相关[4]。甘油-3-磷酸酰基转移酶(glycerol-3-phosphate acyltransferase, GPAT)是藻类TAG 生物合成过程中的第1 个限速酶[5],主要负责将脂肪酰基从酰基-酰基载体蛋白或其辅酶A 上转移至甘油-3-磷酸的sn-1 位点合成1-酰基-sn-甘油-3-磷酸(溶血磷脂酸)。因此,GPAT 在藻类的油脂合成过程中具有重要作用[6]。此外,GPAT 与植物的抗逆性也存在相关性,在植物抵抗高温[7]、低温[8-9]等非生物胁迫过程中发挥着重要作用。
研究表明,光照强度和温度可调控相关基因的表达量,并能影响微藻中脂类物质的含量[10-11]。因此,光照强度和温度可作为促进藻体内脂类物质合成的关键非生物因素。近年来对于GPAT 基因的研究主要集中于陆生植物[12-14],而关于三角褐指藻GPAT 在不同光照强度和温度下基因表达量和油脂含量的应答研究尚未见报道。本试验在三角褐指藻转录组测序的基础上对三角褐指藻GPAT(PtGPAT)进行生物信息学分析,利用不同光照强度和温度处理三角褐指藻,通过实时荧光定量PCR (quantitative real-time PCR, RTqPCR)分析该基因表达量差异并探究藻体内脂质的相应变化情况,以期为新型能源材料的应用以及植物抗逆分子机制方面的研究提供一定的理论依据。
1 材料与方法
1.1 三角褐指藻培养
本研究所用的三角褐指藻由宁波大学海洋生物工程重点实验室微藻室提供。取过滤且高温灭菌完毕的海水,以体积比1 ∶1 000 加入灭菌的培养基母液,培养基母液配方参照蒋霞敏等[15]的方法,以体积比1 ∶10接入三角褐指藻。三角褐指藻在光照强度为37.5 μmol·m-2·s-1,温度为25℃,光照周期为16 h 光照/8 h黑暗的条件下培养。培养2 d 后,分别对三角褐指藻施加光照强度分别为0、12.5、37.5 和62.5 μmol·m-2·s-1的光照处理以及15、20、25 和30℃的温度处理[16-17],其他条件不变,每处理设3 次生物学重复。
1.2 三角褐指藻总RNA 的提取及转录组测序
收集处于对数生长期的藻液80 mL,4℃、5 000 r·min-1离心10 min,按照RNAiso plus [TaKaRa(大连)有限公司] 说明书提取三角褐指藻总RNA,使用PrimeScriptRTReagent Kit [TaKaRa(大连)有限公司]进行cDNA 合成。设3 次生物学重复,样品经检验合格后送至杭州联川生物科技有限公司进行测序。
由转录组测序结果获得三角褐指藻GPAT 全长序列,其开放阅读框(open reading frame,ORF)长度为1 305 bp,所使用的上游引物和下游因为分别为gpat-F(5′-ATGATCGATTTCCGTCGGAACGC-3′)和gpat-R(5′-CTAGGCCTGATCCGTCGTTGTCG-3′),以三角褐指藻cDNA 为模板进行PCR 扩增,反应体系为25 μL,扩增程序:94℃预变性4 min;94℃变性30 s,62℃退火30 s,72℃延伸90 s,循环30 次;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳后,切胶回收目的条带,将目的片段与MD18-T 载体进行连接,再转化至DH5α大肠杆菌感受态细胞中,挑取单菌落,进行菌液验证阳性克隆,将阳性克隆送至上海生工生物公司进行测序。
1.3 三角褐指藻GPAT 生物信息学分析
在NCBI 网站(http:/ /www.ncbi.nlm.nih.gov)上查找该基因的ORF,并运用DNAMAN 软件对三角褐指藻GPAT 进行翻译。
通过CBS 网站(http:/ /www.cbs.dtu.dl/)分析三角褐指藻GPAT 蛋白质的转运肽和跨膜结构域。使用ExPASy 在线分析工具(http:/ /cn.expasy.org) 中的Compute Pl/Mw 获得蛋白质理论分子量以及等电点。运用SignalP 确定GPAT 中是否存在信号肽。通过SOPMA 构建GPAT 蛋白质的二级结构,并使用SWISS Model 网站分析GPAT 蛋白质的三维空间结构。通过Clustal X 和Mega 6.0 软件析分保守序列并通过邻接法构建系统进化树。
1.4 三角褐指藻GPAT 表达分析
按照RNAiso plus Rit[TaKaRa(大连)有限公司]说明书提取不同温度和光照强度处理后三角褐指藻总RNA,反转录合成cDNA,用于RT-qPCR 分析。RTqPCR 反应体系包括2×SYBR® Permix Ex TaqTM10 μL,上下游引物各0.8 μL,cDNA 模板2 μL,ddH2O 6.4 μL。反应程序:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸20 s,循环40 次;72℃延伸8 min;16℃保存。以三角褐指藻18S 为内参基因,内参基因上游引物为18S-F (5′-ACCATTATGAAGTTGCGA T-3′),内参基因下游引物为18S-R (5′-ACCCTCCAATT CCAAACAG-3′)。三角褐指藻GPAT 定量引物分别为gpat-dl-F (5′-TGGACCCGTTGGTATTGC-3′)和gpat-dl-R(5′-GTCGTTGTCGGATTGG-3′)。运用2-ΔΔCt法[18]计算基因相对表达量。
1.5 三角褐指藻总脂含量测定
使用改良的Bligh-Dyer 法[19]测定三角褐指藻的总脂含量。分别取不同光照强度和温度处理后的三角褐指藻藻液于50 mL 离心管中,4℃、4 000 r·min 离心20 min,冷冻干燥2 d。称取0.25 g 藻粉溶于含有25 mL 甲醇、12.5 mL 氯仿以及10 mL 50 mmol·L-1K2HPO4(pH 值7.4)缓冲液的混合溶液中,震荡1 h,继续加入12.5 mL 氯仿和12.5 mL 50 mmol·L-1K2HPO4(pH 值7.4)缓冲液,混匀,静置分层。取下层溶液,使用氯仿定容至10 mL。取5 mL 定容液于铝碟中,60℃烘干至恒重,计算差重。
1.6 数据统计与分析
采用SPSS 22.0 统计软件分析不同温度和光照强度下三角褐指藻GPAT 表达量与总脂含量的相关性。
2 结果与分析
2.1 三角褐指藻GPAT cDNA 序列分析
采用高通量转录组测序分析获得了三角褐指藻GPAT 基因cDNA 序列。为验证转录组获得的GPAT 序列的准确定,本研究采用RT-PCR 技术扩增三角褐指藻GPAT 的ORF 序列并送至测序分析,其测序结果与转录组测序结果一致。三角褐指藻GPAT 基因cDNA 全长1 743 bp,含有一个长度为1 305 bp 的ORF,编码434 个氨基酸(图1)。通过Vector 多序列比对获得3 个保守序列区,分别为NHD(S/T)EADP(Q/A)、PFSMGRNL(Ⅰ/L/F)C 和(L/Ⅰ)W(Ⅴ/Ⅰ)APSGGRDR(图2)。

图1 三角褐指藻GPAT 全长序列及编码氨基酸序列Fig.1 Full-length and encoded amino acid sequence of GPAT in P. tricornutum

图2 三角褐指藻GPAT 氨基酸多序列比对Fig.2 Multi-sequence comparison of GPAT amino acids in P. tricornutum
2.2 三角褐指藻GPAT 理化性质分析
ExPASy 分析结果显示,三角褐指藻GPAT 的分子式为C1651H2685N465O512S13,理论等电位点为6.22。该蛋白正电荷残基为37,负电荷残基为41,预测不稳定指数为41.75,为不稳定蛋白。三角褐指藻GPAT 氨基酸组成中主要为Ala 和Leu,其中Ala 所占比例约为9.8%,Leu 所占比例约为9.6%。Signal 4.1 Serve 预测结果表明,三角褐指藻GPAT 蛋白不存在信号肽。利用SOPMA 软件对三角褐指藻GPAT 的二级结构进行预测,结果表明该蛋白主要结构为无规则卷曲(random coil),占43.24%,其次为α 螺旋(alpha helix),占28.50%,延伸链(extended strand)占20.88%,β 转角(beta turn)占7.37%。
利用SWISS Model 在线预测分析GPAT 空间结构(图3),发现三角褐指藻GPAT 含有的高度保守区域[(V/I/L)(W/Y)(V/I)APSGGRDR]为LPLATs 基因超级家族酶类的催化活性区(溶血磷脂酰基转移酶),其酰基结合位点(putative acyl-acceptor binding pocket)位于第221~第229、第263 ~第274 和第311 ~第321氨基酸处,其作用为将脂肪酰转移到3-磷酸甘油的C-1 位点上合成溶血磷脂酸(1-酰基-sn-甘油-3-磷酸)。
2.3 三角褐指藻GPAT 系统进化树构建
运用NCBI 检索三角褐指藻GPAT 氨基酸序列相似性,发现多种植物GPAT 氨基酸序列与三角褐指藻GPAT 氨基酸序列的相似性介于40%~68%之间。其中圆柱拟脆杆藻GPAT 氨基酸序列与三角褐指藻GPAT 氨基酸序列相似度最高,为68%,其次为大洋洲海藻链和单胞菌海链藻,分别为55%和53%。而三角褐指藻GPAT 与其他类型的植物的相似性较低,表明该基因在进化过程中会发生变化,在不同生物中GPAT 编码的蛋白可能会存在较大差异。
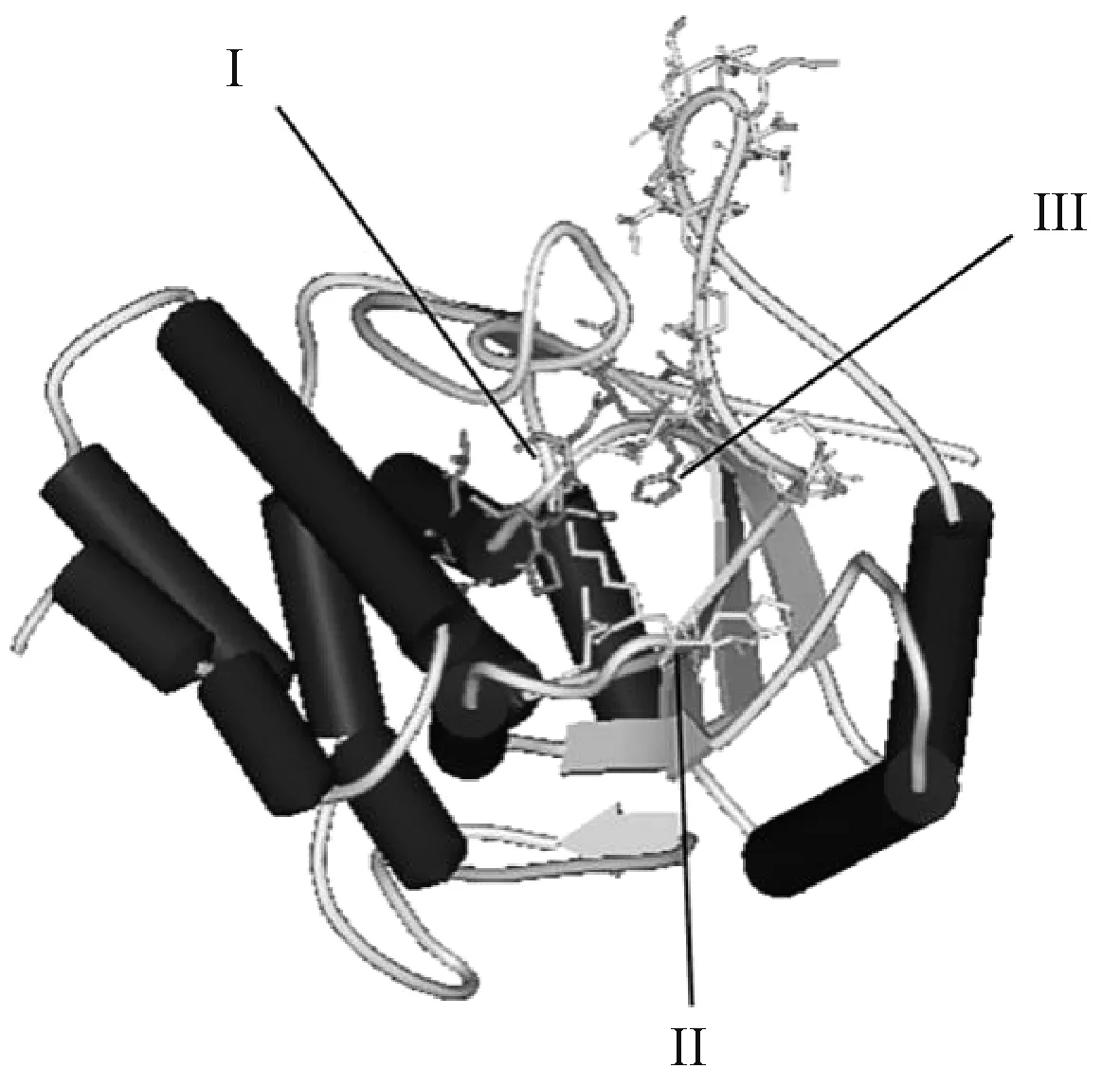
图3 三角褐指藻GPAT 空间结构预测Fig.3 Prediction of spatial structure of GPAT in P. tricornutum
利用Clustal X 以及Mega 6.0 软件构建系统进化树,由图4 可知,进化树主要分为2 支,亚麻芥、白芍、麝香百合、油棕、苹果、麻风树、树形棉和黄瓜聚为一支,三角褐指藻、软克里藻、绿藻、新型微藻、假丝酵母和大洋洲海链藻聚为另一支。其中,大洋洲海链藻GPAT 与三角褐指藻GPAT 的亲缘关系最近。
2.4 光照强度和温度对三角褐指藻GPAT 基因表达水平和总脂含量的影响
由图5 可知,三角褐指藻GPAT 相对表达量随着光照强度和温度的升高均呈先上升后下降的变化趋势。20、25、30℃处理的三角褐指藻GPAT 相对表达量均极显著高于CK,25℃时,三角褐指藻GPAT 相对表达量达到最大值,是CK 的11.46 倍,而随着温度进一步的升高,三角褐指藻GPAT 表达量呈下降趋势(图5-A)。三角褐指藻GPAT 相对表达量在光照强度为37. 5μmol·m-2·s-1时达到最大值,为CK的1. 39倍,而在62.5 μmol·m-2·s-1强光处理下三角褐指藻GPAT表达受到抑制,表达量约为CK 的40%(图5-B)。

图4 三角褐指藻GPAT 系统进化树Fig.4 Evolution tree of GPAT system of P. tricornutum

图5 不同温度(A)和光照强度(B)下三角褐指藻GPAT 的相对表达量Fig.5 Relative expression of GPAT in P. tricornutum under different temperature(A) and illumination intensity(B)

图6 不同温度(A)和光照强度(B)下三角褐指藻的总脂含量Fig.6 Total lipid content of P. tricornutum under different temperature(A) and illumination intensity(B)
由图6 可知,三角褐指藻总脂含量随着温度和光照强度的升高也呈先上升后下降的趋势,总脂含量均极显著高于CK。其中,在温度为25℃,光照强度为37.5 μmol·m-2·s-1时,三角褐指藻总脂含量分别达到最大值,分别为CK 的2.14 倍(图6-A)和1.58 倍(图6-B)。
相关性分析结果表明,三角褐指藻GPAT 表达量与总脂含量在不同温度条件下具有显著相关性(r=0.980, P<0.05),而在不同光照强度下相关性不显著(r=0.087, P>0.05)。虽然三角褐指藻GPAT 的表达水平随着光照强度的变化与藻体中总脂含量的变化并不完全一致,但随着光照强度和温度的升高,基因表达量与脂质含量呈先上升后下降的趋势表现出高度的一致性。
3 讨论
本研究发现三角褐指藻GPAT 含有1 个高度保守的LPLATs 基因超级家族酶类的催化活性区,陈丽静等[20]在毛百合GPAT 中也发现1 个该超家族酶类的保守区域,该区域常含有酰基结合位点,可与CoA 或者ACP 上的酰基结合,在参与1-酰基-sn-甘油-3-磷酸的合成中起重要作用,进而证实了本研究经转录组测序获得的PtGPAT 基因即为三角褐指藻GPAT 基因。
本研究通过比较三角褐指藻与其他植物GPAT 氨基酸序列相似性发现,三角褐指藻GPAT 基因序列与其他物种相似性较低。Misra 等[21]研究表明,藻类和种子植物GPAT 之间的序列相似性较低,但二者间却存在高度保守的结构域。系统进化树构建结果显示,三角褐指藻与大洋洲海链藻的亲缘关系较近,与亚麻芥、白芍等被子植物亲缘关系较远,此结果与传统进化分类结果一致,表明在进化过程中,藻类PtGPAT 逐渐分化,最终形成独立的进化分支[22]。而藻类GPAT 基因在进化水平的关联性可归因于谱系之间的基因水平转移[21]。刘聪等[23]研究表明,植物GPAT 基因存在多个基因家族成员,且不同基因家族成员之间的进化距离存在较大差异,而关于三角褐指藻GPAT 基因家族各成员之间亲缘关系的比较还有待进一步深入研究。
在真核生物中,TAG 作为中性脂质是能量的关键储存形式和生物柴油生产的主要原料,有研究表明,微藻中的TAG 积累通常与环境胁迫相关,如光照强度、高温、氮限制和盐度[24-25]。石娟等[26]研究表明,等边金藻(Isochrysis galbana)和小新月菱形藻(Nitzschia closterium f. minutissima)在低光照强度下可积累较多的脂类物质。而张泽凌等[27]研究光照强度对大龙骨藻(Tropidoneis maxima)总脂含量的影响发现,强光环境有利于大龙骨藻总脂含量的积累,且在光照强度为80 μmol·m-2·s-1时藻体内总脂含量达到最大值,表明不同光照强度下微藻体内总脂含量存在差异。本研究表明,随着温度和光照强度的升高,三角褐指藻体内总脂含量呈先升高后降低的趋势,与前人研究一致。Aaronson[28]研究表明,高温或低温条件均会导致藻体内的酶发生不可逆损伤,进而导致脂类物质合成受限,而不同种类的微藻在脂类物质积累的最适温度存在差异。周连宁等[29]研究表明,小球藻(Chlorella vulgaris)的总脂含量随温度的升高呈先上升后下降的趋势,且在25℃时达到最大积累量,此结果与张桂艳等[30]的报道类似。而本研究中,当温度达到30℃时脂类含量仍保持在较高水平,表明30℃时并不能使脂质物质相关合成酶完全失活,只能使其活性较25℃时减弱。
Ayawardhane 等[31]认为,GPAT 可参与膜脂、包外脂质和储存TAG 等多种脂质物质的合成。Misra等[32]研究表明,麻疯树GPAT 的下调导致种子油含量相对于野生型减少12%,而拟南芥中麻疯树GPAT 的异源表达使其种子含油量增加了13%~20%。Fukuda等[33]指出,在单细胞红藻(Cyanidioschyzon merolae)中过量表达GPAT 可使藻体内TAG 含量增加56.1 倍。GPAT 作为植物甘油脂合成途径中的第1 个限速酶,因对不同底物的选择性差异而影响着类囊体甘油脂的含量、饱和程度[9]。本研究对不同光照强度和温度处理后的三角褐指藻GPAT 进行表达调控分析,结果表明,随着光照强度和温度的上升,三角褐指藻GPAT 的表达量均呈先上升后下降的趋势。推测,在温度和光照强度升高初期,由于光强和温度对三角褐指藻内关键酶产生影响,适宜的温度和光强导致酶活性增强,从而加快了基因的转录翻译与蛋白酶的合成,并加速了藻内脂类合成与代谢。而随着温度和光照强度的升高,三角褐指藻可能通过调控GPAT 的过表达从而提高细胞膜内的总脂含量,最终提高对高温、强光等逆境胁迫的耐受性[34]。但当温度和光照强度持续升高时,不仅酶活性受到抑制,藻细胞的生理活性也会遭到破坏,导致细胞死亡[35]。因此,在温度达到30℃,光照强度达到62.5 μmol·m-2·s-1时,三角褐指藻体内酶活及代谢活动减弱,导致GPAT 表达量和总脂含量均下降。
4 结论
本研究通过克隆获得三角褐指藻的全长GPAT 序列,完成三角褐指藻GPAT 生物信息学分析及表达特征分析。结果表明,随着光照强度和温度的升高,三角褐指藻GPAT 表达量和总脂含量均呈现先上升后下降的趋势,且GPAT 表达量与总脂含量随温度变化呈显著正相关(r=0.980, P<0.05),表明三角褐指藻GPAT可能是其脂类代谢途径的关键基因,光照强度和温度是影响三角褐指藻GPAT 表达和脂质合成的重要因素。本研究为今后利用基因工程手段提高植物体内油脂含量提供了优质的基因资源,同时为进一步揭示三角褐指藻脂类物质合成的分子调控机制奠定了一定的理论基础。

