桑树中miR319的克隆及在雄花发育中表达分析
孙志超 李 娜 谢 岩 杨 帆 高妍夏 高玉军 杨贵明 李季生
(河北省高校特产蚕桑应用技术研发中心/承德医学院蚕业研究所,河北承德 067000)
MicroRNA(miRNA)是一类长度为20 ~24 nt 的内源性、非编码小分子RNA(small RNA,sRNA),通过降解和抑制靶基因表达[1-2],参与植物器官的形态建成[3]、激素应答[4]、营养代谢等一系列生物学过程[5-6]。在植物约20 个保守的miRNA 家族中,miR319 与植物花器官的生长发育密切相关,并参与调控部分植物激素载体蛋白,从而调控植物激素合成及参与重要信号途径[7]。研究表明,miR319 主要靶向于TCP 转录因子,此外,miR319 也能调控一些MYB 转录因子。Nag 等[8]在拟南芥中的研究表明,miR319a 突变体会导致花发育过程中花瓣、雄蕊等缺陷;进一步研究miR319a 与tcp4 突变体中的miR319a 及其5 个靶基因的表达发现,TCP4 基因是miR319a 的5 个靶基因中的主要靶向目标,且miR319a 靶向调控的TCP4 基因表达水平在花发育尤其是花瓣和雄蕊发育中起着关键作用。Palatnik 等[9]研究表明,miR319 调控MYB33和MYB65 转录因子从而影响植物雄蕊育性,miR319a过表达引起雄蕊败育以及雄蕊变短、育性降低等现象,这可能是由于miR319a 过表达导致MYB33 与MYB65降解引起的。Nicolas 等[10]研究表明茉莉酸(jasmine acid,JA)信号途径参与花瓣的生长、雄蕊伸长和花粉成熟。闫志强等[11]研究表明,JA 类植物激素具有诱导禾本科植物颖花开放的功能。Hao 等[12]和Rubiosomoza 等[13]在拟南芥中发现,TCP 转录因子通过调控JA 生物合成关键酶基因LOX 从而控制JA 生物合成。
桑树(Morus alba L.)除用于丝绸业生产外,其叶、嫩枝和根皮已在中国、日本及其他许多国家被广泛运用于药用。随着经济的发展,桑产业正从东南经济发达地区向内陆地区逐步扩大[14]。利用传统育种技术在一定程度上可以筛选出优良林木品种,但很难在短时间内聚合多个优良的目标基因,而利用基因工程技术可以快速提高育种进程[15]。目前,有关桑树miR319 在花发育过程中的应答机制及其靶基因的表达模式研究尚未见报道。本研究基于高通量测序发掘桑树miR319,在川桑基因组中预测miR319 的前体序列及靶基因,采用PCR 技术在桑树物45 中对2 个前体序列进行克隆及测序;利用5′-RACE 对靶基因进行验证;采用RT-qPCR 获取miR319,靶基因及JA 合成关键基因在物45 雄花发育不同阶段表达特征,以期为进一步研究miR319-mRNA 在桑树花发育过程中的机制和功能提供一定的理论依据。
1 材料与方法
1.1 试验材料
以河北省承德市承德医学院蚕业研究所桑园为试验区,桑树品种为物45,从2017年5月26日-6月13日每隔5 d 采集桑树雄花一次,所有样品均来自同一棵树,采集的样品立即置液氮速冻,-80℃保存备用。
1.2 试验方法
1.2.1 雄花材料的固定与石蜡切片 将采集的样品立即放入4%多聚甲醛中固定,4℃过夜(24 h)。然后用酒精、磷酸缓冲液混合液梯度脱水。脱水完成的材料转入二甲苯、酒精混合液(二甲苯∶酒精体积比为1 ∶1)和纯二甲苯进行透明,时间为1 h。透明结束的材料倒去旧的二甲苯,加入石蜡、二甲苯混合液置换,石蜡∶二甲苯体积比为1 ∶1,2 h,将材料转入纯石蜡中浸蜡3 次,每次2 h。材料被切成6 μm 厚度的蜡带,置于专用载玻片上。花芽石蜡切片浸入二甲苯中脱蜡2次,每次处理10 min,乙醇梯度处理。切片用苏木精和伊红染色,然后用乙醇脱水,用100%二甲苯渗透,并用中性树脂覆盖,在BX51T 显微镜(OLYMPUS,日本)下观察并拍照。
1.2.2 RNA 的提取和cDNA 的合成 利用试剂盒(TaKaRa,日本)提取物45 雄花芽总RNA。用Nano Drop ND-2000 分光光度计(Thermo Fisher,美国)检测RNA 的浓度和纯度,琼脂糖凝胶电泳检测RNA 的完整性。按照反转录试剂盒(TaKaRa,日本)说明书合成cDNA。合格的RNA 样品于-80°C 保存备用。
1.2.3 miR319 前体序列克隆与靶基因5′-RACE 验证 miR319 的前体序列使用在线网站RNAfold (http:/ /www.tbi.univie.ac.at/ ~ivo/RNA/ViennaRNA-1.8.1.tar.gz)在川桑基因组中预测,对预测后的结果进行筛选。用Primer Premier 5 软件设计引物(表1),参照PrimeSTAR® HS DNA Polymerase 使用说明扩增前体序列。使用在线网站psRNATarget(http:/ /plantgrn.noble.org/psRNATarget/analysis? function= 3)预测桑树miR319 家族在川桑基因组中的靶基因[16]。利用5′-RACE 技术进行靶基因验证[17],在miR319 与预测到的靶基因互补位点下游设计2 条5′-RACE 下游特异性引物(表1),采用GeneRacer Kit(Invitrogen,美国)在RNA 5′端加上寡核苷酸接头后用Oligo(dT)反转录成cDNA。cDNA 稀释10 倍后利用试剂盒中通用引物和设计的特异性引物对每个基因进行PCR 扩增,扩增产物用快速琼脂糖凝胶DNA 回收试剂盒[生工生物(上海)有限公司]回收,并连接到pMD18-T(TaKaRa,日本),转化到E. coli DH5a 感受态细胞(TaKaRa,日本)中,涂板后37℃过夜培养,挑选单克隆送至上海生工生物有限责任公司测序。
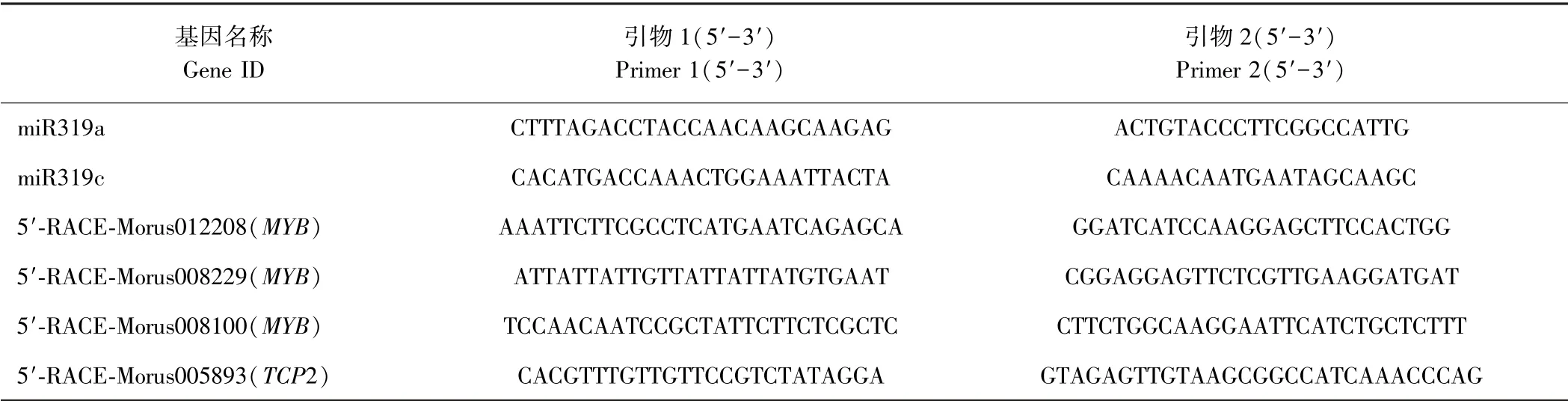
表1 miR319 前体序列克隆与靶基因5′-RACE 引物Table 1 Primer of miR319 precursor sequence and its targets for clone and 5′-RACE
1.2.4 实时荧光定量PCR 采用PrimeScriptTM RT Reagent Kit 试剂盒(TaKaRa,日本)将物45 不同发育阶段雄花芽提取RNA 反转录成cDNA 作为实时荧光定量PCR(RT-qPCR)反应模板。使用颈环法,检测miR319a 的表达,反转录引物为:5′-GTCGTATCCAGTG CAGGGTCCGAGGTATTCGCACTGGATACGACGCACG T-3′。RT-PCR 试剂盒为TaKaRa(日本)公司生产的SYBR Premix Ex TaqTM Ⅱ。以U6 为miRNA 内参基因,以Ribosomal protein L15 为mRNA 内参基因,miR319、靶基因和内参基因各引物序列组成详见表2。相对表达量计算采用2-△△Ct法[18]。
1.2.5 JA 含量的测定 JA 含量采用ELISA 试剂盒(上海仁捷生物有限公司)测定。

表2 基因的RT-qPCR 引物Table 2 List of RT-qPCR primer sequences used for genes
2 结果与分析
2.1 桑树雄花芽组织学观察
组织学分析将花芽发育分为4 个不同的阶段,从顶端分生组织开始到单个小花出现(图1)。相邻发育阶段的间隔时间为5 d。在第一阶段,花芽分生组织由顶端分生组织和一些叶原基组成,为未分化期(A1)(图1-A1)。花序原基开始发育被定义为分化初期(A2)(图1-A2)。花絮长大,为花序分化期(A3)(图1-A3)。在第四阶段花序中可以观察到单个花朵,为总苞形成期(A4)(图1-A4)。
2.2 桑树miR319 前体序列的克隆与分析
在桑树中共预测到3 个miR319 家族成员,分别为miR319a、miR319b 和miR319c。通过序列比对发现miR319b 与拟南芥 miR319a/miR319b 序列一致,miR319a/miR319c 与拟南芥miR319c 在序列的第1 个和最后1 个碱基存在差异(图2-A)。使用PCR 技术对3 个miRNA 前体进行克隆并测序(miR319b 与miR319c 位于同一前体位置上),以物45 总RNA 反转录的cDNA 为模板,结果显示,miR319a 与miR319c 前体扩增分别位于104 bp 与199 bp 位置上。产物连接至PMD18-T 载体进行测序,结果表明miR319a 与miR319c 扩增片段与预测的序列一致(图2-B)。
2.3 miR319 靶基因预测及5′-RACE 技术验证
利用在线网站psRNATarget 预测桑树miR319 家族在川桑基因组中的靶基因。miR319a 预测到6 个靶基因,miR319b 预测到4 个靶基因,miR319c 预测到5个靶基因(图3-A)。使用5′-RACE 技术验证桑树中预测的6 个靶基因,结果显示所预测到的Morus012208(MYB)、Morus008229(MYB)、Morus008100(MYB)和Morus005893(TCP2)4 个靶基因为miR319a 有效靶基因,且切割位点出现在与miRNA 互补序列的第10 ~第11 个碱基之间(图3-B)。
2.4 桑树雄花芽发育过程中JA 含量变化及miR319a 表达分析
采用试剂盒测定JA 在雄花发育过程中的含量变化,JA 在A1-A2 阶段其含量变化不明显,在A2-A4 时期表达水平迅速上升(图4-A)。利用RT-qPCR 技术检测桑树miR319a 在此过程中的表达发现,miR319a在桑树雄花芽发育A1-A2 阶段表达上升,在A2-A4 阶段表达下降(图4-B)。
2.5 桑树雄花芽发育过程中miR319a 靶基因表达分析

图1 花芽发育早期组织学观察Fig.1 Histology of early flower bud development

图2 miR319 成熟体序列比对及前体序列扩增Fig.2 Sequence alignment of the mature miR319 and amplification of miR319 precursor

图3 miR319 靶基因预测及5′-RACE 技术验证Fig.3 miR319 target genes predicted determined by 5′-RACE

图4 桑树雄花发育过程中JA 含量变化(A)及miR319a 表达分析(B)Fig.4 Analysis of JA content(A) and miR319a expression level(B) during male flower development in mulberry
对miR319a 靶基因在雄花发育过程中进行定量分析。结果表明,Morus012208 在A1-A2 阶段表达降低,A2-A4 阶段表达水平呈上升趋势,与miR319a 呈相反的表达模式。Morus008229 在A1-A3 阶段表达水平呈上升趋势,在A4 阶段略有下降。Morus023872 与Morus010305 呈相同的表达模式,均为A1-A2 阶段表达水平上升,A2-A3 阶段表达水平下降,A3-A4 阶段表达水平再次上升,A1-A3 阶段与miR319a 呈现相同的表达模式。Morus008100 与Morus005893 呈现相同的表达模式,均在A1-A2 阶段表达水平下降,A2-A3 阶段表达水平上升,A3-A4 阶段表达水平再下降,A1-A3阶段与miR319a 呈相反的表达模式(图5)。
2.6 桑树雄花芽发育过程中JA 合成关键基因表达分析
RT-qPCR 结果表明,JA 合成关键基因PLDα1 与LOX5 在桑树雄花芽发育A1-A3 阶段表达水平上升,A3-A4 阶段表达水平下降。而AOS 表达水平则呈现A1-A2 阶段上升、A2-A3 阶段下降、A3-A4 阶段上升的波动趋势(图6)。
3 讨论
miRNA 作为基因表达的上层调节因子,其介导的基因沉默在植物花发育过程中发挥着重要的调节作用[19]。有研究表明在山核桃、梅花等植物花芽发育过程中,均能引起内源性miRNA 特定表达[5,20-21]。大量研究表明,miR172 与miR156 对花期的调控作用明显,二者对花型的调控也有一定的作用[22-24]。如miR172在花发育的早期起到关键作用,miR172 抑制AP2 表达,使花瓣数目减少[24]。miR319 及其靶基因TCP 在植物中较保守,miR319 靶向作用TCP4 调控植物花器官的生长发育[8]。
本研究在桑树中共预测到3 个miR319 家族成员(miR319a、miR319b 和miR319c),其中miR319b 与miR319c 位于同一前体位置上,使用PCR 技术验证与所预测的前体序列一致。通过全基因组检索预测到Morus012208、Morus008229、Morus023872、Morus010305、Morus008100 与Morus005893 属于桑树miR319 靶基因,并通过5′-RACE 在桑树物45 中验证miR319 可靶向于 Morus012208、Morus008229、Morus008100 与Morus005893 基因,且切割位点均出现在与miRNA 互补序列的第10 ~第11 个碱基之间。在拟南芥中miR319 切割TCP/MYB 基因位点与桑树中切割位点序列一致,miR319 与靶基因的互补位点及剪切位点在不同物种间保守性较强[25-26]。这种进化的保守性表明,这些作用位点发挥着重要的生物学功能[25,27]。
本研究通过石蜡切片技术判断了桑树雄花发育的4 个关键时期,未分化期(A1)、分化初期(A2)、花序分化期(A3)和总苞形成期(A4)。利用RT-qPCR 发现,在桑树雄花发育花序分化期(A2-A3)miR319 表达明显下 降, 靶基因 Morus012208、Morus008229、Morus008100 和Morus005893 与miR319 表达呈相反的模式,表明miR319 在此阶段负调控靶基因的表达影响桑树雄花花序分化。miR319 靶向基因TCPs 参与JA 合成系统和动态平衡[28]。在拟南芥中TCP 在转录水平上促进或抑制LOX、PLDα1 和AOS 的表达[28]。LOX、PLDα1 和AOS 也是JA 合成系统中的关键基因[29-30]。本研究中LOX5 和PLDα1 在A2 和A3 阶段表达升高,与miR319 靶基因表达趋势一致,表明JA合成关键基因LOX5 和PLDα1 可能受到TCP 的调控。因此,推测miR319 可能通过影响JA 的合成影响桑树雄花花序分化。
4 结论

图5 桑树雄花芽发育过程中miR319a 靶基因表达分析Fig.5 Expression analysis of the targets of miR319a during male flower development in mulberry
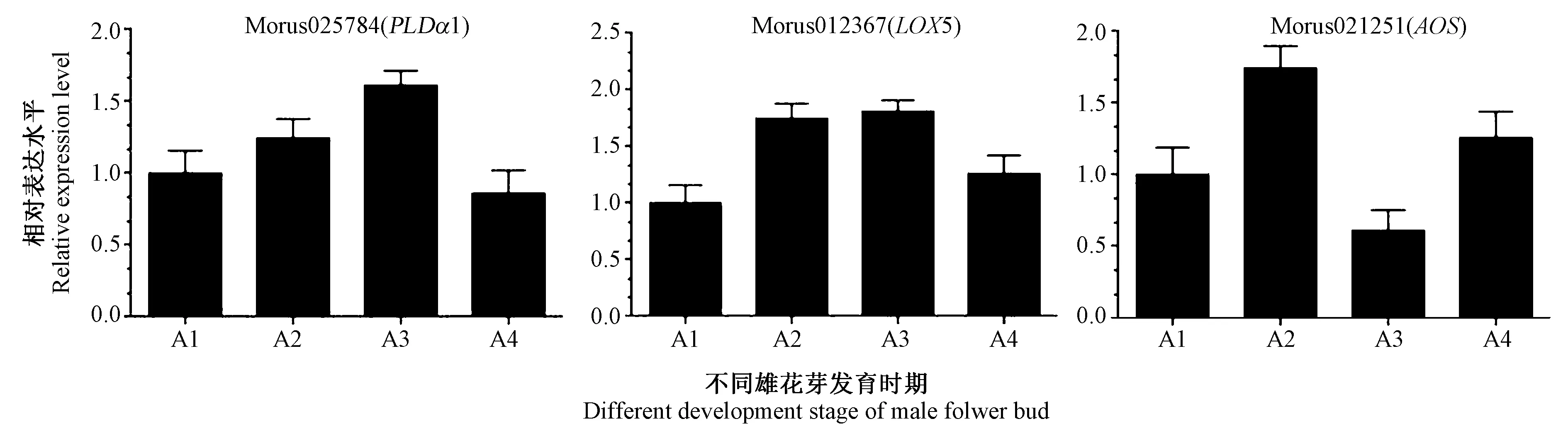
图6 桑树雄花芽发育过程中JA 合成关键基因表达分析Fig.6 Expression profiles of the key genes of JA during male flower development in mulberry
本研究通过生物信息学方法,在桑树中鉴定到3个miR319,并在桑树物45 中克隆了前体序列;对3 个miR319 成员进行了靶基因预测,miR319a 预测到6 个靶基因,miR319b 预测到4 个靶基因,miR319c 预测到5 个靶基因,并采用5′-RACE 技术鉴定到了4 个基因( Morus012208、Morus008229、Morus008100 与Morus005893)为其有效靶基因。利用RT-qPCR 技术分析miR319 及6 个靶基因的表达模式,在雄花发育A2-A3 阶段,miR319a 表达水平迅速降低,靶基因Morus012208、Morus008229、Morus008100 和Morus005893表达水平迅速升高,JA 合成关键基因LOX5 和PLDα1表达水平升高,JA 含量也迅速升高。表明,在桑树雄花花序分化过程中miR319 可能通过调控靶基因影响JA 含量来行使生物学功能。本试验结果为桑树miR319 在雄花发育过程中的作用机制的研究提供了一定的理论依据。

