小麦矮秆突变体DC20的转录组分析
刘 晴 古佳玉 赵紫伟 赵林姝 郭会君 谢永盾 宋希云 刘录祥,∗
(1青岛农业大学生命科学学院,山东青岛 266109;2中国农业科学院作物科学研究所/国家农作物基因资源与基因改良重大科学工程/国家农作物航天诱变技术改良中心,北京 100081)
研究表明,降低株高是矮秆基因功能的具体体现,引起植株矮化的机制较复杂,涉及因素广泛,其中植物激素在植物生长发育的不同阶段发挥着重要作用[1]。六大类植物内源激素中,生长素类(auxin,IAA)、赤霉素类(gibberellins,GAs)、细胞分裂素类(cytokinins,CTK)、油菜素甾醇类(brassinosteroids,BRs)属于生长促进剂,乙烯(ethylene)和脱落酸(abscisic acid,ABA)属生长抑制剂[2-3]。不同激素的调节功能存在差异,如IAA 是最早发现的植物激素,其具有促进营养生长过程中的胚芽鞘和茎生长,抑制根生长,维持顶端优势等生理作用[4]。GAs 为四环二萜类化合物,分为C19GAs 和C20GAs 两大类,目前已有超过136 种不同形式赤霉素的结构和性质被确定,如GA1、GA3等[5],其在种子萌发、节间伸长、开花、结实等生长发育过程中发挥着重要的调控作用[6-10],且GAs 对茎秆伸长的调节作用效果显著[11-12],因此植物体内活性GAs 含量的动态平衡至关重要。ABA 作为生长抑制剂可通过阻止细胞壁酸化和细胞伸长,进而抑制胚芽鞘、胚轴、嫩枝等器官的伸长生长[13]。
此外,植物体中各激素间存在交互作用,如GA3能促进内源IAA 含量提高,同时使用GA3和IAA 较单一激素更能显著促进植物节间伸长[14-15]。研究表明,当GAs 或BR 的信号传导受阻或生物合成受到抑制时,植株表现为矮化[1];蔡鹏[16]研究发现IAA 或某些基因的不正常表达也会导致少数植株矮化。前人通过研究与激素代谢密切相关的矮化突变体,明确了基因突变是致矮的主要因素。此外,研究发现GAs、IAA、BR 等激素合成相关基因的突变会导致植物体内源激素动态平衡紊乱以及激素信号传导发生突变,中断正常信号通路会导致植株矮化[1]。
小麦(Triticum aestivum L.)作为世界三大主要粮食作物之一,其产量和消费量约占世界谷物的30%,贸易量约占世界谷物的45%,株高是决定小麦产量的重要因素,矮秆抗倒伏是小麦育种的主要目标性状之一[17]。目前小麦矮秆基因较单一化且遗传背景狭隘,仅有农林10 号的Rht-B1b、Rht-D1b 和赤小麦的Rht8在育种中被广泛利用,小麦产量和育成品种的遗传多样性不能满足考种需求[18]。因此,发掘新的矮秆基因和矮源材料是当前小麦矮化育种的主要目标。
育种过程中常用的矮秆基因大多是通过自发突变和物理或化学诱发突变产生。诱发突变技术通过提高诱变率,诱发产生自然界稀有或一般方法较难获得的新类型、新性状或新基因,加速育种进程,为选育突破性新品种创造条件[19]。据不完全统计,全世界已通过物理、化学等诱变技术,在粮食作物、经济作物、蔬菜、花卉等164 种植物上育成2 500 多个突变品种和数万份突变资源[20]。突变体DC20 是D6-3(wide type,WT)经北京正负电子对撞机实验室通过高能混合粒子束模拟次级宇宙射线,构成高能混合粒子辐射场处理后选育获得的株高稳定降低、植株株型紧凑、抗倒伏、丰产性能好,而产量与WT 无差异的矮秆植株。
转录组是特定生理或发育阶段条件下,细胞整套转录本的集合,通过转录组学分析,不仅能挖掘到基因组功能要素,而且可以揭示组织或细胞内分子成分与生物学进程,进而阐释植物的发育与病理机理[21]。目前RNA-Seq 数据分析在研究植物特异突变、特定发育时期、生物与非生物胁迫等方面应用广泛,如曹桦等[22]通过转录组学分析研究了铁皮石斛叶色突变体的形成机理,但目前关于小麦矮秆突变体转录组学研究报道尚不常见。本研究通过对矮秆突变体DC20 及其WT 进行转录组测序与比较分析,筛选差异表达基因,以期为小麦突变体DC20 矮化的分子机理研究提供一定的理论依据。
1 材料与方法
1.1 试验材料
矮秆突变体DC20 是高秆亲本D6-3(WT)经185 Gy 的高能混合粒子场处理筛选所得。突变体DC20和WT 于2013年10月均种植于中国农业科学院作物科学研究所中圃场实验基地,行长2 m,行距30 cm,株距6 cm,常规田间管理,DC20(62.13 cm)成熟期的株高较WT(76.35 cm)极显著下降了18.6%。

图1 野生型(WT)与突变体DC20 株高表型性状Fig.1 Phenotypic trait of plant height from wild type(WT)and the mutant DC20
取孕穗期的WT 和突变体DC20 茎秆材料,各样品均设3 次生物学重复,取样后立即置于液氮中并在研钵中充分研磨至粉末状,准确称取50.0 mg 干粉置于2.0 mL 的硬质塑料管中(AXYGEN,USA),-80℃保存备用。
1.2 试验方法
1.2.1 文库的构建和测序 按照plus 植物总RNA 提取试剂盒[天根生化(北京)科技有限公司]操作说明书提取RNA。分别用Nanodrop 2000 微量紫外分光光度计(美国赛默飞世尔有限公司)、1%琼脂糖凝胶电泳和Agilent 2100 芯片生物分析仪(美国安捷科技有限公司)检测RNA 的浓度和完整性。1.9 ≤OD260/OD280≤2.1;OD260/OD230≥1.8;RIN≥6.5 被认为是质量合格的样品,可用于文库的构建。按照Illumina Gene Expression Sample Prep Kit(百迈客生物科技有限公司)说明书构建cDNA 文库并进行质控检测,然后用Illumina HiSeqTM2000 进行转录组双端测序。
1.2.2 转录组数据分析 使用In-house perl 脚本处理测序产出的原始数据,去除含有接头、poly-N 及低质量reads 后获得高质量clean reads(有效读长),并对Q20、Q30、GC 含量以及重复序列水平进行统计;将上述高质量clean reads 与小麦中国春参考基因组(IWGSC1_popseq.31 版本)进行比对,应用Tophat2 工具进行精准匹配,达到100%匹配或仅有1 个碱基错配的reads,才可用于后续功能注释分析。使用BLAST软件(Version 2.2.26)将获得的通用基因(Unigene)序列与NCBI non-redundant protein sequences (NR)、Protein family ( Pfam )、UniProt/Swiss-Prot、Gene Ontology(GO,http:/ /www.geneontology.org)、Clusters of Orthologous Groups of proteins(KOG/COG,http:/ /www.ncbi.nlm.nih gov/COG/)和Kyoto Encyclopedia of Genes and Genomes(KEGG,http:/ /www.genome.jp/kegg/)数据库进行比对,并根据基因在不同样品或样品组中的表达量进行差异表达基因功能注释的分析。
1.2.3 激素含量的测定 将冷冻茎秆干粉样品送至北京林业大学化学实验室,采用LC-MS/MS 法检测孕穗期WT 和DC20 茎秆内激素GA1、GA3、IAA 和ABA的含量,利用Logit 曲线换算激素浓度(ng·mL-1)后,再计算各样品激素含量(ng·g-1FW)。
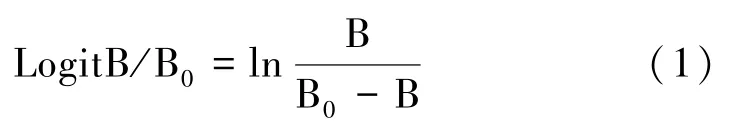
式中,Logit 表示各浓度显色值,B 代表各浓度的显色值,B0代表0 ng·mL-1孔的显色值。
1.3 数据统计与分析
通过FPKM 数值对基因表达水平进行定量分析,对有生物学重复的样品, 利用DEGseq R 软件(1.10.1)进行差异表达分析统计,本研究中阈值为Pvalue≤0.01 和|log2fold changes|≥1 的基因即为显著差异表达基因。
2 结果与分析
2.1 转录组数据分析
2.1.1 基因组装分析 利用Illumina HiSeq 高通量测序平台对已构建好的6 个cDNA 文库进行测序,产出22 300 297~37 909 000 不同数目的clean reads;每组材料的GC 含量均基本呈随机分布且无偏差;通常质量控制参数Q30>80%表示测序质量非常可靠,本试验中Q30>86.56%表明测序数据质量高,建库理想。将匹配上的reads 使用Trinity 进行组装,将其在各大数据库中进行基因功能注释,发现所有的Unigenes 在COG、GO、KEGG、Swiss-Prot、NR 中注释条目较多,且长度分布在1 000 bp 以上,表明测序产出质量较高,所得基因功能注释条目数较多,可用于后续矮秆突变体中差异表达基因的挖掘及对矮化分子机制的相关代谢途径的探讨。
2.1.2 差异表达基因统计分析 将WT 与突变体DC20 转录组数据进行差异分析,通过FPKM 值和以|log2fold changes|≥1,阈值P-value≤0.01 为筛选条件查找差异表达基因并进行聚类分析。由图2 可知,WT与DC20 间的差异基因有2 153 个(上调基因425 个,下调基因1 728 个)。

图2 分组差异表达基因聚类分析Fig.2 The cluster of differentially expressed genes in different groups
2.1.3 差异表达基因功能注释和富集分析 对差异表达基因在各个数据库进行功能注释,GO 富集表明差异基因主要集中在细胞进程(cellular process)(80.63%)、新陈代谢(metabolic term)(72.73%)、单一生物进程(single-organism process)(73.77%)、刺激反应(response to stimulus) (57.39%)、生物调节(biological regulation)(48.61%)及其他信号传递、生长等生物学过程中;差异基因主要分布在细胞内成分(intracellular components) (90.40%)、细胞(cell)(87.69%)、细胞器内成分(cell component)(79.91%)以及膜成分(membrane component)(41.59%);分子功能主要包括结合(binding)(61.24%)和催化反应活性(catalytic activity)(51.11%)等功能(图3-A)。
由COG 注释可知差异基因多集中在通用功能预测( general function prediction only, R ) ( 761,16.77%), DNA 复制、重组和修复( replication,recombination and repair,L)(458, 10.09%),转录调控机制(transcription,K)(412,9.08%),信号转导机制(signal transduction mechanisms,T)(333,7.34%),转录后修饰、蛋白转运与分子伴侣(posttranslational modification, protein turnover, chaperones,O) (296,6.52%),翻译、核糖体结构与生物合成(translation,ribosomal structure and biogenesis,J)(293,6.46%)和细胞周期调控、细胞分裂、染色体分离(cell cycle control,cell division, chromosome partitioning,D)(201,4.43%)等功能条目上(图3-B)。
KEGG 注释表明,差异基因主要富集在苯丙酸生物合成( phenylpropionic acid biosynthesis) (145,11.09%)、淀粉和蔗糖的代谢(starch and sucrose metabolism) ( 88, 6.73%)、苯 丙 氨 酸 代 谢(phenylalanine metabolism)(88,6.73%)、植物激素信号转导(signal transduction of plant hormones) (81,6.20%)等通路(图3-C)。
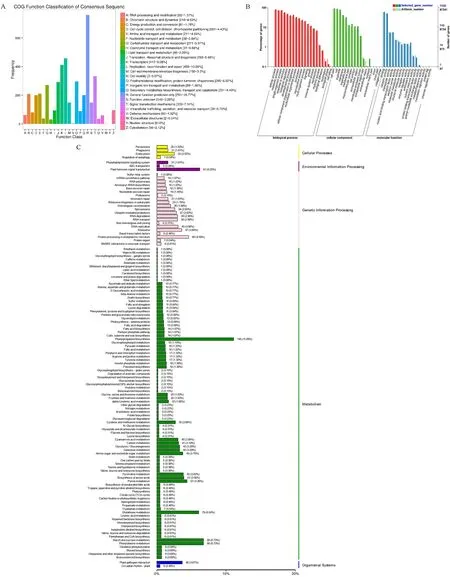
图3 WT 和DC20 间差异表达基因注释分类统计图Fig.3 The classifications of DEGs between WT and DC20
进一步对差异基因进行生物学进程分析,发现植物激素的信号转导(signal transduction of plant hormones)和细胞分裂(cell division)、细胞生长调节(cell growth regulation pathways)通路的所有基因均为下调(图4)。
2.1.4 差异表达基因注释数据挖掘分析 结合NCBI数据库中已有的通路信息,发现矮秆突变体DC20 中与植物激素信号转导相关的差异基因几乎都下调表达(表1)。
调取赤霉素合成通路所有已知合成酶基因与基因序列,与数据进行比对,找到了CPS、KS、KO、KAO、GA20ox 相关基因。其中赤霉素生物合成途径的早期合成酶基因CPS、KS、KO 的表达量均下调,与内源赤霉素含量下降的结果一致(表2)。GA20ox 是赤霉素合成通路中的主要反馈调控节点,在突变体DC20的转录组中GA20ox 的上调可能与反馈调控相关。

图4 WT 和DC20 在不同细胞进程中差异表达基因数Fig.4 The number of DEGs in different cellular processes between WT and DC20
2.2 激素含量分析
由表2 可知,WT 中各内源激素含量均明显高于DC20,其中WT 中GA1和IAA 含量显著高于突变体DC20,WT 中的GA3含量极显著高于DC20,WT 中的ABA 含量与DC20 差异不显著,表明DC20 株高的降低可能与GAs 和IAA 含量降低有关。

表2 赤霉素合成途径的差异表达基因Table 2 DEGs in gibberellin synthesis pathway

表3 小麦茎秆内不同激素含量Table 3 Results of different hormone content in wheat stalk
3 讨论
内源激素作为植物体内的“第一信使”,可介导植物体不同生长和发育过程,贯穿整个生命周期,对植物生长发育和生理活动调节具有重要作用[23]。在调节植物发育过程中,激素可通过调控细胞分裂和细胞长度达到控制株高的目的[24-25]。GH3 家族(GH3.1、GH3.2、GH3.5、GH3.6、GH3.17)编码生长素酰胺合成酶,促使植物体内冗余的IAA 与氨基酸结合形成IAA-氨基酸复合物,从而维持植物体内IAA 的动态平衡,促进植株生长发育[26-28]。而SAUR 基因的诱导表达抑制了植株生长,导致突变体呈现矮化表型[29]。IAA5是一类生长素快速响应因子,具有生长调节作用[30]。本研究中突变体DC20 中的GH3、IAA 和AUX1 等生长促进因子表达下调,而抑制因子SAUR 表达上调,表明生长素的动态平衡调节以及信号转导途径,是影响细胞周期调控和细胞伸长的关键因素,与前人研究一致。
大量研究表明,GAs 生物合成酶基因的缺失可导致植株出现叶色加深、茎秆短粗、开花延迟等变异,施加外源GA3可部分恢复株高、花期等表型[31-32]。Yamaguchi 等[33]对拟南芥和水稻进行研究,结果表明植物体内源GAs 的生物合成途径的早期合成酶包括古巴焦磷酸合酶(copalyl pyrophosphate synthase,CPS)、内根-贝壳杉烯合成酶(kaurene synthase,KS)、内根-贝壳杉烯氧化酶(kaurene oxidase,KO)和内根-贝壳杉烯酸氧化酶(kaurene acid oxidase,KAO)4 类。前体牻牛儿基二磷酸(geranylgeranyl pyrophosphat,GGDP)被上述4 类酶催化合成GAs 前体GA12,此生物途径已在小麦中被鉴定[34-35]。本研究中突变体DC20的CPS、KS、KO 和KAO 的编码基因均下调表达,与激素鉴定中GA1和GA3含量降低的结果一致。拟南芥突变体ga1、ga2 和ga3 由于分别缺失了CPS、KS 和KO 活性,内源GAs 合成停留在早期合成途径,活性GAs 严重缺失,导致植株出现雄性不育和严重矮化的突变表型[36-38]。突变体DC20 中CPS、KS、KO 和KAO的编码基因虽然都下调表达,但内源GA1和GA3的缺失并不严重,因此仅表现出半矮生的突变表型,育性几乎不受影响。内源GAs 生物合成途径的晚期合成酶包括催化活性GAs 生成的GA20ox 和GA3ox,以及催化活性GAs 失活的GA2ox。晚期合成酶兼具反馈调控的功能,植物有机体通过抑制或激活其活性来调节内源GAs 的动态平衡[39]。本研究中突变体DC20 内源GA1和GA3含量降低,GA20ox 的上调表达正好符合反馈调控机制。由此可见,突变体DC20 的矮化表型与内源GAs 的合成调控密切相关,但是具体调控机制还有待进一步研究。
4 结论
本研究通过运用转录组学分析表明,参与细胞周期调控和细胞伸长的差异表达基因在矮秆突变体DC20 中下调表达;参与生长素动态平衡调节、信号转导和赤霉素生物合成的基因在DC20 中下调表达,相关抑制因子则上调表达。辐射诱变产生的突变,主要通过调控植物激素合成及信号转导途径来影响细胞周期调控和细胞伸长,最终产生DC20 的矮化表型。下一步可对DC20 突变性状基因进行定位,并克隆该基因。本研究结果为阐明矮秆突变体形成的分子调控机理研究奠定了一定的理论基础。

