β-氧化石竹烯对Hela细胞诱导凋亡的初步研究1
郑 倩,周菊丽,宋冠华,廖建良
(惠州学院 生命科学学院,广东 惠州 516007)
β-氧化石竹烯属于倍半萜烯类化合物,它是番石榴叶的挥发油成分之一[1],同时也是青蒿、艾叶、沉香等植物挥发油中含量较高的一种精油成分,在化妆品和食品工业中广泛应用.关于倍半萜的研究,一直是天然产物化学成分研究中较为活跃的领域,同时也是寻找和发现天然药物生物活性成分的重要来源[2].以往的研究证明β-氧化石竹烯具有抗血小板聚集的活性[3]以及镇痛和抗炎[4]、抗真菌[5]等作用,此外,它的抗癌活性也被发现,能作为一种有效抗癌药物在部分肿瘤细胞系中表现出细胞毒性[1,6-8]. 虽然β-氧化石竹烯对肿瘤细胞的毒性以及一些分子机制已有研究报道,但该药物对不同细胞存在抑制显著性差异同时在不同细胞中抑制增殖的机制也不同.因此本实验我们通过对β-氧化石竹烯在四种肿瘤细胞增殖中的影响进行比较,筛选出了极显著抑制效果的宫颈癌Hela细胞,并初步从分子水平进行了凋亡研究,为β-氧化石竹烯在宫颈癌治疗中的可能作用提供研究基础.
1 实验材料
1.1 试剂
β-氧化石竹烯(98%)和DMSO购自Sigma公司,DMEM高糖液体培养基和无支原体胎牛血清购自Gibco公司,双抗、MTT、胰酶消化液、BCA蛋白浓度测定试剂盒均购自碧云天生物技术研究所.Annexin-FITC/PI双染凋亡检测试剂盒购自杭州联科生物技术有限公司,β-actin、Bcl-2、Bax和P53抗体购于北京中杉金桥生物技术有限公司,辣根过氧化物酶标记的羊抗兔和羊抗鼠二抗购于Takara公司.
1.2 细胞培养
A375、Hela、Hep-2和LOVO四种细胞系由华南师范大学转赠.A375和Hela细胞系的培养基为加1%双抗和10%FBS的DMEM完全培养基,LOVO细胞系和Hep-2细胞系的培养基为加1%双抗和10%FBS的F12K完全培养基.
2 方法
2.1 细胞增殖测定
对数生长期的四种肿瘤细胞分别接种到96孔板中,待细胞贴壁后,移去旧培养基,加入含有不同浓度β-氧化石竹烯的新鲜培养基,继续培养24 h或48 h后,每孔加入20 μL 的0.005 mg·L-1MTT溶液,孵育4 h,弃上清,100 μL DMSO加入到每孔中,继续37℃暗培养15 min后,570 nm下测定每孔的OD值.每个浓度设4个重复,并以完全培养基为空白对照.
2.2 AO/EB荧光染色
对数生长期Hela细胞以2×105个/孔的密度接种在6孔板中,待贴壁后使用32 μM浓度的β-氧化石竹烯处理48 h,消化并离心收集细胞,加入95 μL完全培养基将细胞悬浮,同时加入5 μL AO/EB混合液,吸取20 μL的细胞悬液于干净载玻片上,盖上盖玻片,荧光显微镜下观察.
2.3 细胞凋亡检测
对数生长期Hela细胞接种到6孔板中,β-氧化石竹烯处理48 h后,离心收集细胞,PBS洗涤两次,弃上清,加入500 μL结合缓冲液重悬细胞,再加入5 μL AnnexinV-FITC和10 μL PI,混匀后室温下避光孵育15 min,尽快进行流式细胞仪检测.
2.4 蛋白免疫印迹
β-氧化石竹烯处理Hela细胞48 h后,离心收集并裂解细胞提取蛋白,BCA蛋白浓度测定试剂盒测定后,根据标准曲线按每孔40 μg蛋白计算蛋白上样量.Western blot检测蛋白表达情况.
2.5 统计学分析
所有实验进行三次重复,统计学分析采用t检验,显著性由*P<0.05,**P<0.01表示.
3 结果
3.1CPO对肿瘤细胞增殖的影响
MTT法检测不同浓度β-氧化石竹烯分别处理四种肿瘤细胞A375、Hela、Hep-2、LOVO 24 h和48 h后细胞增殖的变化,图1A和1B结果显示,在实验浓度范围内,β-氧化石竹烯对四种肿瘤细胞都有不同程度的抑制作用,且48 h处理组相比24 h处理组抑制作用更明显.
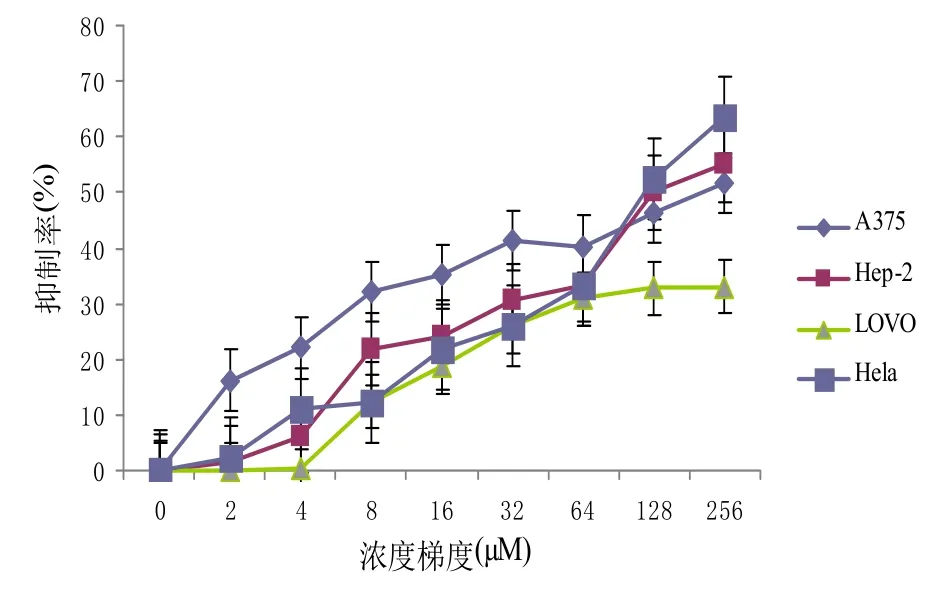
图1 A CPO处理24 h后的细胞抑制率
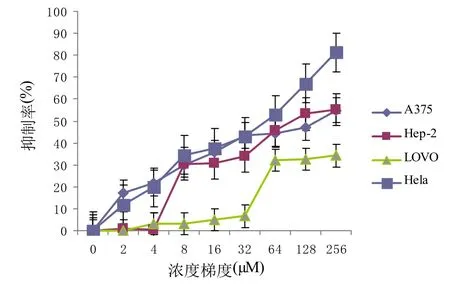
图1 B CPO处理48 h后的细胞抑制率
表1中的IC50结果显示,四种肿瘤细胞经过48 h处理后Hela细胞对β-氧化石竹烯最为敏感,IC50为37.08±0.25μM.

表1 CPO处理48 h后的各细胞的半抑制浓度(IC50)
3.2 CPO对肿瘤细胞形态的影响
采用倒置光学显微镜对浓度为32 μM β-氧化石竹烯处理48 h前后Hela细胞的形态进行检测,结果显示经过药物处理的细胞出现变圆皱缩的形态变化.AO/EB的染色结果显示,未处理的正常细胞呈现出均匀的绿色荧光,而经过药物处理后的细胞则出现较明亮的黄绿色或橘红色荧光,表明细胞出现了一定程度的凋亡(图2).
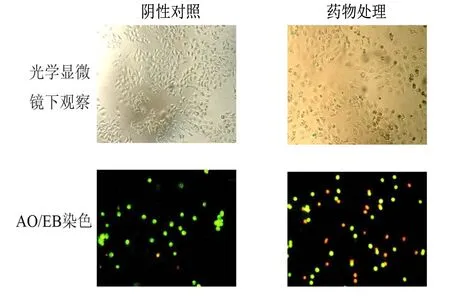
图2 β-氧化石竹烯处理Hela细胞48 h后AO/EB荧光染色结果
3.3 CPO对细胞凋亡的影响
通过流式细胞仪检测了经过β-氧化石竹烯处理48 h后的细胞凋亡率变化情况,从图3可以看到β-氧化石竹烯处理后,随着处理浓度的上升,细胞凋亡率也随之升高,表现药物浓度依赖性.
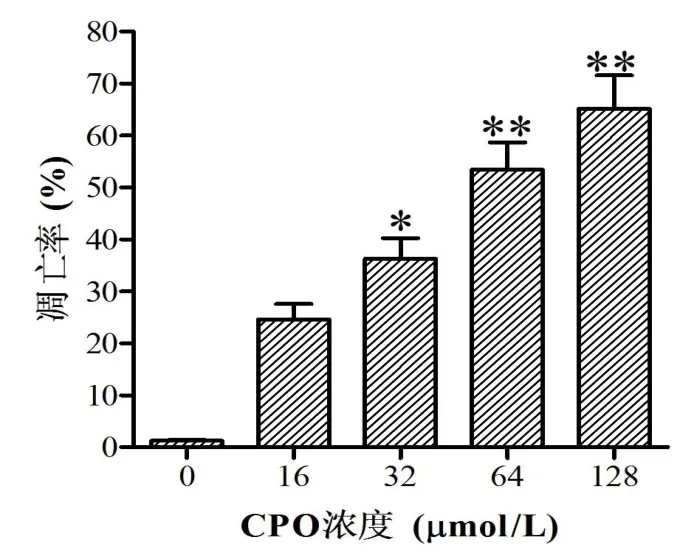
图3 β-氧化石竹烯处理Hela细胞48 h后细胞凋亡率的变化
3.4 CPO对凋亡相关基因表达的影响
Western blot对与凋亡密切相关的三种蛋白Bax、Bcl-2和p53的表达水平进行检测,结果显示经过β-氧化石竹烯处理48 h后促凋亡蛋白Bax和p53的表达水平均随着药物处理浓度的升高而上调;凋亡抑制蛋白Bcl-2则随着药物浓度的升高而下调.这一结果表明β-氧化石竹烯能够影响凋亡相关蛋白的表达水平从而引起细胞出现凋亡反应(图4).
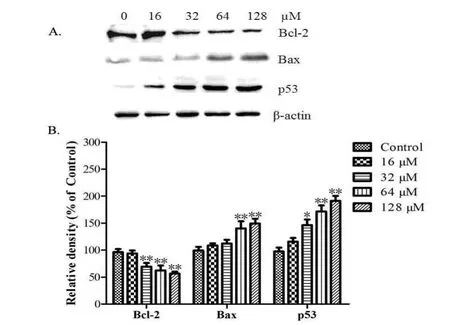
图4 β-氧化石竹烯处理Hela细胞48 h后蛋白表达的变化
4 讨论
目前,寻找新的高效且低毒副作用较小的抗癌新药是癌症研究者们的研究热点[9].在自然界中部分植物含有广泛的天然活性成分,且部分成分具有高效低毒、多靶点、特异性强等多重作用,已逐渐获得了广大研究者们的青睐[10].β-氧化石竹烯虽然在一些肿瘤细胞中表现出抗肿瘤活性,但鉴于药物本身的特异性以及细胞敏感性差异,本研究选择β-氧化石竹烯作用于A375、Hela、Hep-2、LOVO四种细胞,以筛选出抑制效果更好的细胞种类.MTT法是检测药物对细胞增殖影响的常用方法.实验结果显示β-氧化石竹烯对四种不同细胞有选择性抑制效果,可以在48 h处理下显著抑制宫颈癌Hela细胞的增殖,这表明β-氧化石竹烯具有作为抗宫颈癌药物的潜在可能性.
肿瘤细胞能够持续的分裂增殖,因此,通过诱导癌细胞凋亡来减少癌细胞过度增殖积累以达到治疗癌症的目的成为目前抗癌研究的重要方向.而细胞发生凋亡往往伴随着一系列形态上的变化,比如经过AO/EB染色时,细胞若发生早期凋亡会导致AO透过细胞嵌入细胞核DNA发生较明亮的绿色荧光,其强度高于正常细胞的染色效果,而在凋亡晚期AO和EB均能进入细胞核嵌入DNA,从而出现黄绿色或橘红色的荧光[11].从我们得到的结果可以看出,相比正常细胞的染色,β-氧化石竹烯处理的细胞经过AO/EB染色后出现黄绿色或橘红色的荧光,这说明细胞经过β-氧化石竹烯处理后可能发生了凋亡反应.流式细胞术的检测结果进一步证明β-氧化石竹烯处理48 h确实能引起细胞浓度依赖性的凋亡,与形态变化结果一致.在细胞凋亡反应中往往涉及到一些内在分子的调控,其中就包括Bax、Bcl-2和p53三种蛋白.Bcl家族成员在细胞凋亡中起着重要作用,而成员Bax和Bcl-2又分别为正负调控因子.当细胞内Bcl-2蛋白升高时,凋亡趋势减弱;而当细胞内Bax蛋白升高时,能够通过引起线粒体通透性改变、细胞色素c释放等激活线粒体凋亡途径来促使细胞发生凋亡.因此,二者的蛋白比例变化对细胞凋亡调节起关键作用[12].实验结果显示在经过β-氧化石竹烯处理48 h后细胞内的Bax和Bcl-2表达水平药物依赖性的分别上调和下调,导致Bax/Bcl-2的比例升高,从而促使细胞发生凋亡.p53蛋白作为转录调节因子,可以通过调控Bax/Bcl-2,Fas/Apol,IGFBP3等凋亡相关蛋白表达完成对细胞凋亡的调控作用[13].Western blot的结果显示p53蛋白的表达量同样在药物浓度依赖性的上调,从而通过上调Bax的表达水平,以及下调Bcl-2的表达以激活线粒体凋亡途径来完成促进细胞凋亡的作用.
总之,本研究在细胞水平上检测了β-氧化石竹烯对四种肿瘤细胞增殖影响,明确了其对宫颈癌Hela细胞的选择性抑制效果,并初步对β-氧化石竹烯在Hela细胞凋亡中的作用进行了研究,而更具体的内在分子调控机制还有待进一步研究.

