不同促排卵方案对小鼠卵巢颗粒细胞凋亡的影响
陈艳婷,王玉林,袁秋虹,邓伟民,郭新宇 *
(1.中国人民解放军南部战区总医院中西医结合科,广州 510010;2.广州中医药大学,广州 510405;3.广州中医药大学顺德医院内三科,佛山 528333)
随着IVF-ET的发展,促排卵技术作为IVF-ET的关键环节也趋向多样化、个体化发展。促排卵技术主要是在外源性的人为激素的干预下,通过增强或改善卵巢自身的内分泌及排卵功能,以获取多个卵母细胞,为提高IVF-ET的成功率创造机会。但促排卵过程中,非生理剂量促性腺激素的运用,最终导致体内的雌激素超出生理水平[1],高于生理水平的雌激素是否影响卵泡及胚胎质量还未得出一致结论[2]。卵泡是卵巢的基本结构和功能单位,在卵泡发育成熟过程中,颗粒细胞的增殖、分化对卵泡的发育有着重要的作用。颗粒细胞的凋亡可抑制卵母细胞及卵泡的发育,促进卵泡闭锁。因此,本研究模拟临床不同促排卵方案建立小鼠模型,通过观察不同促排卵方案对小鼠卵巢颗粒细胞凋亡的影响,以探讨不同促排卵方案对卵泡质量的影响。
材料与方法
一、药物、试剂与仪器
醋酸曲普瑞林注射液(GnRH-a,辉凌,瑞士);注射用醋酸西曲瑞克(GnRH-ant,Pierre Fabre,法国);注射用血促性素(PMSG,Prospecbio,以色列);人绒毛膜促性腺激素(HCG,珠海丽珠医药)。兔抗小鼠Fas抗体(ab82419,Abcam,英国),兔抗小鼠FasL抗体(af0157,Affnity Biosciences,美国),兔抗小鼠Caspase-8抗体(ab25901,Abcam,英国),兔抗小鼠Caspase-3抗体(bs-0081R,北京博奥森),山羊抗兔鼠通用二抗(GK500705,上海基因,),包埋机(JB-P5,武汉俊杰电子),病理切片机(RM2016,上海徕卡仪器),倒置荧光显微镜(NIKON ECLIPSE TI-SR,尼康,日本)。
二、研究方法
1.实验动物及分组:SPF级KM雌性小鼠40只,6~8周龄,体重20~25 g(实验动物由中国人民解放军南部战区总医院动物实验中心提供,合格证号:44007200046941)。适应性饲养1周后进入实验阶段,随机分为4组:孕马血清促排卵组(PMSG组)、促性腺激素释放激素激动剂组(GnRH-a组)、促性腺激素释放激素拮抗剂组(GnRH-ant组)、自然排卵组(空白对照组),每组10只。
2.各组小鼠具体促排卵方案及操作如下[3-4]:GnRH-a组:小鼠于阴道涂片为动情后期(动情周期第3天)时,每日9:00 am 腹腔注射醋酸曲普瑞林20 μg/kg,连续9 d,第9天同时腹腔注射PMSG 400 U/kg,48 h 后腹腔注射HCG 1 000 U/kg;GnRH-ant组:GnRH-ant组小鼠以醋酸西曲瑞克注射液400 U/kg代替GnRH-a腹腔注射,其余处理同GnRH-a组;PMSG组:PMSG组小鼠以等体积生理盐水代替GnRH-a腹腔注射,其余处理同GnRH-a组。空白对照组:空白对照组小鼠每日给予等体积生理盐水腹腔注射,连续11 d。
各组小鼠于最后一次腹腔注射2 h后颈椎脱臼处死,快速取出双侧卵巢,其中一侧卵巢经4%多聚甲醛固定,脱水,常规石蜡包埋,切片(4 μm);另一侧卵巢置于-80℃冰箱冻存。
3.检测指标与方法:免疫组化检测各组小鼠卵巢组织中Fas、FasL、Caspase8、Caspase3的表达。石蜡切片脱蜡至水,切片浸泡于装满EDTA抗原修复缓冲液的修复盒中,于微波炉内进行抗原修复,阻断内源性过氧化物酶,加一抗过夜,加二抗孵育,切片稍甩干后在圈内滴加新鲜配制的DAB显色液,显微镜下控制显色时间(一般在2 min以内),阳性为棕黄色,自来水冲洗切片终止显色。用苏木素复染细胞核,最后脱水封片。用Image-Pro Plus 6.0图像分析系统对各组小鼠卵巢组织中Fas、FasL、Caspase8、Caspase3的蛋白表达进行半定量分析,以平均光密度值(IOD)表示结果,阳性细胞的表达越强,IOD值越大。
三、统计学分析
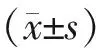
结 果
各组小鼠经不同促排卵方案干预后,卵巢颗粒细胞免疫组化Fas、FasL、Caspase8、Caspase3表达水平总体趋势为:GnRH-a组/GnRH-ant组>空白对照组>PMSG组。其中,PMSG组小鼠卵巢颗粒细胞凋亡因子Fas、FasL、Caspase8、Caspase3表达低于空白对照组,但差异无统计学意义(P>0.05);GnRH-a组与GnRH-ant组小鼠卵巢颗粒细胞Fas、FasL、Caspase8、Caspase3表达显著高于空白对照组(P<0.05)(图1~4,表1)。
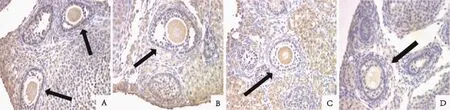
A:PMSG组;B:GnRH-a组;C:GnRH-ant组;D:空白对照组;箭头示卵泡图2 小鼠卵巢颗粒细胞FasL的表达(免疫组织化学,×40)
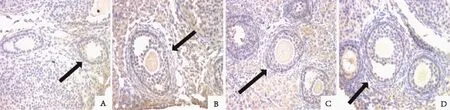
A:PMSG组;B:GnRH-a组;C:GnRH-ant组;D:空白对照组;箭头示卵泡图3 小鼠卵巢颗粒细胞Caspase8的表达(免疫组织化学,×40)
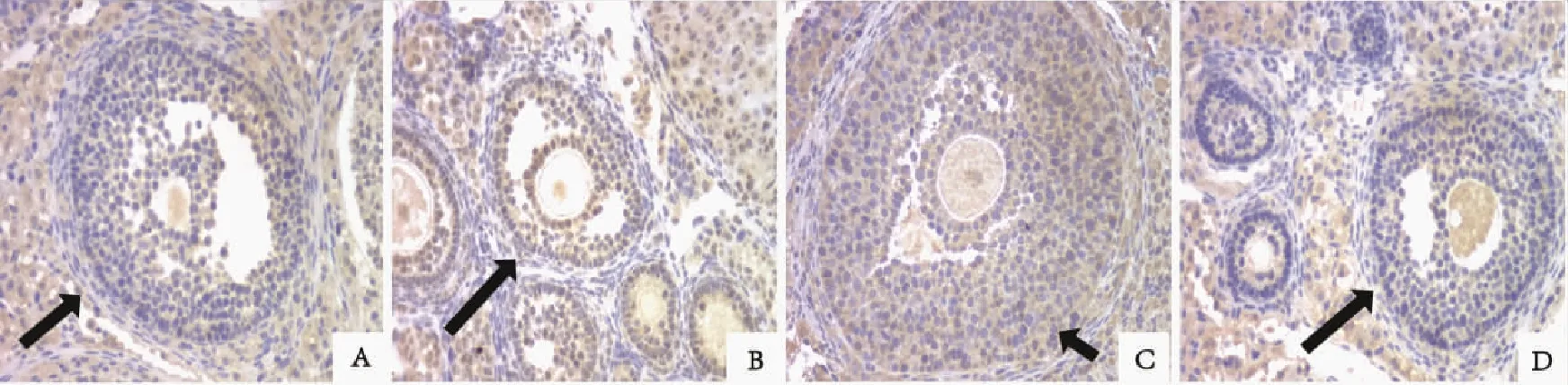
A:PMSG组;B:GnRH-a组;C:GnRH-ant组;D:空白对照组;箭头示卵泡图4 小鼠卵巢颗粒细胞Caspase3的表达(免疫组织化学,×40)

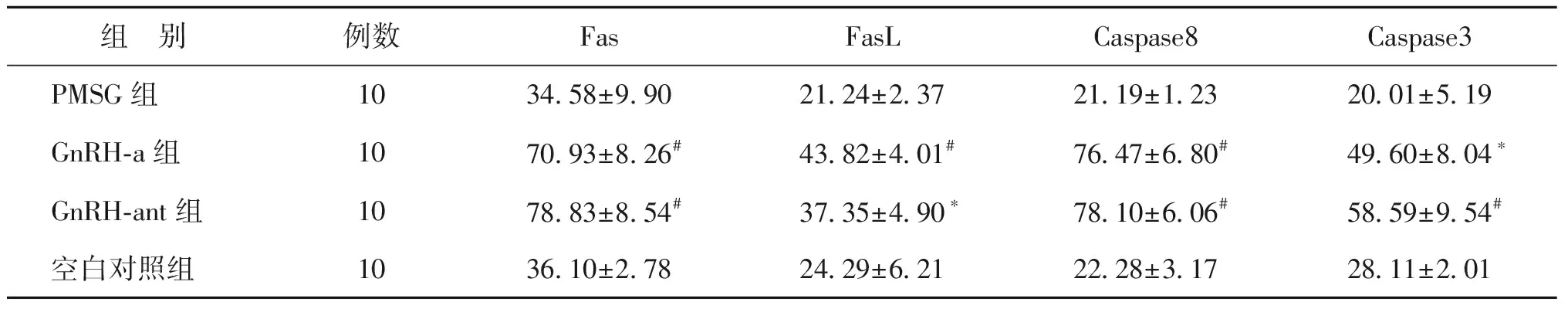
组 别例数FasFasLCaspase8Caspase3PMSG组1034.58±9.9021.24±2.3721.19±1.2320.01±5.19GnRH-a组1070.93±8.26#43.82±4.01#76.47±6.80#49.60±8.04∗GnRH-ant组1078.83±8.54#37.35±4.90∗78.10±6.06#58.59±9.54#空白对照组1036.10±2.7824.29±6.2122.28±3.1728.11±2.01
注:与空白对照组比较,*P<0.05,#P<0.01
讨 论
卵泡发育是由原始卵泡启动生长的,依次发育为初级卵泡、次级卵泡、窦卵泡和成熟卵泡。在卵泡发育过程中,颗粒细胞的生长启动早于卵母细胞,提示颗粒细胞的变化可作为卵泡生长启动的信号,也说明颗粒细胞的生长和分化可能是原始卵泡启动发育的关键。作为卵巢的主要功能细胞之一,颗粒细胞具有支持和营养卵母细胞的作用,在卵泡发育过程的不同阶段,颗粒细胞接受来自生殖轴神经内分泌和卵巢自分泌、旁分泌的调控而发生增殖或凋亡,是影响生殖功能的重要一环。细胞凋亡是卵泡闭锁的根本机制[5-8],它所累及的主要是颗粒细胞的凋亡[9]。Wallace等[10]研究认为,卵母细胞质量与卵泡液中代谢产物有关,而卵泡液中多种细胞因子及激素的产生主要依赖于颗粒细胞。如果颗粒细胞大量凋亡,将引起卵泡内局部环境变化,干扰正常卵泡发育,导致卵巢病理性改变,并直接影响 IVF-ET 结局与妊娠成功率。所以颗粒细胞是一个较好的评价卵巢功能及卵泡质量的系统[11]。Fas 通路是经典细胞凋亡通路之一,以Fas系统为代表的死亡受体信号转导途径是卵巢颗粒细胞凋亡的重要途径之一[12-14],由Fas介导的细胞凋亡信号通路Fas-FasL-Caspase8-Caspase3的激活最终导致细胞凋亡不可逆的发生。
研究表明,GnRH-a方案对人颗粒细胞及猪卵巢颗粒细胞均有直接的促凋亡作用[15-16]。Giampietro等[17]通过对卵巢储备功能正常的妇女卵巢颗粒细胞的研究发现,GnRH-ant方案可导致颗粒细胞凋亡率的上升及凋亡相关基因表达的增加。并且有研究发现[18],GnRH-a方案与GnRH-ant方案治疗后妇女卵巢颗粒细胞凋亡水平相当,两种方案对颗粒细胞的凋亡率无明显差异。本研究中,GnRH-a组和GnRH-ant组小鼠卵巢颗粒细胞Fas、FasL、Caspase8、Caspase3蛋白表达水平均较空白对照组升高,说明GnRH-a方案和GnRH-ant方案促进小鼠卵巢颗粒细胞Fas细胞凋亡信号通路各凋亡因子的表达,促进了小鼠颗粒细胞的凋亡,而GnRH-a组和GnRH-ant组两组间凋亡水平无明显差异,与以上研究结果基本一致。研究表明,PMSG方案具有抑制卵泡闭锁以及颗粒细胞凋亡的作用,可促进卵泡重新生长发育成熟[19],增加卵母细胞的蛋白质合成能力[20],提高卵母细胞体外发育潜能[21]。本研究中PMSG组小鼠卵巢颗粒细胞Fas、FasL、Caspase8、Caspase3蛋白表达水平均较空白对照组降低,说明PMSG方案可以下调Fas通路上各凋亡因子的表达水平,抑制小鼠卵巢颗粒细胞的凋亡,并使其接近自然排卵小鼠状态。
总之,不同促排卵方案对小鼠颗粒细胞凋亡的影响不同,GnRH-a方案和GnRH-ant方案促进小鼠卵巢颗粒细胞Fas细胞凋亡信号通路各凋亡因子的表达,促进小鼠卵巢颗粒细胞的凋亡;PMSG方案则下调Fas通路上各凋亡因子的表达水平,抑制小鼠卵巢颗粒细胞的凋亡。鉴于颗粒细胞与卵泡质量的密切关系,推测GnRH-a方案和GnRH-ant方案对卵泡发育有一定程度的不利影响,PMSG方案可在一定程度促进卵泡发育。

