子宫肌壁间子宫内膜异位囊肿与囊性腺肌病可能是两种不同的疾病
李玲,王文泽,邓姗*
(中国医学科学院 北京协和医学院 北京协和医院1.妇产科,2.病理科,北京 100730)
子宫腺肌病是指子宫内膜腺体和间质异位到子宫肌层内,周边可见肥大增生的肌层组织。腺肌瘤、腺肌瘤样息肉以及囊性腺肌病或(瘤)都属于其中少见的类型。粘膜下腺肌瘤伴有囊肿形成最早由Cullen于1908年报道,当初的5例病例均为30岁以上的女性,囊肿直径在10 mm左右。后来一种集中多见于未生育年轻女性的囊性腺肌病逐渐引起各国学者注意,更多是因为这种特殊类型的囊性腺肌病暗示着一种有别于一般性腺肌病的发病机制,既非“子宫内膜基底内陷理论”也非“经血逆流干细胞种植理论”所揭示,而可能是“苗勒管残留组织化生”造成的。
病例资料
病例1:王某,35岁,女性,G1P0,因“未避孕未孕2年,阴道不规则出血7个月”行宫腹腔镜联合不孕检查。平素月经规律,7/28 d,量中,痛经(-),5年前曾于我院因子宫多发肌瘤行开腹子宫肌瘤剔除术(肌壁间、前后壁深肌层),术中探查子宫如孕18周大小,前壁及左侧宫旁肌瘤分别为8 cm、6 cm,后壁近宫颈处肌瘤6 cm,术中自体血回输250 ml。术后病理:子宫平滑肌瘤,伴退变及散在钙化灶,可见较多淋巴细胞、浆细胞浸润,淋巴滤泡形成。术后两年发现有肌瘤复发,前壁0.6 cm×0.5 cm,后壁下段1.4 cm×0.7 cm,左侧宫底部3.6 cm×2.7 cm×2.0 cm伴钙化。试孕至今,BBT双相,早卵泡期激素水平(月经期第3天):FSH 14.15 U/L,E239.80 pg/ml(145.67 pmol/L),P 1.04 ng/ml(3.30 nmol/L),T 0.50 ng/ml(0.17 nmol/L),LH 6.54 U/L,PRL 26.51 ng/ml(1.21 nmol/L),未行子宫输卵管造影。因年龄超过35岁,且合并肌瘤,要求直接行手术。术前盆腔MRI提示子宫前壁肌层多发肌瘤,后壁下段及宫颈后方异常信号伴出血4.9 cm×1.9 cm(图1E);右侧输卵管扩张积水。近7个月阴道不规则出血,与月经无关,每个月约有1~2周,量不多,无腹痛。后全麻下行腹腔镜盆腔粘连松解+右输卵管囊肿切除+右输卵管切除+子宫肌瘤剔除+子宫囊肿切除+通液术+宫腔镜检查+诊刮术,术中见:宫底部宽大,左侧宫角处略膨隆(图1A);前壁下段直径约2 cm肌壁间肌瘤突起;后壁下段外凸大小约3 cm×5 cm的质软囊性突起,囊肿表面光滑,囊肿似为多房融合、局部壁薄、可见暗褐色囊内液(图1B);另于子宫左后壁见直径0.5 cm浆膜下肌瘤。左卵巢未见异常,左输卵管走形正常,分离粘连后见外观正常。右侧卵巢外观未见异常,右输卵管全程膨大积水,走形迂曲,可见少许伞结构。凝切子宫后壁浆膜下肌瘤,切开子宫后壁下段囊肿,内含稀薄淡褐色囊内液(图1C)。囊肿共3房,与周围肌壁间边界尚清,囊壁光滑未见乳头。宫腔镜检查:宫腔深8 cm,宫颈管形态正常,宫腔倒三角形,右侧输卵管开口可见(图1D),左侧输卵管开口因内膜遮挡显示不清。宫颈后壁略凹陷。术后病理:子宫后壁子宫内膜异位囊肿(图1F)。
病例2:濮某,48岁,女性,平素月经规律,6~7/27~28 d,量中,痛经(+)。2013年开始经量增多,痛经进行性加重,经期3~5 d为甚,需口服止痛药止痛,血色素最低80 g/L。2015年首次超声提示有子宫腺肌症,未予治疗。因“自觉腹部肿块3个月”就诊我院。2018年2月份始觉腹部活动性肿块,拳头大小,经后有牵拉性胀痛。4月11日就诊我院,B超检查提示:子宫增大、肌层回声不均,子宫腺肌症可能;子宫上方脐水平见无回声囊性包块7.6 cm×8.7 cm×7.3 cm。MRI检查提示:右腹部巨大出血性病变,与子宫肌层病变呈鸟嘴征改变,不除外子宫来源,病变周围血管推压(图2C);弥漫性子宫腺肌症;子宫多发性肌瘤,后壁下段不典型肌瘤。CA-125值169.5 U/ml,CA-199值45.3 U/ml。2018年6月1日行腹腔镜全子宫+双附件切除+盆腔粘连松解术。术中见:子宫均匀增大如孕16周,前壁及下段与前腹壁广泛致密粘连;宫底部外突囊性肿物直径约8 cm(图2A),该肿物被大网膜广泛包裹粘连;双侧附件未见明显异常;子宫直肠窝及宫骶韧带光滑。术中松解宫底部外突的包块周围粘连,过程中有多量巧克力样囊内液流出(图2B)。台下剖视标本见子宫底部外突的囊肿为单房、壁略厚,未见乳头结构。术后病理:子宫腺肌症,合并囊性病灶,符合子宫内膜异位特征(图2D)。
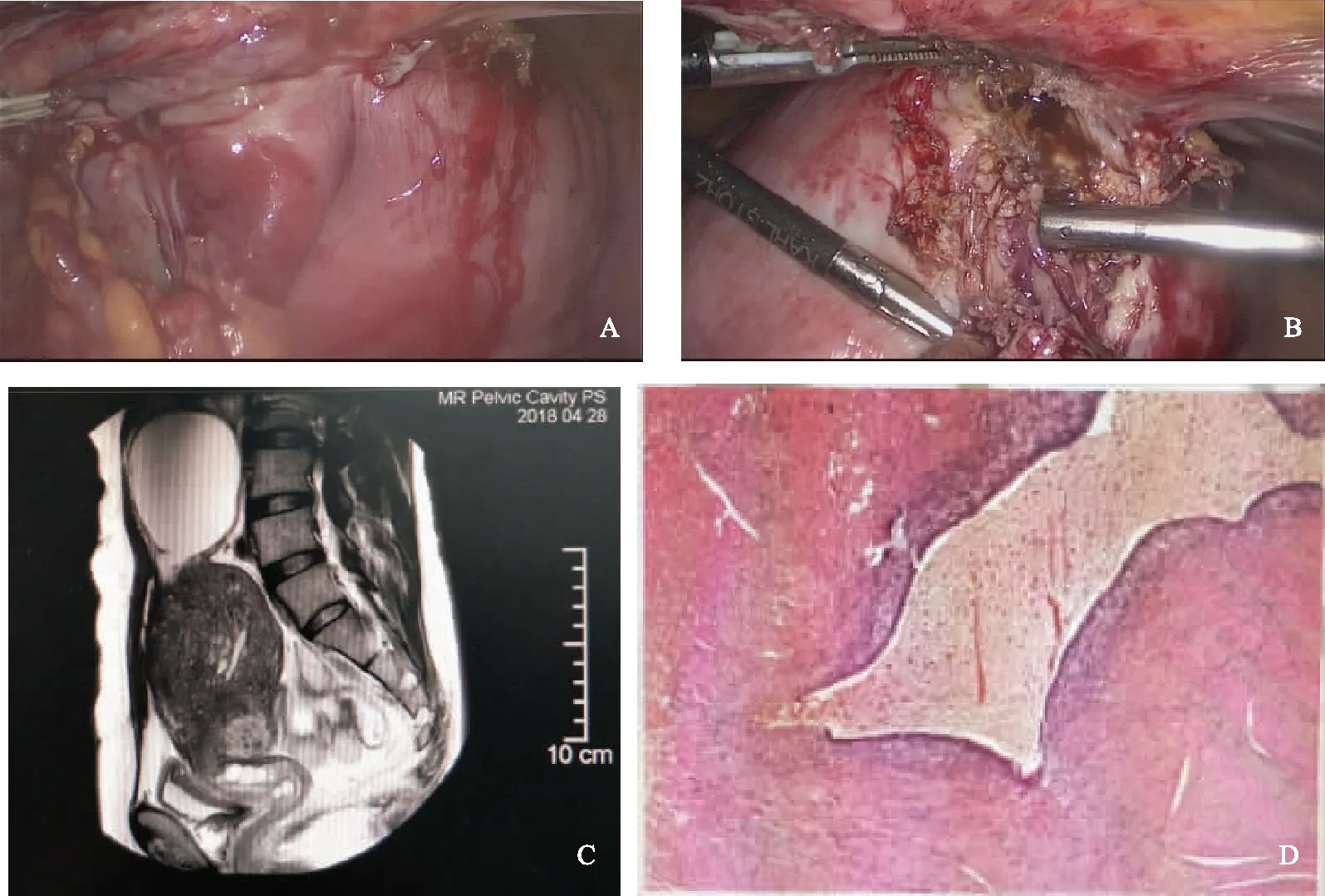
A:子宫后壁可见外凸包块,呈鸟嘴样;B:囊内液为巧克力样液体,囊肿无明显包膜;C:MRI显示右腹部巨大类圆形压脂短T1长T2信号,直径约9.2 cm,局部与子宫肌层病变呈鸟嘴征改变,囊壁厚约1.9 mm;D:病理切片(HE染色,×100):子宫肌层内岛屿状内膜腺体和间质,腺体分泌不活跃,局部有囊腔形成图2 病例2的术中所见、MRI图像及病理切片
讨 论
一、子宫肌壁间子宫内膜异位囊肿(intermuscular endometriotic cyst)与囊性腺肌症(cystic adenomyo)是两种病变
1.二者发病机制不同:尽管两者的共同特点是子宫肌壁间存在充满陈旧性出血的囊腔,但异位内膜的来源机制可能不同,进而发病年龄和临床特点也有不同。子宫囊肿的发病机制尚不明确,主要有以下两大观点[1]:(1)先天性疾病:来源于吴菲氏管或苗勒氏管。苗勒氏管发育过程中某部分受损,部分苗勒管残留,初潮后在雌激素作用下残留苗勒管上皮周期性出血形成囊腔,囊内压力增加出现痛经;(2)医源性疾病:患者在发病前有不同类型的子宫操作史,病变部位可能与手术操作部位相关,临床表现往往出现在子宫操作后,子宫操作史、创伤可能是诱因[1-2]。
囊性子宫腺肌症,是一种较为罕见的情况,腺肌症病灶内的囊性部分一般不超过5 mm,大的囊性部分很少见,文献中报道的最大的囊性子宫腺肌瘤直径约为8 cm[3],其文献对于囊肿的术中细节和病理图片未有详细披露,但根据该病例27岁未生育过且周期性腹痛在连续服用复方口服避孕药5年的情况下仍进行性加重的病史分析,属于幼年型囊性腺肌病(Juvenile Cystic Adenomyosis,JCA)[4]的可能性大。而所谓JCA,是囊性腺肌病中相对最常见的类型[5],属于先天性疾病。在近期一篇关于66例囊性腺肌病的综述中,43例属于JCA,患者年龄介于13~30岁间,囊肿直径介于10~30 mm[6]。印度有医生报道了4例JCA,患者年龄16~24岁,囊肿直径25~42 mm,明确表述腺肌瘤病灶与周围组织无明显肌瘤样假包膜,根据手术图片判断,与本文报道的两例子宫内膜异位囊肿显著不同[2]。另外值得注意的是,JCA通常在术前被怀疑为先天性生殖道畸形中存在子宫内膜腔的残迹子宫[2,7-8],而它们也是截然不同的两种疾病,后者是苗勒管发育不良的残迹结构,因经血梗阻造成发育不良的宫腔内积血,而囊性腺肌病(瘤)是继发于腺肌病灶内反复内膜出血的集聚。
本文报道的病例1之子宫肌壁间子宫内膜异位囊肿,更符合医源性疾病的病史特点。该患者既往有子宫肌瘤剔除术史,根据手术记录,肌瘤剔除术中一处肌瘤为后壁近宫颈处,与此次术中发现囊肿的位置相近,病灶的形成考虑与前次子宫肌瘤剔除手术相关。另结合前期报道的另一个类似病例[9],患者既往有正常的月经和婚育史,只是在剖宫产术中因为轻度的胎盘植入,产后出血做过B-Lynch缝合等操作,后期发现的子宫中下段肌壁间囊肿与内膜异位于卵巢所形成的巧克力囊肿相似,有明显的囊壁界限,也推测与子宫创伤后的继发种植相关。这两个病例均不合并明显的腺肌症,因此笔者认为并非囊性腺肌病,而推测更可能是一种继发于人为创伤的种植性囊肿。
2.二者病理学特征不同:囊性腺肌病为子宫腺肌症或腺肌瘤的病灶中出现一个或多个囊性区域,内含棕黑色或褐色液体;囊性区域与周围腺肌症病灶或肌层界限欠清[10]。镜下所见为囊壁上皮由子宫内膜腺体与间质排列而成,囊壁周围被覆肥大、增生的肌层组织(图3A)。而子宫肌壁间子宫内膜异位囊肿与周围组织或肌层之间有明显界限。镜下囊壁也由子宫内膜腺体与间质排列而成,但囊性区域周围肌层组织无明显增生、肥大(图3B)。
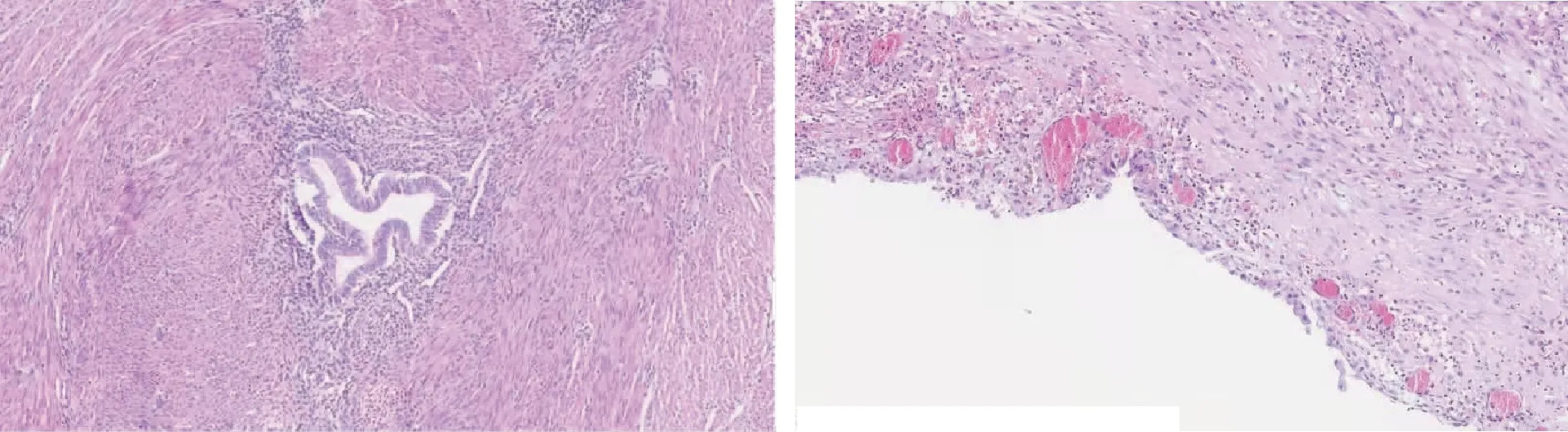
A:囊性腺肌病:囊壁上皮由子宫内膜腺体与间质排列而成,囊壁周围被覆肥大、增生的肌层组织;B:子宫内膜异位囊肿:囊腔上皮为单层增殖期子宫内膜,周围是子宫内膜间质图3 囊性腺肌病和子宫内膜异位囊肿不同的镜下表现(HE染色,×150)
3.处理原则不同:之所以提出并强调子宫肌壁间内异症囊肿与囊性腺肌病的鉴别,主要在于两种疾病的处理原则不同。前者与周围组织有明显界限,完整切除囊肿病灶是完全可行的。本文病例1的病灶位于子宫浆膜下,且有完整包膜,采用腹腔镜下子宫囊肿剥除术后随诊情况良好。而囊性子宫腺肌病(如病例2所示)属于子宫腺肌症的一种特殊类型或一部分,但同样存在与周围正常组织边界不清的特点,单独切除囊性部分或腺肌瘤病灶通常无法完全切净,处理原则同子宫腺肌症,根据有无生育要求、症状轻重、病灶范围及大小,需个体化选择药物、手术的综合治疗方案[11-14]。
二、其他类型的子宫囊肿
1.子宫肌瘤囊性变:临床多无痛经表现,血CA125一般不升高。B超下囊肿可因内有液体或黏液而呈低回声的囊性区域;红色变性多无特异性,可因出血和水肿出现混合回声;透明变性多呈低回声或混合回声。MRI在透明变性时显示T1、T2低信号,红色变性时T1、T2不规则高信号。囊腔大小不等,其间有结缔组织相隔,数个小囊腔也可融合成大囊腔。
2.苗勒管发育异常:如Robert子宫、残角子宫等。前者是一种罕见的子宫畸形,表现为部分宫腔被肌性的隔封闭为盲腔,月经初潮后可出现梗阻性痛经;残角子宫为一侧苗勒管发育不良,与对侧单角宫腔不相通,若残角子宫内有功能性内膜,则会出现明显的周期性腹痛。子宫输卵管造影(HSG)可显示宫腔和/或输卵管异常,系统的B超或MRI检查可发现同时存在的其他系统畸形,如泌尿系、骨骼、心脏和神经系统等。盆腔MRI在判断子宫畸形方面有明显的优势[6],对于特殊病例的鉴别诊断帮助很大。
3.先天性子宫囊肿:先天性子宫囊肿通常来源于中肾管或副中肾管的胚胎残迹。性分化过程中,中肾管及副中肾管发育过程中的残迹在极少见的情况下内皮仍然活跃,并继续增殖形成囊肿。其中中肾管来源的子宫囊肿不受激素影响,可能区别于副中肾管来源的先天性囊肿。通常无明显特异性症状,临床罕见,多为术后病理诊断。Sherrick等[1]曾提出先天性子宫囊肿诊断的5条标准:(1)囊肿不与宫腔相通,并且无子宫内膜;(2)囊肿不与宫颈管腺体相连,且囊内壁与宫颈管上皮不同;(3)囊肿位于子宫肌层,在中线(苗勒氏管来源)或一侧(吴菲氏管来源);(4)囊腔内衬有纤毛或无纤毛的立方或柱状上皮,为类似于副中肾管的低乳头状型或类似于中肾管的平滑型;(5)囊壁应部分由子宫肌层构成。可见最终诊断需要病理依据。
4.寄生虫性囊肿如包虫病:包虫病又称棘球蚴病,是细粒棘球绦虫的幼虫感染人体所致。人包虫病最常见的部位是肝脏和肺,其次是脾脏、卵巢、脑、骨骼、心脏,盆腔包虫病多由于肝脏病变囊肿破裂所致,原发于盆腔的包虫病罕见约占包虫病的0.2%~0.9%,临床表现和影像学检查缺乏特异性,诊断依赖手术探查。有原发生于宫颈的包虫病的报道,患者有明显的性交痛及慢性盆腔痛,妇科查体直肠子宫陷凹可及光滑、界清、无压痛的囊性肿物;B超下为无回声囊肿,与宫颈后壁分界不清[15]。术前初步诊断为肌瘤变性,术后病理诊断为包虫病。
5.妊娠相关病变:有文献报道输卵管间质部妊娠囊性变[16],患者主诉流产后不规则阴道出血3个月,妊娠试验为阴性,辅助检查为子宫浆膜下3 cm囊性肿物,术中见囊肿内为妊娠组织。
三、结合文献综述的命名和分类建议
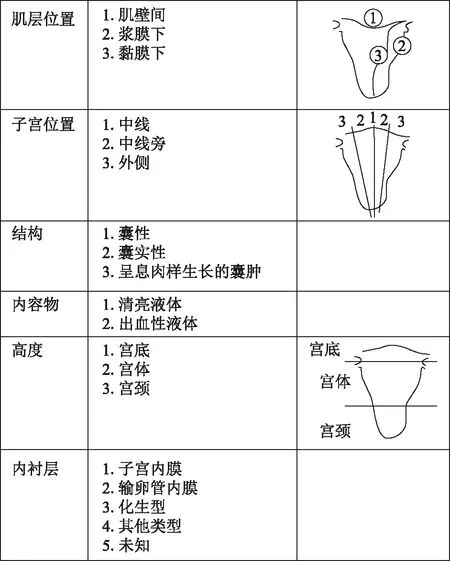
图4 MUSCLE描述系统[6]
由此可见,子宫肌壁间的囊肿可以有多种组织学来源和病因基础,但根据Brosens等[6]2015年发表的关于前期子宫囊肿的综述文献,显然以被覆子宫内膜上皮的“囊性腺肌病(瘤)”最为常见,但由于采用的术语多样,很有可能存在混淆和遗漏。作者主张首先应该根据囊肿被覆的上皮性状进行分类描述:(A)腺肌瘤性囊肿(adenomyotic cyst):部分或全部被覆子宫内膜样上皮和间质;(B)非腺肌瘤性囊肿(non-adenomyotic cyst):被覆其他类型的上皮细胞;(C)子宫肌瘤囊性变(cystic degeneration of a leiomyoma):没有被覆上皮;(D)未分类囊肿(unclassified cyst):囊肿上皮没有组织病理学检查证据的情况。其次,所有的相关病例应按照图示MUSCLE描述系统[6](图4)所建议的进行变量描述,以便于统一和比较。对于A类腺肌瘤性囊肿又分为3种亚型:A1型:粘膜下或肌壁间囊性腺肌瘤;A2型:囊性腺肌瘤样息肉;B1型:浆膜下囊性腺肌瘤;B2型:外生型囊性腺肌瘤;C型:子宫样包块型。本文报道的病例1不属于上述任一亚型,而病例2可归类于B2型腺肌瘤性囊肿。本文的亮点在于,提出子宫肌壁间内异症囊肿和囊性腺肌病是两种不同的病变,尽管它们都具有以子宫内膜上皮和间质被覆囊腔的组织学特点,但前者更可能是一种后天获得性囊肿,通常有局部手术史、发病年龄较大、囊肿与子宫肌壁组织有明确的边界,可完整剥除。而后者是子宫腺肌病(瘤)的一部分或是一种特殊类型。对于几种均以经血梗阻性疼痛为临床表现的子宫囊肿,鉴别诊断要点整理如下(表1)。
综上所述,子宫体部的囊肿整体上临床少见,而病因机制多样且复杂,即便是同为陈旧性出血性囊肿,也可因发病机制不同而有不同的临床病理特点和手术处理策略。临床手术医师应学习子宫体囊肿的鉴别诊断要点,并尝试采用MUSCLE描述系统细化对此类病变的描述,以便更准确地诊断和处理。子宫肌壁间子宫内膜异位囊肿很可能是一种医源性的种植性病变,尽管剥除相对容易,但预防为先的理念更重要。
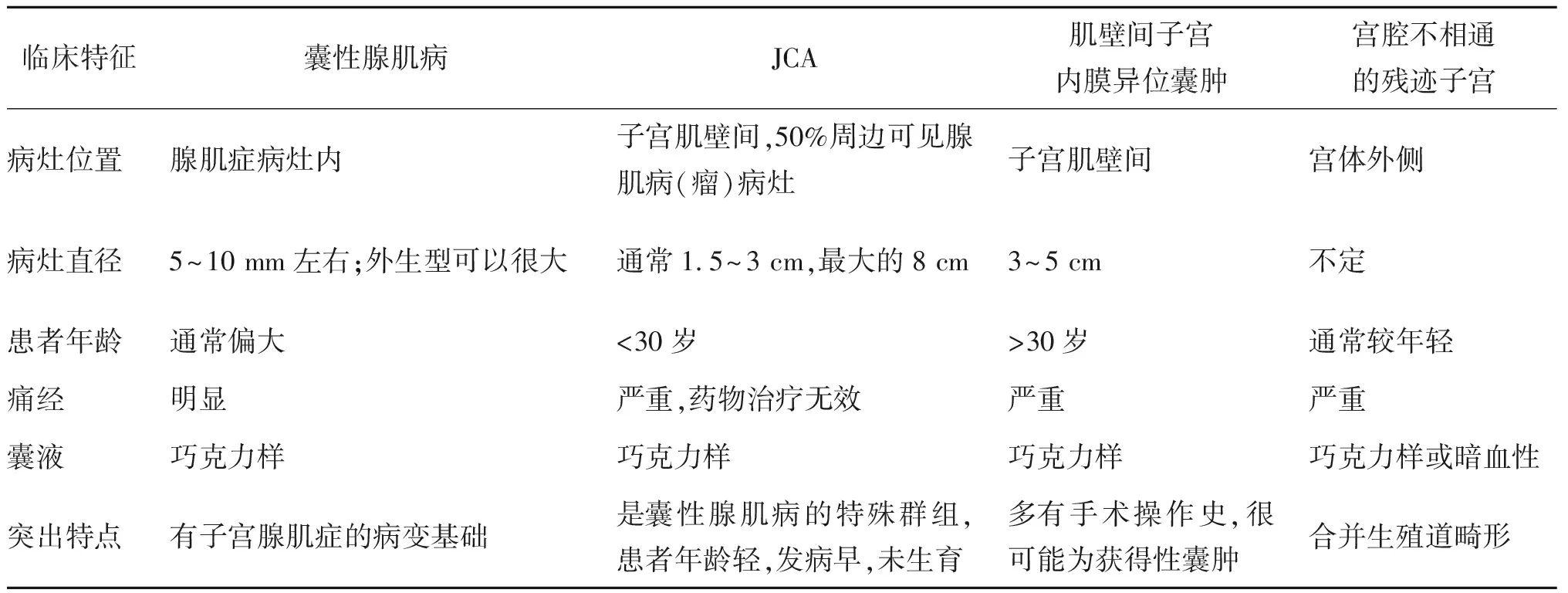
表1 常见子宫来源囊性包块的鉴别诊断要点

