核因子E2相关因子2基因沉默对人前列腺癌PC-3细胞增殖、侵袭和转移的影响
岳树香,连玉菲,刘广舒
核因子E2相关因子2(subcellular localization of nuclear factor E2-related factor 2,NRF2)是一种细胞内重要的核转录因子,可通过与KELCH样ECH关联蛋白1(kelch-like ECH-associated protein-1,KEAP1)蛋白质的相互作用调节下游相关基因的表达,在维持细胞内环境稳态、抗氧化应激和抗炎等过程中发挥着重要作用[1,2]。NRF2不仅具有保护正常细胞的作用,同时还能够阻止肿瘤细胞对应激反应的抵抗,提高肿瘤细胞的存活率[3,4]。文献[4-6]证实,NRF2在胃癌、肺癌和卵巢癌等多种肿瘤中异常高表达,参与细胞增殖、侵袭和迁移等生物学过程,与肿瘤的发生发展和药物抵抗等关系密切。近年来文献[7]指出,NRF2在前列腺癌组织中异常高表达,与肿瘤的淋巴结转移、浸润深度和分期密切相关。然而,NRF2在前列腺癌细胞增殖、侵袭和转移中的作用尚不明确。因此,本研究以前列腺癌PC-3细胞为研究对象,通过靶向沉默NRF2表达,观察NRF2对PC-3细胞增殖、侵袭和转移的影响,并初步探讨其可能的分子机制。
1 材料与方法
1.1 材料与仪器 人前列腺上皮细胞株RWPE-1和前列腺癌细胞株PC-3购于美国ATCC,胎牛血清购于美国Gibco公司,RPMI1640培养液、胰蛋白酶和二甲基亚枫购于北京索莱宝科技有限公司,青霉素-链霉素双抗购于美国Hyclone公司,放射免疫沉淀法(radio-immunoprecipitation assay ,RIPA)裂解液购于美国Thermo Scientific公司,CCK-8试剂盒购于上海碧云天公司,NRF2、基质金属蛋白酶9(matrix metalloprotein 9,MMP-9)、N-钙黏附素(N-cadherin)和β肌动蛋白(β-actin)抗体购于美国Abcam公司,细胞核增殖相关抗原(Ki67)、细胞周期蛋白D1(CyclinD1)抗体以及辣根过氧化物酶(Horse reddish peroxidase,HRP)标记的羊抗兔/鼠二抗购于北京中杉金桥生物试剂公司。脂质体2000和反转录试剂盒购于美国Invitrogen公司。总RNA提取试剂盒购于日本TaKaRa公司,倒置显微镜购于日本Olympus公司,酶标仪和PCR 扩增仪购于美国Bio-Rad公司。CO2细胞培养箱购于美国Thermo公司。
1.2 细胞培养 在温度为37 ℃、CO2体积分数为5%的条件下,采用含10%胎牛血清和青霉素-链霉素双抗的RPMI 1640 培养液培养RWPE-1和PC-3细胞。待细胞贴壁融合达80%左右时,以0.25%胰蛋白酶消化传代。收集第3~5代细胞进行实验。
1.3 RT-PCR实验 参照总RNA提取试剂盒说明书步骤提取待测的RWPE-1和PC-3细胞的总RNA,并将经紫外分光光度计定量合格的RNA反转录合成单链cDNA。取2 μl cDNA作为模板,与各1 μl的上下游引物、10 μl Master Mix 和6 μl ddH2O充分混合配成20 μl的PCR扩增体系。以β-actin为内参,按照如下反应条件进行PCR扩增:95 ℃预变性 5 min(1个循环);95 ℃变性 15 s(35个循环);56 ℃退火30 s(35个循环);72 ℃延伸30 s(35个循环)。其中,由上海生工合成的引物序列分别为:NRF2正向引物,5′-TCAGCGACGGAAAGAGTATGA-3′;NRF2反向引物,5′-CCACTGGTTTCTGACTGGATGT-3′;β-actin正向引物,5′-ATGATGATATCGCCGCGCTC-3′;β-actin反向引物,5′-TCGATGGGGTACTTCAGGG-3′。
1.4 细胞分组与转染 实验分为Con组(不做转染)、NC组(转染阴性对照)、NRF2 siRNA-1组(转染NRF2 siRNA-1)、NRF2 siRNA-2组(转染NRF2 siRNA-2)和NRF2 siRNA-3组(转染NRF2 siRNA-3)。将长势良好的对数生长期PC-3细胞以每孔1.5×106个细胞接种于6孔细胞板上,在细胞培养箱内培养过夜,待细胞生长至贴壁75%左右时,按照实验分组,参照转染试剂脂质体2000的说明书步骤将NRF2干扰序列和阴性对照序列转染至PC-3细胞中。待转染48 h后,收集各组细胞,采用Western blot和RT-PCR检测转染结果。其中NRF2的3条干扰序列NRF2 siRNA-1(5′-CCAACCAGUUGACAGUGAACUCAUU-3′)、NRF2 siRNA-2(5′-CAAUGAAGCUCAACUUGCAUUAAUU-3′)、NRF2 siRNA-3(5′-CAAACUGACAGAA-GUUGACAAUUAU-3′)及阴性对照序列(5′-TTCTCCGAACGTGTCACGT-3′)由海吉凯生物公司合成。
1.5 CCK-8实验 将对数生长期的Con组、NC组和NRF2 siRNA组(即转染NRF2 siRNA-3序列的细胞)细胞以每孔104个接种至96孔细胞板上,每组实验设置3个重复。于细胞培养箱中分别培养24、48、72 h,取出培养板。每孔加入CCK-8试剂10 μl,孵育2 h后,上酶标仪于490 nm波长处检测各组的吸光度(OD值),并按照细胞存活率(%)=100%×(OD实验组-OD空白组)/(OD对照组-OD空白组)的公式计算各组细胞的存活率。
1.6 平板克隆实验 将对数生长期的Con组、NC组和NRF2 siRNA组细胞以每孔600个接种至6孔细胞板上,于细胞培养箱内常规培养14 d,定期观察。当有肉眼可见的细胞集落形成时,停止培养。去上清,以磷酸缓冲液洗涤细胞后,分别以10%甲醇固定30 min和0.1%结晶紫染色15 min。洗去染色液并晾干。采用显微镜随机选取5个视野观察计数,以大于50个细胞的集落作为有效克隆。根据公式克隆形成率(%)=100%×(克隆细胞数/接种细胞数)计算各组细胞的克隆形成能力。每组实验重复3次。
1.7 Transwell实验 取Transwell小室,采用浓度为8.4 g/L的Matrigel凝胶50 μl对孔径为8 μm的聚碳酸酯微孔膜进行包被(侵袭实验)或不做处理(迁移实验)。将Con组、NC组和NRF2 siRNA组细胞以无血清的RPMI 1640培养液制成浓度为105个/ml的细胞悬液。取细胞悬液100 μl加入小室上室中,并向下室中加入含胎牛血清的RPMI1640培养液600 μl。于细胞培养箱内培养24 h后,取出小室,小心擦去微孔滤膜上的细胞,采用4%多聚甲醛对下室内的细胞固定30 min,0.1%结晶紫染色15 min。显微镜下观察。各组细胞的侵袭和迁移能力以随机选取5个视野的穿膜细胞数的均值表示。
1.8 Western blot实验 采用RIPA细胞裂解液提取待测的各组PC-3细胞的总蛋白后,以BCA法对总蛋白的浓度进行定量。按照每孔50 μg蛋白样品上样至SDS-PAGE凝胶孔中进行电泳分离。待电泳结束后,转膜。封闭液(含5%脱脂奶粉)常温封闭PVDF膜2 h后,分别以1∶500倍稀释的NRF2和N-cadherin抗体、1∶800倍稀释的MMP-9、CyclinD1和Ki67抗体于4 ℃下孵育24 h,再以1∶2000倍稀释的HRP标记的羊抗兔/鼠IgG二抗于常温孵育2 h。经ECL显影曝光后,以β-actin为内参,凝胶成像系统检测分析目的蛋白的相对表达量。每组实验重复3次。
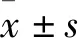
2 结 果
2.1 NRF2 siRNA下调前列腺癌PC-3细胞中NRF2的表达 RT-PCR检测发现,人前列腺上皮细胞株RWPE-1和前列腺癌细胞株PC-3中NRF2 mRNA的相对表达量分别为0.22±0.03和0.84±0.05。与RWPE-1细胞相比,PC-3细胞中NRF2 mRNA的表达水平明显升高(P<0.05)。PC-3细胞转染NRF2 siRNA后,经Western blot和RT-PCR检测,与Con组相比,NC组细胞中NRF2蛋白和mRNA的表达水平无显著差异(P>0.05),而NRF2 siRNA-1组、NRF2 siRNA-2组和NRF2 siRNA-3组细胞中NRF2蛋白和mRNA的表达均明显降低,且NRF2 siRNA-3组降低幅度明显大于NRF2 siRNA-1和NRF2 siRNA-2组(P<0.05,图1、表1)。故后续选用NRF2 siRNA-3干扰序列进行实验。
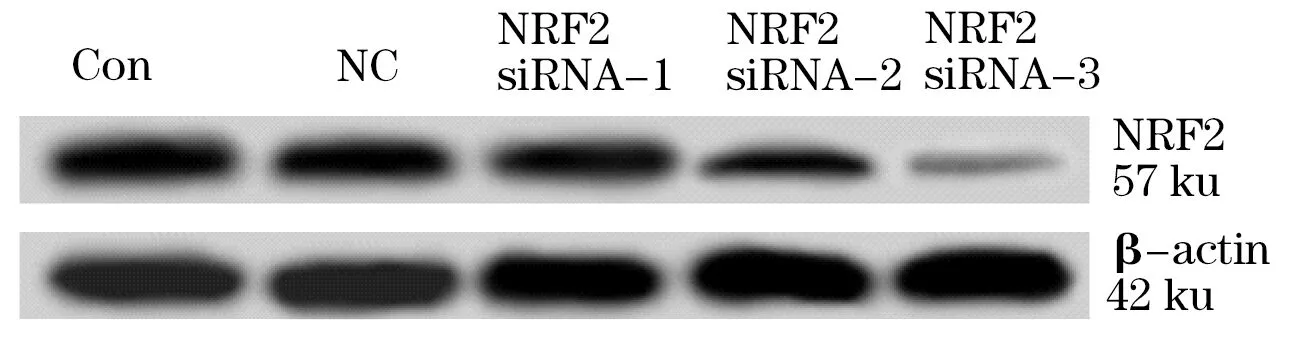
图1 Western blot检测各组细胞中NRF2蛋白的表达
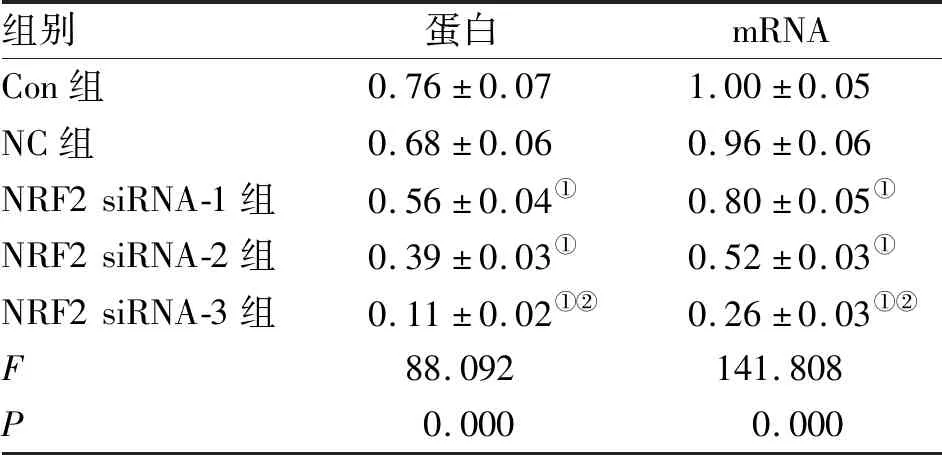
组别蛋白mRNACon组0.76±0.071.00±0.05NC组0.68±0.060.96±0.06NRF2siRNA-1组0.56±0.04①0.80±0.05①NRF2siRNA-2组0.39±0.03①0.52±0.03①NRF2siRNA-3组0.11±0.02①②0.26±0.03①②F88.092141.808P0.0000.000
注:与Con组相比,①P<0.05;与NRF2siRNA-1组和NRF2 siRNA-2组相比,②P<0.05
2.2 NRF2基因沉默抑制前列腺癌PC-3细胞的增殖 CCK-8法检测结果显示,转染24、48、72 h,NC组细胞的存活率与Con组相比无统计学差异,而NRF2 siRNA组的细胞存活率在各时间点较Con组均明显降低(P<0.05)。同时,平板克隆实验结果显示,与Con组相比,NC组细胞的克隆形成率差异无统计学意义,但NRF2siRNA组明显降低(P<0.05,表2)。
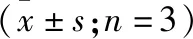
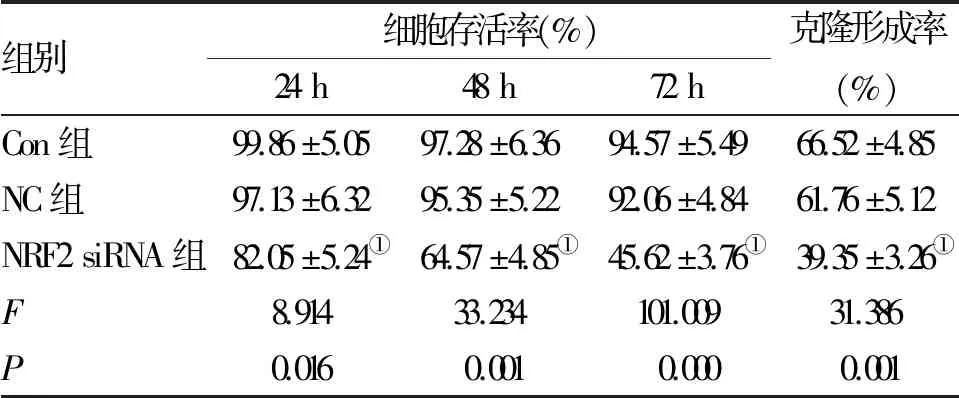
组别细胞存活率(%)24h48h72h克隆形成率(%)Con组99.86±5.0597.28±6.3694.57±5.4966.52±4.85NC组97.13±6.3295.35±5.2292.06±4.8461.76±5.12NRF2siRNA组82.05±5.24①64.57±4.85①45.62±3.76①39.35±3.26①F8.91433.234101.00931.386P0.0160.0010.0000.001
注:与Con组相比,①P<0.05
2.3 NRF2基因沉默抑制前列腺癌PC-3细胞的侵袭和迁移 Transwell小室实验检测结果显示,NC组的侵袭细胞数和迁移细胞数与Con组相比差异无统计学意义,而NRF2siRNA组较Con组均显著降低(P<0.05,表3)。
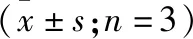
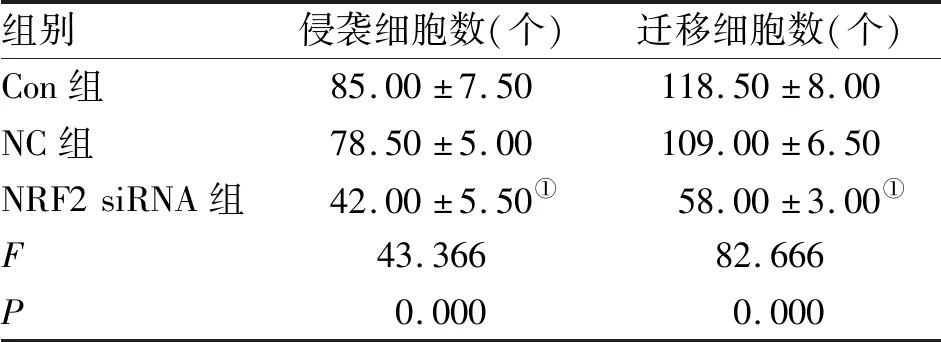
组别侵袭细胞数(个)迁移细胞数(个)Con组85.00±7.50118.50±8.00NC组78.50±5.00109.00±6.50NRF2siRNA组42.00±5.50①58.00±3.00①F43.36682.666P0.0000.000
注:与Con组相比,①P<0.05
2.4 NRF2基因沉默抑制前列腺癌PC-3细胞中Ki67、CyclinD1、MMP-9和N-cadherin蛋白的表达 Western blot检测结果显示,与Con组相比,NRF2 siRNA组细胞中Ki67、CyclinD1、MMP-9和N-cadherin蛋白的表达水平均明显降低(P<0.05),而NC组与Con组间这四种蛋白的表达水平差异无统计学意义(P>0.05,图2、表4)。
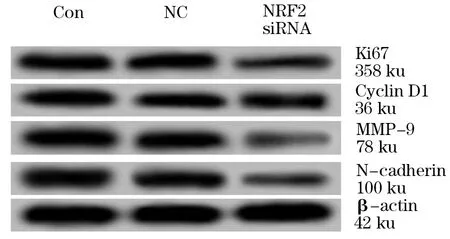
图2 Western blot检测Ki67、CyclinD1、MMP-9
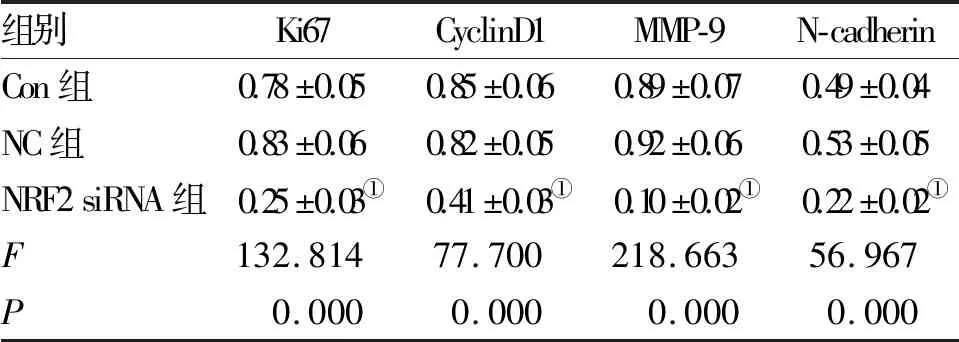
组别Ki67CyclinD1MMP-9N-cadherinCon组0.78±0.050.85±0.060.89±0.070.49±0.04NC组0.83±0.060.82±0.050.92±0.060.53±0.05NRF2siRNA组0.25±0.03①0.41±0.03①0.10±0.02①0.22±0.02①F132.81477.700218.66356.967P0.0000.0000.0000.000
注:与Con组相比,①P<0.05
3 讨 论
前列腺癌是一种男性泌尿生殖系统常见的恶性肿瘤,其发病率高居美国男性恶性肿瘤的首位[8],并且在我国的发病率有逐渐升高的趋势[9,10]。目前,关于前列腺癌的治疗多以手术、放化疗为主,但存在一定的局限性。前列腺癌的发生发展机制尚不明确,与癌基因、抑癌基因和信号通路调控等多种因素相关,肿瘤细胞的恶性增殖是前列腺癌发生的重要因素,而肿瘤细胞的侵袭、迁移能力与肿瘤发生局部浸润和远处转移关系密切[11]。因此,研究前列腺癌细胞的增殖、侵袭和迁移的分子机制对改善和治疗前列腺癌具有重要意义。
NRF2是CNC亮氨酸拉链转录激活因子家族成员,可通过调控HO-1、GST和SOD等发挥抗氧化的细胞保护作用;然而,其过渡积累又可增强肿瘤细胞对放化疗的抗性,与Ki67、Myc和K-Ras等多种致癌基因有关,在肿瘤的发生发展和转移过程中发挥着重要作用[12]。NRF2异常高表达与食管癌患者有无复发和总生存率有关,NRF2siRNA可通过调节谷胱甘肽代谢和ROS抑制癌细胞生长、诱导G1期细胞周期阻滞和凋亡;还可通过下调HO-1、Bcl-2及MMP-9蛋白表达参与调控肿瘤细胞的增殖、凋亡、侵袭转移及放疗敏感性[13-14]。NRF2 mRNA水平的升高预示乳腺癌患者预后不良,NRF2沉默可通过RhoA/ROCK信号转导通路抑制MCF7和MDA-MB-231细胞的增殖、迁移和侵袭[15]。NRF2沉默或敲除可增强化疗剂氟尿嘧啶(5-FU)对胰腺癌细胞的抗增殖作用,其作用机制可能与降低ALDH1A1和ALDH3A1的表达有关[16]。在胆管癌中,NRF2敲除抑制了肿瘤细胞的集落形成,增强了5-氟尿嘧啶抗增殖活性,通过下调Cyclin D1和上调p21表达诱导细胞阻滞于G0/G1期[17]。可见,NRF2可通过多种途径参与肿瘤细胞的增殖、侵袭和迁移等生物学过程,与肿瘤的发生发展关系密切。
本研究证实了NRF2在前列腺癌PC-3细胞中异常高表达。通过转染NRF2干扰序列成功下调NRF2表达后,发现PC-3细胞的增殖、克隆形成、侵袭和迁移能力均明显减弱。这说明,前列腺癌中异常高表达的NRF2能够促进癌细胞的增殖和转移,进而促进前列腺癌的发生发展。Ki67常被作为判断肿瘤细胞增殖重要指标,Cyclin D1是推动细胞从G1期进入S期的特异性周期蛋白,MMP-9是基质金属蛋白酶家族中的一种明胶酶,在维持细胞外基质的降解和重塑过程中发挥着重要作用,N-cadherin是一种细胞黏附因子,在介导细胞间的黏附和迁移过程中发挥着重要作用,四者均在前列腺癌组织中均异常高表达,与肿瘤细胞的增殖、侵袭和迁移过程密切相关[18,19]。为了探讨NRF2调控前列腺癌细胞增殖和转移的分子机制,本研究在NRF2基因沉默后检测发现,PC-3细胞中Ki67、CyclinD1、MMP-9和N-cadherin蛋白的表达水平均明显受到抑制。结果提示,NRF2基因沉默可能通过抑制CyclinD1和Ki67蛋白表达抑制肿瘤细胞增殖,通过抑制MMP-9和N-cadherin蛋白表达抑制肿瘤细胞的侵袭和转移。
总之,NRF2高表达在前列腺癌细胞增殖、侵袭和转移过程中发挥着重要的促进作用,其作用机制可能与调控Ki67、CyclinD1、MMP-9和N-cadherin蛋白的表达有关。沉默NRF2基因表达,抑制肿瘤细胞增殖、侵袭和转移可能是改善和治疗前列腺癌的一种新途径。

