Hec1在膀胱癌组织中的表达及其与临床病理因素和预后的关系
苏 宏,宋 博,张珊珊,李 青,于新路,王 雪,高万峰
有丝分裂是细胞增殖周期中的主要阶段,在真核细胞分裂产生体细胞的过程中,任何一种调节机制出现异常均可引起染色体不稳定性,进而影响着肿瘤的产生和发展。癌症高表达蛋白(high expression in cancer,Hec1)由人hec基因编码,是一种富卷曲结构的核蛋白,是纺锤体正确组装的重要复合物[1]。研究表明,在多种肿瘤细胞中,Hec1的异常表达影响着细胞的发生和发展,可能是肿瘤浸润和转移的重要修饰基因。尽管Hec1在多种器官的生理生化功能研究较多,但其在生理机制及发生作用等方面的信息还比较匮乏,国内关于Hec1在人膀胱癌组织中的表达及意义还未见报道。本研究应用EnVision免疫组织化学法和Western印迹法检测膀胱癌及正常膀胱组织中Hec1的表达,探讨其与膀胱癌临床生物学行为和预后的关系。
1 材料与方法
1.1 材料 标本取自2008-08至2012-05手术切除的膀胱癌标本105例,其中武警辽宁总队医院23例,辽宁省人民医院82例。年龄38~87岁,中位年龄55.8岁。所有病例均为初次手术,术前均未行介入、放化疗等治疗,所有术后标本均由高年资病理医师参照第九版Arkman外科病理学[2]标准作出诊断,均证实为膀胱癌。组织学分级参照Elson and Ellis半定量三级分类法:Ⅰ级51例,Ⅱ级39例,Ⅲ级15例;临床TNM分期采用NCCN(2010)分期标准进行界定[3]:Ⅰ期31例,Ⅱ期23例,Ⅲ+Ⅳ期51例;伴淋巴结转移者71例,无淋巴结转移34例;肿瘤直径≤2 cm患者49例,2~5 cm患者35例,>5 cm患者21例。另取距离癌灶>5 cm处正常肾组织20例作为对照。
1.2 试剂 兔源性Hec1多克隆抗体购自上海鼎杰生物技术有限公司,Hec1兔抗人多克隆抗体购自美国Santa Cruz公司,浓度1∶100。每次染色均以膀胱癌阳性切片作为阳性对照,PBS液代替一抗作为阴性对照。
1.3 方法
1.3.1 免疫组织化学 常规方法脱蜡,石蜡组织块经4 μm连续切片,EnVision法检测Hec1的表达,具体步骤严格按试剂盒说明书进行。每次染色均以膀胱癌阳性切片作为阳性对照,PBS液代替一抗作为阴性对照。免疫组化染色结果采用双盲法判定。
1.3.2 Western印迹 于4 ℃下取等量标本(1~2 g),加大5倍湿重裂解缓冲液,粉碎匀浆后,4 ℃静置24 h,低温高速离心。取上清为总蛋白,Bradford法测定蛋白浓度,取等量蛋白进行SDS-聚丙烯酰胺凝胶电泳。取下凝胶40 V转印2 h,封闭后与抗Hec1和抗β-actin孵育过夜。经TBS、TTBS洗涤后与二抗(1∶50)室温下孵育1 h,TTBS、TBS洗涤,DAB显色。结果经自动电泳凝胶成像分析仪(Chemilmager 5500,美国)采集,进行灰度值检测。
1.4 结果判定 每张切片均由两位高级职称病理医生独立阅片,两位诊断意见均为阳性方视为阳性。按照着色强度和阳性细胞率计算评分。其中不着色者记0分,淡黄色记1分,棕黄色者记2分,棕褐色记3分;阳性细胞百分率≤5%记0分,6%~25%记1分,26%~50%记2分,51%~75%记3分,76%~100%记4分。着色强度与阳性细胞百分率的得分相乘的积即为最终得分,≥6分者即判定为阳性,<6分者即判定为阴性。
1.5 统计学处理 采用Prism 6.0软件进行数据统计处理,Hec1的表达率与患者各临床因素之间的关系采用χ2检验和Fisher确切概率法。生存分析采用K-M方法和Log-rank检验,多因素分析采用Cox比例风险模型。以P<0.05为差异有统计学意义。
2 结 果
2.1 Hec1在膀胱癌及正常组织中的表达 免疫组化结果显示,105例膀胱癌标本中,Hec1的阳性表达率为78.2%(82/105),阳性产物分布于胞核,均显示为黄色-棕褐色颗粒。在正常组织中Hec1的阳性表达率达15.0%(3/20),两者比较差异有统计学意义(P<0.01)。
2.2 Hec1的表达与膀胱癌临床病理因素的关系 Hec1的表达与患者的年龄、组织学分级及肿瘤大小均无关。但Hec1在膀胱癌中的表达随临床TNM分期的升级(P=0.042)及淋巴结转移的出现(P=0.033),Hec1的表达水平逐渐升高;5年生存的患者中Hec1(+)表达率低于没有达到5年生存的患者(χ2=5.665,P=0.021,表1)。

表1 Hec1的表达与膀胱癌临床病理因素及预后的相关性 (n;%)
2.3 Hec1的表达与膀胱癌预后的相关性分析 采用K-M法进行生存分析,结果显示Hec1(+)表达的病例无病生存率明显较Hec1(-)表达的病例差(P=0.025,图1)。Cox比例风险模型发现淋巴结转移、TNM分期以及Hec1为影响膀胱癌预后的独立因子(表2)。
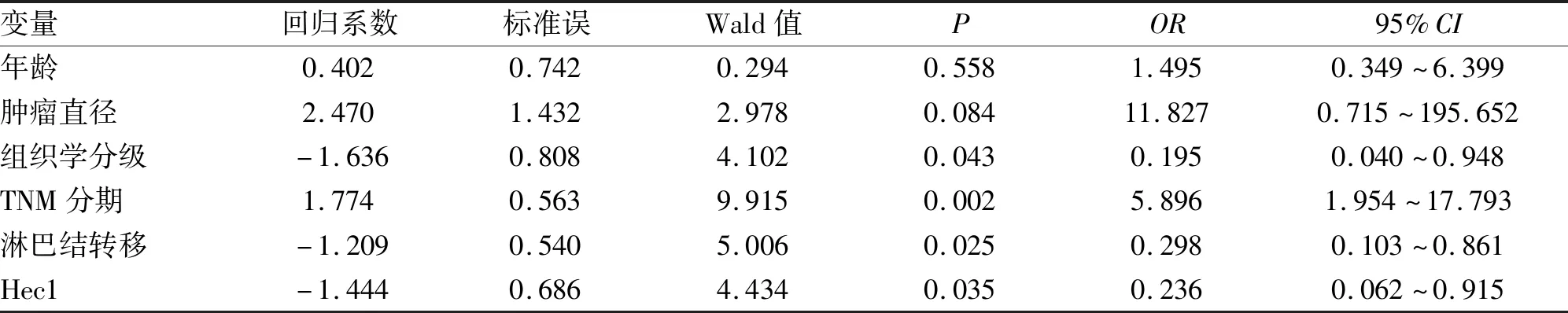
表2 Cox多因素分析膀胱癌预后的影响因素
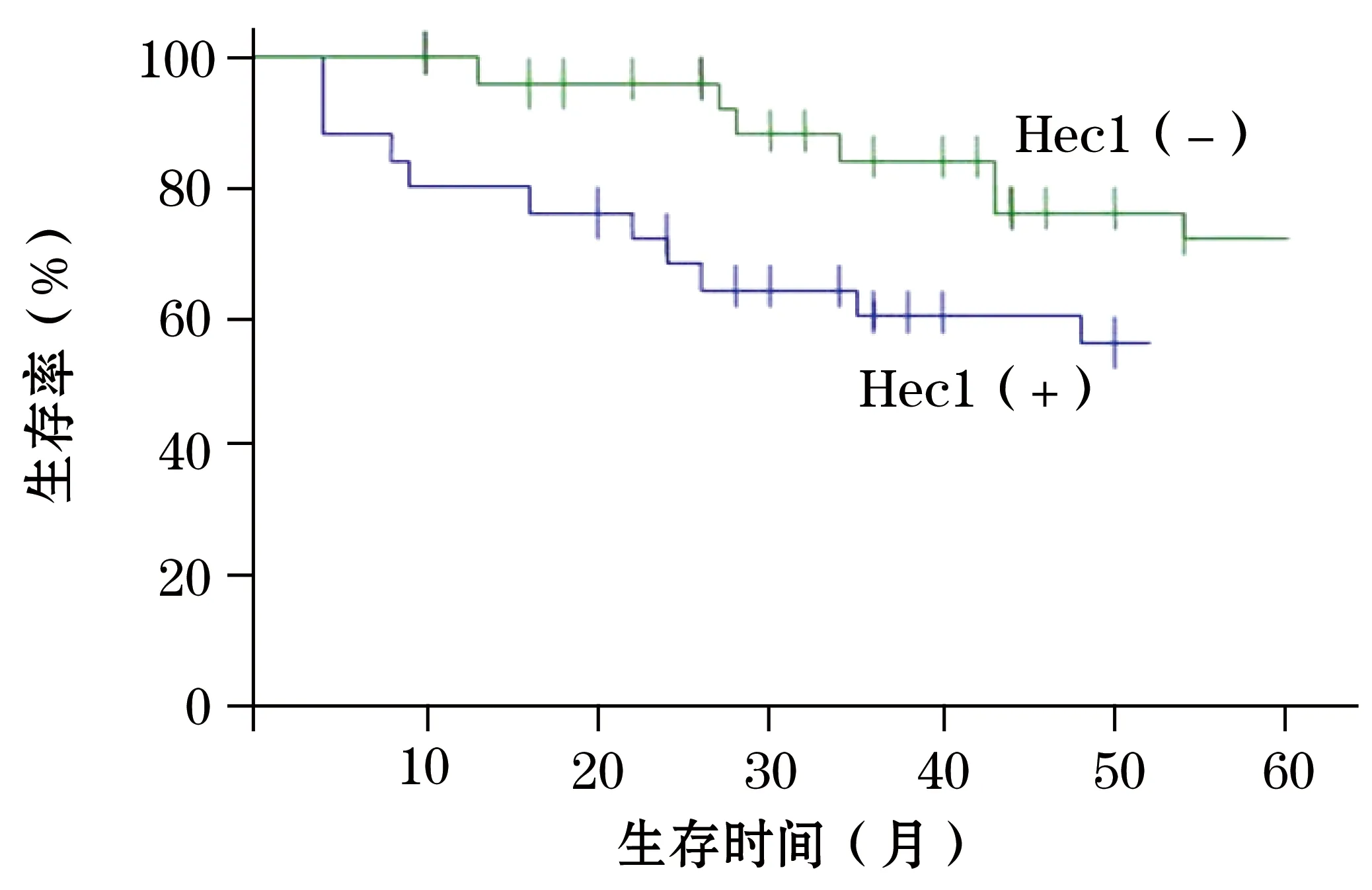
图1 膀胱癌患者5年生存曲线
3 讨 论
细胞周期检查点是保证DNA复制和染色体分配质量的检查节点,是一类负反馈调节机制。其中,处于有丝分裂期的纺锤体组装检查点是防止染色体分离错误的控制关键,可起到抑制细胞进入后期的作用,直至所有已复制的染色单体均与纺锤体有效结合。Hec1是纺锤体组装检查点复合物的重要组分,最初是以Rb蛋白为“介质”,通过酵母双杂交的方法被发现,因其在癌症中表达明显高于正常组织而被命名。Hec1在纺锤体的正确组装、染色体正确排列以及找寻有丝分裂检查点蛋白的过程中起到重要作用[4,5]。
近年多项研究表明,Hec1的表达突变在多种肿瘤组织的形成中发挥重要作用,文献[6,7]报道,Hec1在胃癌、乳腺癌等中表达明显增高,高表达的Hec1刺激癌细胞的生长和发展,可能扮演致癌基因的角色,协同参与某些肿瘤的发生发展。文献[8,9]通过加入特异性Hec1抗体发现以下几种有丝分裂的异常:染色体凝集但分离异常;中期染色体赤道板无法形成;纺锤体不能引导染色单体两极化;细胞分裂可以进行,但是杂乱的染色体分离形成变异的不能存活的子代细胞。这些结果证实Hec1在细胞有丝分裂及细胞生长中起重要作用。
本研究结果显示,Hec1在膀胱癌组织中的表达率(78.2%)明显高于正常膀胱组织(15.0%),Western印迹实验结果进一步证实,Hec1在膀胱癌组织中的表达亦显著高于癌旁正常组织,这一结果与Hec1在胃癌、结肠癌中表达增高的研究结果相一致,符合其在某些肿瘤的生长中起正向促进调节作用的条件之一。因各种因素致Hec1与着丝粒结合的减弱被证明是Hec1表达增高的主要可能性因素[10]。
本研究首次从蛋白水平检测了膀胱癌组织Hec1 的表达与临床病理特征的关系,结果提示Hec1的表达与患者的年龄、组织学分级及肿瘤大小均无关。但Hec1在膀胱癌中的表达随临床TNM分期的升级以及淋巴结转移的出现,表达水平逐渐增高。此外,本研究还证实,在Hec1(+)表达的患者中,其5年生存率明显低于Hec1(-)表达的患者组。采用K-M法进行生存分析,结果显示Hec1(+)表达的病例预后明显较Hec1(-)表达的病例差。尽管Hec1与肿瘤发生、发展的相关性研究还较少,但基于以上结果,笔者认为Hec1 的表达可能维持了细胞的正常生长和分化表型,在肿瘤的发生及癌变转化的过程中,其表达水平的增高促进了癌组织表现侵袭、浸润和转移的能力。最近研究发现[11],抑制肿瘤细胞中Hec1的表达可以促使着丝粒与微管结合力的减弱,在微管正常的情况下,少量持续存在的有丝分裂检查点蛋白(MAD2)可以引起有丝分裂检查点的持续激活,从而引起长时间的细胞周期阻滞,进而有效抑制肿瘤生长。目前有研究发现可针对Hec1的小分子抑制剂,并证明其能够抑制肿瘤生长[12]。
综上,Hec1在膀胱癌中的表达显著高于正常膀胱组织,同时其表达水平与临床分期、淋巴结转移、五年生存率等因素显著相关,提示Hec1在膀胱癌的发生发展过程中,可能起到肿瘤刺激基因的作用。从临床诊断和治疗角度考虑,针对Hec1的表达状态来评估患者病情及寻找靶向治疗药物可能成为膀胱癌未来的主要研究方向。

