短乳杆菌49蛋白提取及酶解条件优化
徐久翔,郭斯宇,钱衍霓,孙 珍
(大连工业大学生物工程学院,辽宁 大连 116034)
啤酒是一种微生物稳定的饮料,但在啤酒生产过程中,不可避免地会发生微生物污染,从而对啤酒的生产和安全构成威胁[1]。啤酒酿造过程中需要加入酒花,其可以赋予啤酒特定的苦味[2],同时酒花苦味物质能够通过破坏细胞跨膜pH梯度抑制微生物生长[3]。研究表明[4-6],酒花抗性菌株有多种机制来抵抗酒花对其产生的危害:细胞可以通过增加多药物抗性基因(HorA)的表达量将胞内积累的酒花苦味酸或其他毒性分子由胞内排出细胞外;也可以通过增加质子转运H+-ATPase酶的表达量,以排出质子来抵消酒花苦味酸的质子转运作用;还可以通过改变细胞壁上的半乳糖苷基甘油磷壁酸以及细胞膜的膜脂组分,增加细胞壁对酒花苦味酸的过膜障碍,从而造成啤酒腐败。
蛋白质组学是20世纪末发展起来的一项基于质谱对蛋白质进行研究的新兴技术[7],该技术能够在高通量水平上研究蛋白质的特征,包括蛋白的表达水平、结构、丰度变化、翻译后修饰等,对蛋白质的功能做出更精细和准确的阐述,由此获得蛋白质水平上关于疾病发生、细胞代谢等过程的整体、全面的认识[8]。使用质谱鉴定蛋白质具有灵敏、快速、重复性好、自动化程度高等特点[9]。质谱技术不是直接分析完整的蛋白分子,而是将蛋白质经过特异的蛋白酶(胰蛋白酶、糜蛋白酶等)水解,得到肽段混合物进行质谱分析[10]。蛋白质酶解过程是否充分、酶解产生的肽段分子质量是否能落在质谱扫描范围内,直接决定了蛋白质能否被鉴定到。因此,除了常规使用的胰蛋白酶,其他种类的蛋白酶(如糜蛋白酶)也可以被用来酶解蛋白质。胰蛋白酶可以特异性地切割碱性氨基酸残基(赖氨酸Lys和精氨酸Arg)的羧基末端,糜蛋白酶主要切割芳香族氨基酸残基(酪氨酸Tyr,色氨酸Trp,苯丙氨酸Phe)和亮氨酸Leu的羧基末端。糜蛋白酶与胰蛋白酶的切割位点具有高度互补性,所以可以预计,在仅使用胰蛋白酶酶切时许多不能被鉴定到的蛋白质,在使用糜蛋白酶等其他蛋白酶酶解后有可能被鉴定到[11-12]。
短乳杆菌49(Lactobacillusbrevis49)是本实验室从腐败啤酒中分离得到的酒花抗性菌株[13],希望通过利用蛋白质组学技术对L.brevis49的蛋白质组成进行研究来获取更多的酒花抗性相关信息。L.brevis49的蛋白质组成包括菌体内的蛋白质(胞内蛋白)以及分泌到培养基中的蛋白质(胞外蛋白)两部分。在细胞中,胞外分泌蛋白合成于与内质网结合的核糖体上,核糖体合成出的多肽在内质网中翻译后修饰,最后被转运到细胞外[14]。胞外分泌蛋白在细胞生长、信号传导、细胞凋亡等生命过程中起着至关重要的作用[15]。信号肽位于分泌蛋白的N端,能有效地引导新生肽穿越原核生物的质膜或真核生物的内质网膜,对于分泌蛋白的分泌起主导作用。但是,胞外蛋白提取面临着蛋白含量低、蛋白沉淀中杂质多、样品易被修饰等分析难题[16]。对于胞内蛋白,因为需要破碎细菌细胞壁才能提取胞内蛋白,而L.brevis49菌体小壁厚,所以存在着破碎困难、蛋白提取不完全等分析难题。
为了更大程度地获取L.brevis49的蛋白质信息,需要优化蛋白质的提取条件与酶解条件。本实验中,将同时对胞内蛋白提取方法与酶解方法进行优化,采用正交实验法考察破碎方法、蛋白酶种类、加酶量和酶解时间等4个影响因素,以质谱中检测到的蛋白质数目为参考指标,确定最佳的实验条件。通过优化培养基中氮源的使用,减少培养基中多种氮源对胞外蛋白检测的影响。最后,通过比较超滤法、冷丙酮法、平衡酚-丙酮法以及TCA(三氯乙酸)法等,确定最佳的胞外蛋白提取方法。
1 实验部分
1.1 材料与仪器
1.1.1主要仪器与装置 Q ExactiveTM组合型四极杆Orbitrap质谱仪:美国Thermo Fisher公司产品;Ultimate 3000 RSLC nano System:美国戴安公司产品;C18固相微萃取柱:美国Waters公司产品;C18 PepMap 100反相预柱、Acclaim PepMapTMRSLC反相分析柱:美国Thermo Fisher公司产品;Millipore超纯水处理系统:美国Millipore公司产品。
1.1.2主要材料与试剂 菌种:短乳杆菌49(Lactobacillusbrevis49),由大连工业大学微生物资源与生物催化实验室保存。
Trypsin(来源于牛胰腺,不小于10 000 BAEE单位/毫克蛋白)、Chymotrypsin(来源于牛胰腺,不小于40 单位/毫克蛋白):美国Sigma-Aldrich公司产品;超滤管:美国Millipore公司产品;BCA蛋白浓度测定试剂盒:中国碧云天生物技术有限公司产品;低背景银染试剂盒:中国生工生物工程有限公司产品。
乙腈、甲醇、超纯水:均为色谱纯,美国Thermo Fisher公司产品;甲酸:质谱纯,美国Sigma-Aldrich公司产品;尿素、三羟甲基氨基甲烷(Tris):中国生工生物工程有限公司产品;二硫苏糖醇(DTT)、碘代乙酰胺:美国Sigma公司产品;其他未特殊提到的试剂皆为分析纯。
1.2 培养基
采用MRS培养基提取胞内蛋白,包含0.4%酵母浸膏、0.5%D-麦芽糖、1%蛋白胨、0.8%牛肉膏、2%无水葡萄糖、0.5%无水乙酸钠、0.1%吐温-80、0.2%磷酸氢二钾、0.2%柠檬酸三铵、0.02%硫酸镁、0.005%硫酸锰和水。
1.3 胞内蛋白的提取
将培养到对数生长中期的菌株在6 000 r/min条件下离心10 min,取沉淀的菌体,用milli-Q水洗2遍,再使用相同体积的缓冲溶液(50 mmol/L Tris-HCl,pH 8.0)洗2遍,冻干得到菌体干粉,-80 ℃冷冻保存。
1.4 胞外蛋白的提取
将培养到对数生长中期的菌株在6 000 r/min条件下离心10 min,取上清发酵液过0.22 μm膜,相同体积分装4份。
1.4.1TCA-丙酮沉淀法提取蛋白 向发酵液中加入1/10样品体积的100%TCA,置于冰上30 min,然后在4 ℃下以10 000 r/min离心 10 min,去除上清液;再加入1/10样品体积的丙酮,混匀后在4 ℃下以10 000 r/min离心5 min,洗涤2次后从沉淀中去除丙酮,风干沉淀60 min;最后加入适量的缓冲溶液(8 mol/L尿素,50 mmol/L Tris-HCl,pH 8.0)溶解沉淀,于-80 ℃保存。
1.4.2冷丙酮沉淀法提取蛋白 向发酵液中加入冷丙酮(发酵液∶冷丙酮=1∶4,V/V),混匀,于-20 ℃过夜,次日在4 ℃下以10 000 r/min离心10 min后弃去上清液,沉淀自然风干,加入适量的缓冲溶液(8 mol/L尿素,50 mmol/L Tris-HCl,pH 8.0)溶解,于-80 ℃保存。
1.4.3超滤沉淀法提取蛋白 将发酵液加入截留分子质量10 kDa的超滤管中,在4 ℃下以10 000 r/min离心至超滤管中液面不再下降,再加入适量的缓冲溶液(8 mol/L尿素,50 mmol/L Tris-HCl,pH 8.0)继续离心直至液面不再下降,取出内管中的溶液,于-80 ℃保存。
1.4.4平衡酚-丙酮沉淀法提取蛋白 将发酵液加入相同体积的Tris-平衡酚,置于冰上30 min,并每隔10 min取出振荡摇匀,然后在4 ℃下以10 000 r/min离心10 min,取出上层酚相及中间层后,加入3倍体积的乙酸铵-甲醇(100 mmol/L),于-20 ℃过夜。次日,以10 000 r/min离心10 min后弃去上清液,将沉淀用含0.1% DTT的冷丙酮离心,然后用冷丙酮清洗,得到的蛋白样品自然风干,加入适量缓冲溶液(8 mol/L尿素,50 mmol/L Tris-HCl,pH 8.0)溶解,于-80 ℃保存[17]。
1.5 总蛋白浓度的测定
采用BCA蛋白浓度测定试剂盒测定总蛋白浓度,具体实验步骤按说明书进行操作。
1.6 SDS-PAGE电泳
配制12%分离胶和5%浓缩胶,上样量10 μL,设置电压170 V,电流20 mA。直至溴酚蓝移动到胶条的最底端,用低背景银染试剂盒进行染色。
1.7 质谱样品的制备
将50 g蛋白质溶液复溶在8 mol/L尿素+50 mmol/L Tris-HCl(pH 8.0)中,然后用10 mmol/L二硫苏糖醇在37 ℃下还原1 h,并在室温避光环境下用20 mmol/L碘代乙酰胺烷基化40 min。然后将溶液中尿素浓度稀释到1 mol/L,加入一定比例的蛋白酶,37 ℃孵育得到肽段。酶解反应结束后,经C18固相微萃取柱除盐,真空浓缩仪旋转蒸干后,将蒸干的肽段溶解在0.1%甲酸中。
1.8 实验条件
1.8.1色谱条件 复溶后的肽段样品经Ultimate 3000 RSLC nano System上样加载到C18 PepMap100反相预柱上,使用Acclaim PepMapTMRSLC反相分析柱进行肽分离,流动相组成分别为0.1%甲酸溶液(A相)和80%乙腈-20%H2O-0.1%甲酸溶液(B相),流速0.2 μL/min。线性洗脱程序:0~10 min(4%B),10~13 min(4%~10%B),13~35 min(10%~35%B),35~41 min(35%~55%B),41~42 min(55%~95%B),42~52 min(95%B),52~53 min(95%~4%B),53~70 min(4%B)。
1.8.2质谱条件 样品通过nanoESI源离子化,在Q Exactive中进行串联质谱分析(MS/MS)。Orbitrap检测完整肽段的分辨率设为70 000;使用27%标准化碰撞能量对选定的肽段进行MS/MS分析;Orbitrap检测离子碎片的分辨率设为17 500。选取高于阈值离子计数3×106的前15个母离子在一级MS全扫描之后进行MS/MS分析,动态排除设为 30.0 s,施加的喷雾电压为2.5 kV,MS/MS的自动增益控制(AGC)设为1×105,一级质谱扫描范围为m/z350~1 800。使用Proteome Discoverer 2.2.0.388处理得到的MS/MS数据,肽段的假阳性鉴定率设为小于1%。根据实际使用的酶设定切割位点,允许2个漏切位点。前体离子的质量误差设定为1×10-5,碎片离子的质量误差设定为0.02 Da。动态修饰设为甲硫氨酸上+15.995 Da的Oxidation修饰,静态修饰设为半胱氨酸上+57.021 Da的Carbamidomethyl修饰。
2 结果与讨论
对培养基氮源和胞外蛋白提取工艺进行优化;采用正交实验法考察破壁方法、蛋白酶、酶解时间及酶用量4个因素对胞内蛋白的提取条件,具体的实验流程及结果示于图1。
2.1 L. brevis 49胞内蛋白提取及含量测定
通过超声破碎、液氮研磨和溶菌酶3种破壁方法获得的短乳杆菌胞内蛋白,经BCA蛋白定量法测定的结果列于表1。结果表明,处理相同质量的菌体干粉,超声破碎法提取胞内蛋白的效率较高。因杆菌体积小,液氮研磨和溶菌酶法破碎过程较为困难,所以提取效果较差。
单向电泳结果表明:样品溶液通过SDS-PAGE电泳显示较明显,3种破壁方法所得蛋白条带均较清晰,其中超声破碎法提取的蛋白条带颜色较深,L.brevis49胞内蛋白的分子质量分布较广,主要集中在20.1~66.4 kDa之间,低于20.1 kDa的蛋白较少,示于图2。
2.2 正交实验结果
由于破壁方法、蛋白酶、酶解时间、酶用量是影响蛋白提取和水解的主要因素,因此以4因素3水平安排正交表L9(34)。破壁方法:a1=超声破碎,a2=液氮研磨,a3=溶菌酶法;蛋白酶:b1=胰蛋白酶,b2=糜蛋白酶,b3=胰蛋白酶+糜蛋白酶;酶用量(酶与蛋白质量比):c1=1∶40,c2=1∶50,c3=1∶60;酶解时间:d1=12 h,d2=16 h,d3=20 h。每组实验中处理相同量的蛋白,结果和极差分析列于表2。
表2中的极差分析结果显示,在影响胞内蛋白酶解的4个主要因素中,蛋白酶的影响最为显著,破壁方法、酶解时间和酶用量次之。

图1 实验流程图Fig.1 Experimental flow chart

表1 不同破壁方法处理得到的蛋白浓度Table 1 Protein concentration obtained by different disruption methods

注:M.低分子质量蛋白质标记物;1.溶菌酶法;2.液氮研磨法;3.超声破碎法 图2 胞内蛋白SDS-PAGE电泳分析Fig.2 SDS-PAGE analysis of intracellular protein

表2 正交实验分析结果Table 2 Analysis results of orthogonal test
注:K1,K2,K3为每个因素各水平下的指标总和;Rj为每个因素的极差值
当使用两种酶组合作用时,在酶解时间较短的情况下即可达到较好的酶解效果。选取3种蛋白,分别经过不同条件的酶解后得到的肽段有很大差异,两种酶共同作用可以得到更大的覆盖率,如SZ_GM000147蛋白覆盖率提高了2.4倍,SZ_GM000224蛋白提高了2.7倍,而SZ_GM002491蛋白提高了近10倍。这可能是由于单一酶作用的切割位点单一,造成个别肽段过长、质荷比偏大,超过检测范围,利用胰蛋白酶和糜蛋白酶互补的性质对蛋白共同切割,能够使更多的肽段落在检测范围内,结果列于表3。结合表1中的结果,超声破碎法提取的胞内蛋白浓度最高。这4个因素的最优组合为:破壁方法为超声破碎法,蛋白酶为胰蛋白酶和糜蛋白酶组合使用,酶用量为1∶50,酶解时间为12 h。
2.3 培养基氮源成分优化
在质谱分析时,培养基中的氮源会影响胞外蛋白的检测,因此本实验对培养基氮源进行了优化。在MRS培养基的基础上,固定其他成分不变,采用不同的氮源分别作为MRS中唯一的氮源配制培养基接种培养,根据菌体生长情况对其最优氮源进行筛选。本实验以MRS中酵母浸粉、牛肉膏和蛋白胨3种氮源分别按1%和0.8%加入培养基中,接入相同量的种子液,在30 ℃摇床中培养,测得的生长曲线示于图3a。由图3a可知,酵母浸粉作为培养基唯一的有机氮源时,L.brevis49可以更好地生长,并在12 h进入对数期,在36 h时OD600可以达到2.0以上;牛肉膏和蛋白胨作为氮源时,L.brevis49生长趋势较差,且无法呈对数生长。因为胞外蛋白提取面临诸多困难,在保证菌株较好生长的前提下,才能提取足够多的胞外蛋白,所以选用酵母浸粉作为培养基中的唯一氮源。将酵母浸粉按1%、0.8%、0.6%、0.4%和0.2%加入无氮源MRS中培养48 h,对比不同酵母浸粉添加比例的培养基中L.brevis49的生长情况,结果示于图3b。含0.6%及以上的酵母浸粉培养基中L.brevis49的OD600均可以达到 1.7以上。为了降低培养基中氮源对胞外蛋白检测的干扰,选用0.6%酵母浸粉作为培养基中的单一氮源。

表3 不同酶切方法得到的蛋白肽段信息Table 3 Information of digested peptides of three proteins by different enzyme digestion methods

注:a.3种不同氮源培养基(蛋白胨、酵母浸粉、牛肉膏);b.不同的酵母浸粉添加量图3 利用不同氮源培养的L. brevis 49生长曲线Fig.3 L. brevis 49 growth curves cultured with different nitrogen sources
2.4 培养过程中胞外蛋白浓度与生长曲线的关系
将活化的L.brevis49接入含0.6%酵母浸粉的改良MRS培养基中,每隔12 h用分光光度计测菌浓,同时测培养基中的蛋白浓度,结果示于图4。经过活化培养后的L.brevis49接种到改良后的MRS培养基中,在36 h菌株处于对数中期,代谢旺盛,胞外蛋白一直处于分泌状态且含量较高。而稳定后期至衰亡期,菌体细胞逐渐老化并出现自溶现象,会将胞内蛋白释放到培养液中,干扰胞外蛋白的提取。因此,为了提取更多种类的乳杆菌胞外蛋白,选取36 h作为L.brevis49菌胞外蛋白提取时间。

图4 生长曲线与胞外蛋白浓度的关系图Fig.4 Relationship between growth curve and extracellular protein concentration
2.5 信号肽分析
本实验分别采用超滤法、冷丙酮法、平衡酚-丙酮法以及TCA法等蛋白质提取方法处理相同体积的发酵液,其中TCA法的提取效率较高,蛋白组数远远高于其他提取方法。对提取到的蛋白经SignalIP 4.1分析,TCA法提取的蛋白中44个有信号肽剪切位点,属于分泌蛋白;冷丙酮法提取的蛋白中25个有信号肽剪切位点;超滤法和饱和平衡酚法提取的蛋白中分别仅有9个和4个信号肽剪切位点,结果列于表4。在实验过程中,冷丙酮法和超滤法得到的蛋白颜色较深且粘稠,可能是由于培养液中含有的多肽、有机提取物以及色素等复杂组分大量沉淀下来,影响蛋白浓度的测定。TCA法和平衡酚法得到的蛋白受到的影响较小。
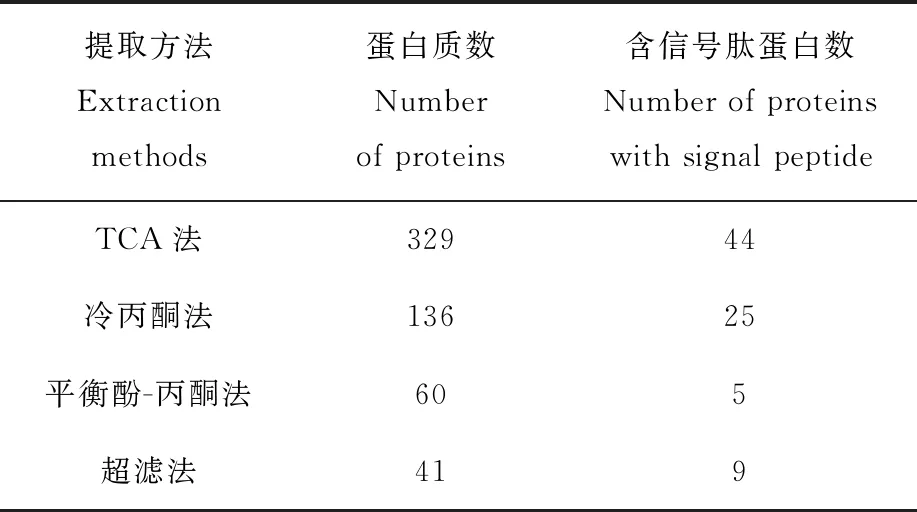
表4 不同提取方法得到的蛋白质信号肽分析Table 4 Signal peptide analysis of proteins obtained by different extraction methods
在含信号肽的蛋白中,有4个蛋白均可由4种提取方法提取并鉴定,分别是SZ_GM001307、SZ_GM000172、SZ_GM000166、SZ_GM000887。对于同一蛋白而言,利用TCA法得到的肽段数目最多,结果列于表5。在TCA法得到的蛋白样品中,含有更多该蛋白的肽段,推测TCA法在得到更多种类蛋白的同时,对同一种蛋白可以得到的蛋白含量也会更多,从而能够检测到更多的肽段。
AGGLTTDTPAATATDNNSVTIK为蛋白质SZ_GM001307的肽段,使用TCA法和平衡酚-丙酮法处理得到该肽段的二级质谱图示于图5。N端二级碎片离子b+与C端二级碎片离子y+的数量和含量均关系到谱图质量的好坏以及后续肽段的鉴定。图5a中b+和y+的数量均明显多于图5b。因此,TCA法处理得到的蛋白质肽段数量更多,从而提高了蛋白质的覆盖率,对于低丰度的蛋白质,将有更大的概率被检测到。
3 结果
本研究以水解后经LC-MS/MS分析得到的蛋白组数为依据来确定最佳的酶解条件。实验结果表明:提取L.brevis49胞内蛋白最佳的破壁方法为超声破碎法,胞内蛋白的最佳水解酶为糜蛋白酶和胰蛋白酶共同作用,最佳添加比例为1∶50,最佳酶解时间为12 h。
提取L.brevis49胞外蛋白对培养基进行优化,在改良后的MRS培养基中加入0.6%酵母浸粉作为单一氮源可以保证菌株正常生长,并尽可能地降低培养基中氮源对胞外蛋白检测的干扰。TCA法提取所得蛋白较纯,且较低丰度的蛋白也可以被保留,与 LC-MS/MS结合检测蛋白和信号肽,效率较高,适于乳杆菌胞外蛋白提取。希望该方法可为啤酒的安全检测和鉴定提供参考。
在后续的工作中,将选择敏感株作为对照组,用优化的方法提取敏感株和酒花抗性株菌的胞内蛋白及胞外蛋白,比较蛋白质组成差异。由于胞内蛋白和胞外蛋白有协同作用,预计抗性株细胞的酒花抗性与胞内蛋白和胞外蛋白均有关,所以提取胞外蛋白和胞内蛋白的效率至关重要。

表5 不同提取方法得到的含信号肽蛋白的鉴定肽段数目Table 5 Number of identified peptides of signal peptide-containing protein obtained by different extraction methods
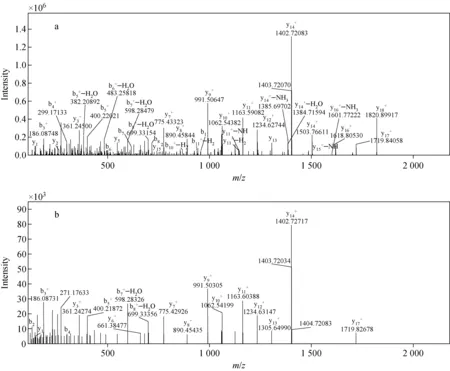
注:a.TCA法;b.平衡酚-丙酮法图5 肽段AGGLTTDTPAATATDNNSVTIK的二级质谱图Fig.5 MS/MS spectra of AGGLTTDTPAATATDNNSVTIK

