基于液相色谱-质谱的血清糖蛋白质组定量分析
胡丹阳,蒋碧云,王 献,刘晓慧
(1.中南民族大学化学与材料科学学院,国家民事委员会分析化学重点实验室,湖北 武汉 430074;2.复旦大学生物医学研究院,上海 200032)
糖基化是一种具有重要生物学功能的蛋白质翻译后修饰。与许多其他翻译后修饰不同,蛋白质的N糖基化的主要结构N-聚糖是由许多单糖单元组成,且呈非线性排列,具有结构多样性,研究蛋白质的糖基化对了解其生物学结构和功能有着重要意义,如对糖蛋白和糖基化位点、对糖型进行鉴定等[1-3]。研究表明[4-7],糖蛋白参与了很多重要的生物学过程,包括细胞粘附、分子运输、受体激活和特定的蛋白功能等,许多疾病的病理过程与糖蛋白表达量的变化密切相关。据报道[8-9],美国食品药品监督局批准的25%肿瘤标志物都是糖蛋白,例如载脂蛋白A1、甲胎蛋白(α-Fetoprotein)、癌胚抗原(carcinoembryonic antigen)等。
研究蛋白质糖基化具有一定难度。糖蛋白在复杂样品中的含量较低,糖肽的离子化效率有限,其质谱响应信号强度远低于非糖肽,且具有高度的微观不均一性,若糖蛋白、糖肽不经富集,几乎无法用于质谱直接鉴定[10-12]。因此,为获得较理想的质谱信息,在样品处理过程中,将糖蛋白、糖肽从复杂样品中富集出来是关键步骤。常见的糖蛋白/糖肽富集方法包括凝集素富集法、肼化学富集法[13]、两性离子亲水相互作用色谱富集法(zwitterionic hydrophilic interaction liquid chromatography, ZIC-HILIC)等。凝集素富集法是通过凝集素选择性地识别某些特殊结构的单糖或聚糖而实现对糖蛋白的富集,虽然该法具有高度的特异性,但凝集素与糖蛋白的结合力较弱[14]。肼化学富集法是通过糖链的顺式二羟基被高碘酸钠氧化形成二醛,然后与固定相上的肼官能团反应形成腙进行富集,其特异性好、效率高,但糖链结构会受到破坏[15]。糖基化修饰中的聚糖基团具有亲水性,亲水相互作用色谱法(hydrophilic interaction liquid chromatography, HILIC)不需要对样品进行衍生,具有较强的保留能力。在此基础上发展的两性离子亲水相互作用色谱(ZIC-HILIC)则是利用电荷相互作用和亲水相互作用富集糖肽,固定相上存在正电荷和负电荷的中心,可以和被分析物表面基团以及流动相中的电解质产生电荷相互作用和电荷-偶极相互作用,从而对糖肽进行富集[16]。该方法高效、快速、不易破坏糖链。
糖尿病是一种以高血糖为特征的代谢性疾病,目前糖尿病患者需终生服药,饮食方面有诸多禁忌,严重影响生活质量。糖尿病还伴随多种并发症,长期血糖升高会对心脏、血管、眼睛、肾脏和神经系统造成较大损伤。目前,全球已有超过4亿人患有糖尿病[17],我国的糖尿病患者约9 500万,糖尿病前期患者约1.5亿[18]。研究发现,患者糖蛋白的表达量发生了变化[19-21],O-糖基化糖蛋白在糖尿病及其并发症的病因及形成中有重要作用[22],但关于N-糖基化糖蛋白的相关报道较少。
本工作拟以6例正常人与6例糖尿病人的血清为样品,深入研究N-糖蛋白,对血清进行蛋白质组学和糖蛋白质组学的非标记定量(label-free quantification),以系统、全面地揭示糖尿病发病过程中蛋白质和糖基化后修饰的变化,希望为进一步揭示糖尿病的发病机理提供参考。
1 实验部分
1.1 主要仪器与试剂
Eksigent UPLC超高效液相色谱仪、Triple-TOFTM5600高分辨质谱仪:均为美国AB Sciex公司产品;Milli-Q超纯水系统:美国Millipore公司产品;C18除盐柱:美国Waters公司产品;离心机、真空浓缩仪器、恒温混匀仪:德国Eppendorf公司产品;两性离子亲水相互作用填料(ZIC-HILIC particles)、-80 ℃超低温冰箱:美国Thermo Fisher公司产品。
糖尿病人血清、正常人血清:由中山医院提供;碳酸氢铵、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、三氟乙酸(TFA):均为美国Sigma公司产品;胰蛋白酶(Trypsin):美国Promega公司产品;肽N-糖苷酶F(PNGaseF):美国New England Biolabs公司产品;乙腈(ACN):德国Merck公司产品;甲酸:美国Fisher Scientific公司产品。
1.2 血清收集与处理
将采集的血液样品在不加抗凝剂的情况下室温静置1 h凝血,随后以1 500 r/min离心10 min,取上清液得到血清,分装并置于-80 ℃冰箱保存。实验时取出血清,在冰上进行解冻,低温下以14 000 r/min离心30 min,取中层血清于离心管中,并编号。
1.3 蛋白质酶解与C18除盐
各取55 μL每例血清,分别加入终浓度为1 mol/L尿素和100 mmol/L碳酸氢铵溶液稀释后,使血清蛋白质充分变性,然后加入终浓度为10 mmol/L二硫苏糖醇,于56 ℃恒温反应1 h;避光加入终浓度25 mmol/L碘乙酰胺,于37 ℃避光振荡30 min;按照胰蛋白酶与蛋白质量比1∶50加入胰蛋白酶,于37 ℃反应过夜;将酶解后的溶液以14 000 r/min离心15 min去除悬浮微粒,然后加入200 μL 乙腈活化C18柱,用200 μL 0.1%三氟乙酸平衡柱子;将酶解好的蛋白质溶液重复上样3次,并用0.1%三氟乙酸清洗3次;依次用200 μL 30%乙腈+0.1%三氟乙酸、60%乙腈+0.1%三氟乙酸将肽段从C18柱上洗脱下来,将多次洗脱液混合均匀后,各取每个样品40 μL洗脱液于离心管中,在冻干机中冻干,直接用于蛋白水平质谱鉴定;将剩余的洗脱液置于冻干机中冻干,待糖肽富集实验。
1.4 糖肽富集
将上述剩余肽段用200 μL 80%乙腈+1%三氟乙酸溶液溶解,并用200 μL 80%乙腈+1%三氟乙酸溶液平衡活化ZIC-HILIC柱3次,重复上样3次,用80%乙腈+1%三氟乙酸淋洗6次除去未结合的肽段;然后将保留于ZIC-HILIC柱上的糖肽用0.1%TFA洗脱2次,收集洗脱液,冻干后置于-20 ℃冰箱中备用。将富集的糖肽用100 mmol/L碳酸氢铵溶解,向其中加入PNGaseF酶,并在37 ℃孵育振荡过夜处理;将酶解后的肽段冻干,并用0.1%甲酸溶解,待LC-MS/MS分析,所有样品处理过程一致。
1.5 实验条件
用于做全蛋白质组分析的肽段以及经富集后的糖肽,均以相同的液相色谱和质谱条件进行分析。采用Eksigent UPLC色谱仪与AB Sciex TripleTOF®5600质谱仪联用系统进行LC-MS/MS实验。
1.5.1色谱条件 C18反相色谱柱(0.3 mm×150 mm×3 μm);流动相:A为0.1%FA水溶液,B为0.1%FA的乙腈溶液;流速5 μL/min;洗脱程序:0~1 min(5%~7%B),1~94 min(7%~24%B),94~109 min(24%~38%B),109~109.5 min(38%~80%B),109.5~114 min(80%B),114~114.5 min(80%~5%B),114.5~119 min(5%B)。
1.5.2质谱条件 正离子模式检测;气帘气压强172.4 kPa;喷雾电压2 300 V;一级质谱采集的质量扫描范围为m/z350~1 250;采集模式为数据依赖采集,并选取丰度最高的20个母离子进行二级扫描;动态排除时间为14 s,排除已检测到的离子;检测的肽段所带电荷数为2~4。
1.6 数据库检索
质谱数据使用 Maxquant(1.6.0.1版本)软件进行分析,以Uniprot_human(20 394条肽段)为蛋白数据库进行搜库。搜索参数:Trypsin蛋白酶,糖肽/糖蛋白鉴定漏切上限是2个(全蛋白组漏切位点参数设置为1);可变修饰(variable modification):蛋白N端乙酰化(N-terminal acetylatin(+42.01 u)),甲硫氨酸上的氧化修饰(oxidation[M](+15.99 u)),天冬酰胺脱酰胺基(deamidated-N(+0.98 u))(仅限于糖蛋白);固定修饰(fixed modification):半胱氨酸的还原烷基化修饰(carbamidomethy[C],(+57.02 u));MS的质量误差为40×10-6,MS/MS的质量误差设为0.1 u,蛋白假阳性率(false discovery rate, FDR)设为1%;组间匹配(match between runs):匹配时间窗口为0.7;对齐时间窗口为20;非标定量参数:LFQ label-free定量,设定选择独有肽段(unique peptide)的强度信息进行定量。各组数据依据总强度信息进行强度归一化后,组间通过肽段强度进行定量分析。
2 结果与讨论
2.1 实验方法
作为最广泛的蛋白后修饰,糖基化修饰在疾病的发生和发展过程中受到较多关注。糖蛋白天然丰度较低,非糖基化肽会严重干扰糖肽的信号,因此蛋白富集是糖蛋白组学分析中的重要环节之一。 ZIC-HILIC是一种简单、快速且高通量的糖蛋白富集方法,处理过程不需要衍生,且不破坏糖链结构,因此被广泛应用于糖基化位点、完整糖肽和位点特异性的糖蛋白分析。本研究采用ZIC-HILIC对糖肽进行富集和分析,为了更准确地找到糖基化水平发生变化的蛋白质,选用未经富集的肽段进行定量分析,以蛋白质表达水平作为参考,同时找出差异蛋白质和糖基化水平发生变化的差异糖蛋白质信息,作为研究糖尿病发生发展的参考。
常规蛋白质组学研究采用的纳升级液相色谱-质谱法(nano-LC-MS/MS)具有检测灵敏度高的特点,但是也存在较多缺点。首先,nano-LC-MS/MS的负载容量低,导致生物基质中的浓度敏感度较低;其次,操作稳定性相对较差,需要耗费大量的人力、物力用来维护仪器,且分析通量相对较低,限制了其在大型队列分析中的应用。为了增加分析通量,且保证定量分析的稳定性,本研究选择微升级液相色谱-质谱法(micro-LC-MS/MS),同时采用label-free方法进行定量分析,一次分析12个样品的蛋白质组差异和糖蛋白质组差异。
血清样品取材侵入性小、易于保存,且包含了机体丰富的生理病理信息,是疾病早期诊断和预后研究中重要的生物样品材料。因此,本研究以6例正常人与6例糖尿病人的血清为样品,对其进行Trypsin酶解后分成2份,其中1份进行LC-MS/MS分析,得到全蛋白质组的定性和定量结果;另一份经HILIC富集糖肽与PNGaseF酶切糖肽后进行LC-MS/MS鉴定,得到糖肽的鉴定和差异表达结果,实验流程示于图1。
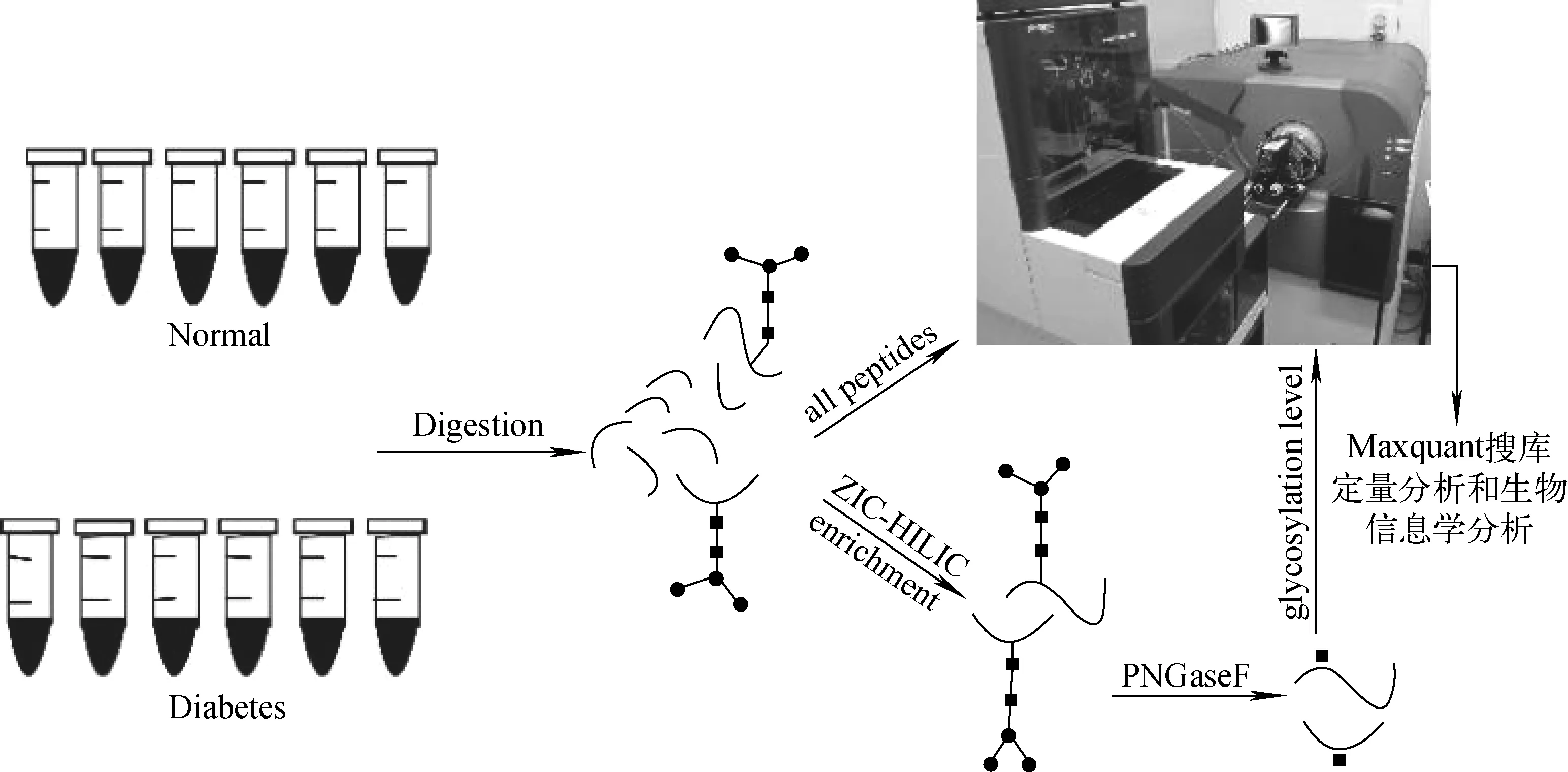
图1 实验流程图Fig.1 Flow chart of analysis of serum
2.2 血清蛋白与糖蛋白定量结果分析
通过Maxquant搜库得到6例正常人与6例糖尿病人血清样品的质谱数据信息,在蛋白质水平上,选取2种样品均含有的肽段进行去冗余,共鉴定出291个非冗余蛋白质和2 500条非冗余肽段;在糖肽水平上,首先以Deamidated为条件筛选出糖基化的肽段,选取2种样品均含有的糖基化肽段去冗余,并找出具有糖基化位点序列特征(N-!P-S/T/C,其中!P不是脯氨酸)的肽段,结果共鉴定到181个非冗余糖蛋白和637条非冗余糖基化肽段。
采用Student’s T-test,以蛋白质在糖尿病患者血清和正常人血清中表达含量作为参考,找出具有显著性差异的蛋白(P<0.05),并分别以两组样品中的蛋白强度平均值计算含量比值。为找到更多的差异蛋白质,采用表达量± 20%为差异,即蛋白在糖尿病患者血清中相比正常人血清升高1.2倍或者降低0.8倍为参考值[23-25]。在蛋白水平上共分析得到65种差异蛋白质,其中有29种显著下调,36种显著上调,结果列于表1。在糖蛋白水平上,分析得到24种正常人血清与糖尿病患者血清的差异糖蛋白,其中有17种显著上调,7种显著下调,并对糖蛋白的位点进行标注,结果列于表2。

表1 蛋白水平上差异蛋白信息Table 1 Information of differential protein on protein level

续表1

续表1
注:#DIV/0!代表正常血清6次重复中有0次有定量值的情况

表2 糖尿病人与正常人血清的差异糖蛋白信息Table 2 Differential glycoprotein information between diabetic and normal human serum
注:*表示糖蛋白的位点
2.3 蛋白与糖蛋白水平的比较分析
通过比较蛋白和糖基化水平的蛋白质,发现有21种蛋白质在蛋白水平上无差异而糖基化水平表达有差异,结果列于表3。选取其中2种代表性的糖蛋白进行分析。
硒蛋白P是一种特殊的细胞外糖蛋白,有研究表明[26-28],无论硒蛋白过量或缺乏,均会引起体内葡萄糖稳态的异常调节。本研究中,糖尿病患者血清中的硒蛋白P有1.7倍上调,根据文献报道[27],硒蛋白P通过抑制肝脏中AMP活化蛋白激酶和乙酰CoA羧化酶的磷酸化水平抑制胰岛素信号转导,从而导致胰岛素抵抗和糖尿病的发生和发展。
载脂蛋白B-100的主要功能是:1) 将胆固醇运送到外周组织;2) 识别、调节低密度脂蛋白受体与低密度脂蛋白的结合;3) 刺激血管平滑肌增生,与内膜基质结合[29]。结果表明,糖尿病患者血清中的载脂蛋白B-100的含量有2.83倍上调,可能是由于糖尿病患者血浆中低密度脂蛋白胆固醇浓度升高,或高血糖下低密度脂蛋白修饰使其无法进入正常的代谢途径,从而引起病变[30]。

表3 蛋白水平无差异而糖基化水平有差异的蛋白质信息Table 3 Protein information with no difference in protein levels and difference in glycosylation levels
2.4 差异蛋白与糖蛋白的功能富集分析及比较
为了深入了解鉴定到的差异蛋白与差异糖蛋白所属的细胞组分、对应的分子功能和参与的生物学过程,本实验使用DAVID软件(https:∥david.ncifcrf.gov/)对鉴定到的差异蛋白与差异糖蛋白进行基因本体功能富集分析(gene ontology, GO),结果示于图2。
从图2可见,差异蛋白质主要集中在血微粒、细胞外区域、胞外外泌体、细胞外间隙等区域;差异糖蛋白质主要集中于血微粒、细胞外区域、血小板、胞外外泌体等区域。在分子功能富集分析中,差异蛋白质行使的分子功能包括丝氨酸型肽链内切酶活性、丝氨酸型肽链内切酶抑制剂活性、肽链内切酶抑制剂活性、肝素结合等;差异糖蛋白的分子功能包括丝氨酸型肽链内切酶活性、肝素结合、丝氨酸型肽链内切酶抑制剂活性、免疫球蛋白A结合等。差异蛋白参与的主要生物学过程包括补体激活(经典途径)、血小板解聚、补体激活的调节、补体激活等;差异糖蛋白参与的生物进程有血小板解聚、凝血(内在途经)、受体介导内吞作用、凝血等。
比较差异蛋白质与差异糖蛋白质功能富集结果,发现二者细胞定位接近;在分子功能上,差异蛋白质中丝氨酸型肽链内切酶活性、丝氨酸型肽链内切酶抑制剂活性所占比例与差异糖蛋白中相应比例相差较大;生物过程中,差异蛋白参与的生物过程较多,且分布相对均匀,差异糖蛋白中血小板解聚以及凝血相关过程所占比例较大。
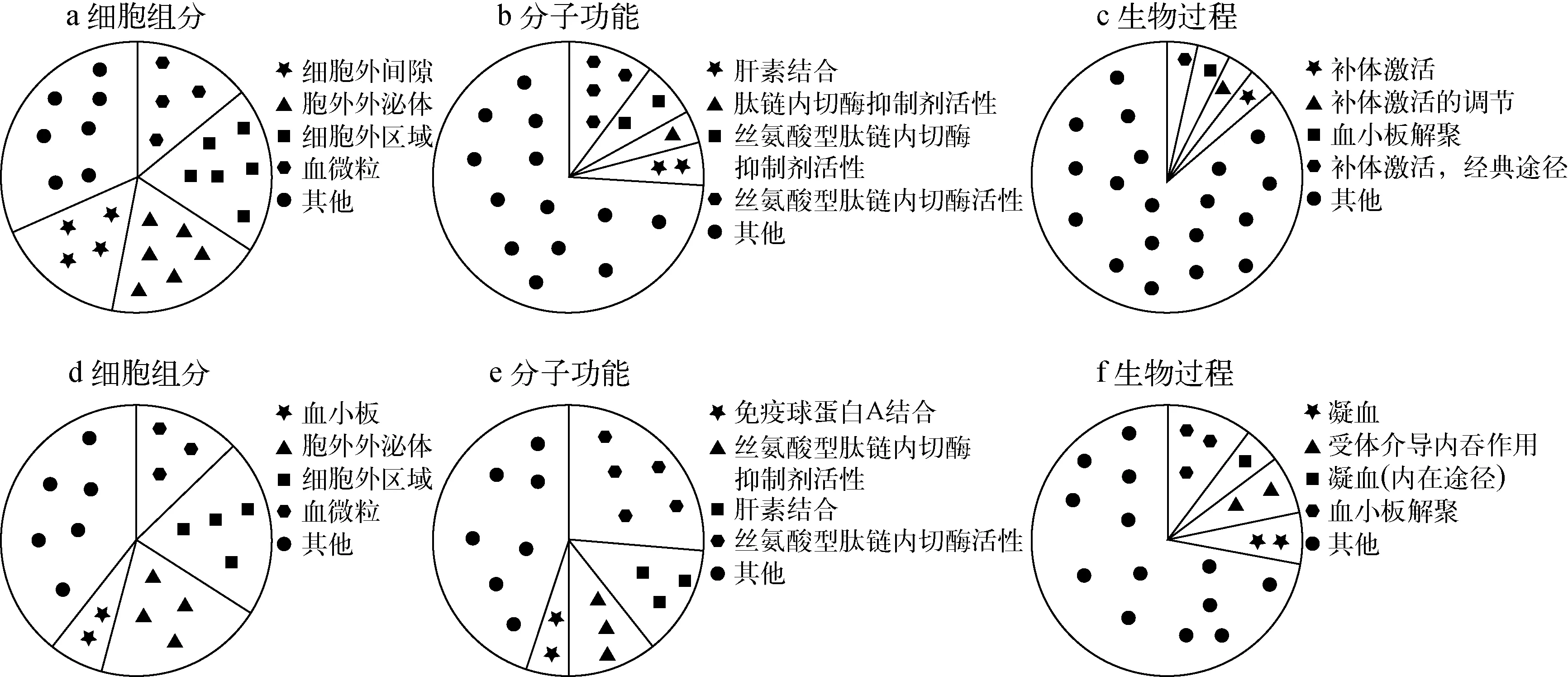
图2 差异蛋白(a,b,c)与差异糖蛋白(d,e,f)的GO分析图Fig.2 GO analysis of differentially expressed proteins (a, b, c) and differentially expressed glycoproteins (d, e, f)
3 结论
为揭示糖尿病发病过程中糖蛋白的变化,本研究根据糖尿病的特点以及分析要求,从样品选择、糖肽富集方法、LC-MS/MS分析和数据处理等方面进行了探讨。选择血清作为研究对象,并选用稳定性好的micro-LC-MS/MS方法进行label-free检测,建立了基于所有肽段与ZIC-HILIC富集后肽段双重定量的方法以确定蛋白质糖基化的差异。结果表明,实验得到65个蛋白水平的差异蛋白,鉴定得到24种糖基化水平的显著差异糖蛋白,该实验可为复杂体系样品分析、差异蛋白质的定性定量分析提供可靠准确的方法,同时为糖尿病的研究提供详实的数据参考。

