石榴籽油对D-半乳糖诱导衰老小鼠免疫功能的调节作用
黄 旭 郝 吉 李 薇 蔡梦珊 邓旭坤 舒广文
(中南民族大学药学院 武汉430074)
衰老一般指高等生物各个器官系统的机能在时间推移过程中的逐渐衰退。随着我国经济社会的快速发展,人口老龄化程度不断增加,与衰老相关的一系列问题日益严重。高等动物的免疫系统能够辨别体内的非自体物质(一般是病原体),并将其消灭或排出体外,对于维持机体正常生命活动具有重要意义。免疫抑制是衰老的重要特征之一[1-4]。
石榴(Punica granatum Linn.)是石榴科石榴属落叶灌木或小乔木,在我国各地均有广泛栽培。石榴籽油(Punica granatum seed oil,PGSO)是从石榴的种子中提取的挥发油。研究表明,PGSO 具有广泛的生物学活性[5-7]。然而,目前尚不清楚PGSO 是否可以改善衰老相关的免疫抑制。本文以D-半乳糖(D-Gal)诱导的衰老小鼠为研究模型,探讨PGSO 对免疫抑制的干预作用,旨在为PGSO在免疫调节功能性食品开发领域的应用提供理论依据。
1 材料与方法
1.1 实验动物、试验材料、试剂与试剂盒
无特定病原体 (Specific pathogen free,SPF)级8 周龄雄性昆明小鼠(20±2)g,湖北省疾病预防控制中心。实验动物生产许可号:SCXK (鄂)2015-0018。小鼠饲养于SPF 动物房内,适应性喂养1 周后开始实验。依已有文献报道的方法制备石榴籽油[8-9]。
维生素E(VE),浙江医药股份有限公司;DGal、RNaseA、刀豆蛋白A (ConA)、细菌脂多糖(LPS),美国Sigma Aldrich 公司;台盼蓝、中性红、MTT 和碘化丙啶(PI),西安Wolsen 生物技术研究所;RPMI-1640 细胞培养液,美国Hyclone 公司;胎牛血清,天杭生物科技股份有限公司。其它常规化学试剂(分析纯),国药集团化学试剂有限公司。NO 含量测试试剂盒、caspase-1 活性检测试剂盒,碧云天生物技术研究所;IL-1β 酶联免疫试剂盒,南京建成生物技术研究所;免疫球蛋白和补体含量测试试剂盒,美国Ortho-Clinical Diagnostics 公司。
1.2 主要仪器及设备
高速冷冻离心机(5810R 型),德国Eppendorf公司;HH-S2 型数显恒温水浴锅,金坛市盛威实验仪器厂;流式细胞仪 (Becton Dickinson FACSCalibur),美国Franklin Lakes 公司;CO2细胞培养箱(317 型)、多功能酶标仪(354 型),美国Thermo 公司。
1.3 试验方法
1.3.1 动物的分组与给药 将60 只小鼠分别随机分为6 组,每组10 只,分别是健康对照组、模型组、阳性对照组(VE,200 mg/kg)、PSGO 低剂量组(75 mg/kg)、PSGO 中剂量组(250 mg/kg)和PSGO高剂量组(750 mg/kg)。健康对照组每日皮下注射0.5 mL 生理盐水。其余各组每日皮下注射0.5 mL质量分数为5%的D-Gal 溶液。VE 和PGSO 均通过灌胃途径给药。给药时间持续45 d。末次给药24 h 后,分离培养原代巨噬细胞。然后麻醉小鼠,取血,收集血清。最后处死小鼠,迅速解剖,摘取相关组织器官进行后续实验。
1.3.2 巨噬细胞的分离、培养与吞噬能力测定将4 mL 无血清的RPMI-1640 细胞培养液注射入小鼠腹腔内。轻揉小鼠腹部,使培养液在腹腔内流动均匀。15 min 后,抽取腹水,离心收集腹水中的细胞,再用培养液漂洗细胞多次。最后,将细胞重悬于含10%胎牛血清的RPMI-1640 培养液中。经台盼蓝染色法确定细胞存活率大于95%后,将细胞浓度调整到2×106/mL,备用。
将所得巨噬细胞悬液接种于96 孔培养板中,每孔0.1 mL,于5%CO2、37 ℃的条件下培养4 h。用生理盐水洗去未贴壁的细胞,向每孔中添加0.04%的中性红溶液100 μL,继续培养4 h,弃上清,用生理盐水洗涤3 次,最后加入乙醇-乙酸(1∶1)混合液200 μL,静置12 h。测定每孔溶液在波长570 nm 处的吸光度D(λ)。此吸光度可以代表巨噬细胞的吞噬功能。
1.3.3 巨噬细胞IL-1β 和NO 分泌能力检测以及巨噬细胞内IL-1β 含量和caspase-1 活性检测向巨噬细胞悬液中加入LPS,至LPS 终质量浓度为20 μg/mL,24 h 后,收集其培养液上清,利用相应的试剂盒,检测培养液中NO 和IL-1β 的含量。然后收集细胞,将细胞裂解后利用相应的试剂盒,检测细胞裂解液中的IL-1β 含量及caspase-1 的相对活性。
1.3.4 脾脏/胸腺指数计算、脾脏/胸腺细胞分离与ConA 刺激脾脏与胸腺细胞增殖检测 处死小鼠后迅速解剖,摘取脾脏与胸腺,称重,计算脾脏与胸腺指数。计算公式:脏器指数= 脏器质量(mg)/小鼠体质量 (g)。将脾脏/胸腺放入低温无血清RPMI-1640 培养液内,剪碎、研磨,用无菌纱布过滤,即得脾脏/胸腺细胞悬液。漂洗后立即向细胞悬液中加入0.15 mol/L 的NH4Cl (pH=7.4)溶液以去除红细胞。经台盼蓝染色确定细胞存活率大于95%后,将细胞接种入96 孔板中,接种密度为每孔5×105个细胞,培养24 h(5%CO2,37 ℃)。
向试验孔中加入含有ConA(2 μg/mL)的RPMI-1640 培养液100 μL,阴性对照孔中加等体积RPMI-1640 培养液。继续培养72 h 后,每孔加入MTT(2.0 mg/mL)50 μL,再继续培养4 h。最后移去培养液,每孔加15 μL DMSO,彻底混合,测定每孔溶液在波长570 nm 处的光密度。以试验孔和对照孔光密度的比值代表ConA 刺激下免疫细胞的增殖能力。
1.3.5 流式细胞分析 用贮存于-20 ℃的70%乙醇固定脾脏细胞悬液,至少2 h 后,再用含20 mmol/L EDTA 的生理盐水洗涤3 次。向样品中加入质量浓度为1 mg/mL 的RNaseA,37 ℃孵育1 h。最后向样品中加入20 μg/mL 的PI 染液,混匀后,上流式细胞仪进行细胞周期分布分析。
1.3.6 血清免疫球蛋白及补体含量检测 按照相应试剂盒说明书操作,测量各组小鼠血清免疫球蛋白IgM、IgG、IgA 和补体C3、C4 的含量。
1.4 统计学分析
所有试验数据均以平均值±标准差的形式表示,以spss 软件进行统计分析。采用t 检验法比较模型组和健康组数据差别的统计学意义。如数据分析涉及的组多于2 个 (如模型组和2 个PGSO给药组的比较),则先采用单因素方差分析法,比较多个试验组的数据差别,再采用Scheffe 法进行均数两两比较检验。P<0.05 时,可以认为数据的差别具有统计学意义。
2 结果与分析
2.1 PGSO 对D-Gal 诱导衰老小鼠脾脏指数与ConA 刺激的脾细胞增殖的影响
脾脏是机体重要的免疫器官。如表1所示,与健康组相比,模型组小鼠脾脏指数降低了13.7%,ConA 刺激指数降低了38.3%(P<0.01)。与模型组相比,在PGSO 低、中和高剂量组中,脾脏指数分别上升了6.1%,9.5%和15.4%,ConA 刺激指数则分别上升了17.9%,43.4%和66.9%。而在阳性对照VE 组中,脾脏指数上升了13.4%,ConA 刺激指数上升了56.6%。以上结果表明,PGSO 能够显著提高D-Gal 诱导衰老小鼠的脾脏指数和脾细胞增殖能力,其作用效果与阳性对照药VE 相当。

表1 PGSO 对D-Gal 诱导衰老小鼠脾脏指数与ConA 刺激的脾细胞增殖的影响Table 1 Effects of PGSO on spleen index and ConA-mediated splenocyte proliferation of aging mice induced by D-Gal
2.2 PGSO 对D-Gal 诱导衰老小鼠胸腺指数与ConA 刺激的胸腺细胞增殖的影响
胸腺是机体另一重要的免疫中枢。如表2所示,与健康小鼠相比,衰老模型小鼠的胸腺指数降低了34.7%,ConA 刺激指数降低了44.7%(P<0.01)。与模型组相比,PGSO 剂量依赖性地提高了衰老小鼠的胸腺指数和ConA 刺激胸腺细胞增殖。在PGSO 低、中和高剂量组中,小鼠胸腺指数分别上升了20.7%,42.0%和61.7%,ConA 胸腺刺激指数则分别上升了26.5%,48.3%和82.3%(P<0.01)。PGSO 的干预作用与阳性药物VE 相当。以上试验结果说明,PGSO 可明显提高D-Gal 诱导衰老小鼠的胸腺指数和胸腺细胞增殖能力。

表2 PGSO 对D-Gal 诱导衰老小鼠胸腺指数与ConA 刺激的胸腺细胞增殖的影响Table 2 Effects of PGSO on thymus index and ConA-mediated proliferation of thymus cells of aging mice induced by D-Gal
2.3 PGSO 对D-Gal 诱导衰老小鼠脾脏细胞细胞周期分布的影响
脾脏细胞周期时相分布与脾脏的免疫功能紧密相关。一般而言,处于S 期和G2/M 期的细胞是正在分裂的细胞。这部分细胞在脾脏中所占比例越大,脾脏细胞的增殖能力就越强。处于亚G1 期(Sub G1 期)的细胞一般是细胞内DNA 出现片段化、发生凋亡的细胞。这部分细胞在脾脏中所占比例越大,脾脏的免疫功能就越弱。如表3所示,与健康组比较,模型组小鼠脾脏细胞处于亚G1 期的比例大幅升高(P<0.01),而处于S 期及G2/M 期的比例则分别降低了40.7%和60.0%(P<0.01)。这说明在衰老模型小鼠的脾脏中,正在分裂的细胞所占比例明显降低,而凋亡细胞所占比例则明显增加。与模型组比较,PSGO 各剂量组小鼠脾脏细胞亚G1 期细胞所占比例均显著降低(P<0.01),而处于S 期及G2/M 期的细胞比例均明显升高(P<0.01)。代表性的流式细胞分析图谱参见图1。PSGO 的干预效果与阳性药物VE 相当。这些数据综合说明,PSGO 能够抑制脾脏细胞凋亡并加强脾细胞增殖。

表3 PGSO 对D-Gal 诱导衰老小鼠脾脏细胞细胞周期分布的影响Table 3 Effects of PGSO on cell cycle distribution of splenocytes of D-Gal-induced aging mice

图1 PGSO 对D-Gal 诱导衰老小鼠脾脏细胞细胞周期分布的影响Fig.1 Effects of PGSO on cell cycle distribution of splenocytes of D-Gal-induced aging mice
2.4 PGSO 对衰老模型小鼠巨噬细胞功能的影响
巨噬细胞能够吞噬侵入机体的非自体物质。IL-1β 和NO 是巨噬细胞分泌的免疫调节因子。它们在机体免疫调节过程中扮演了重要角色[10-12]。如表4所示,与健康组相比,模型组小鼠巨噬细胞的吞噬能力明显下降(P<0.01)。IL-1β 和NO 的分泌能力也明显低于健康组(P<0.01)。经PGSO 干预后,衰老模型小鼠巨噬细胞的吞噬能力以及分泌IL-1β 和NO 的能力均明显上升(P<0.01)。PSGO的干预效果与阳性对照药VE 相当。
巨噬细胞内以前体形式表达的IL-1β 蛋白需经过蛋白酶caspase-1 的切割加工后才能成熟[13-14]。进一步研究发现,与健康组相比,模型组小鼠巨噬细胞的IL-1β 蛋白含量与caspase-1 活性均明显下降(P<0.01)。与阳性对照药物VE 类似,PGSO 明显提高了巨噬细胞内IL-1β 蛋白的含量以及caspase-1 活性(P<0.01)。试验结果如表5所示。以上数据综合说明,PGSO 能显著改善衰老模型小鼠的巨噬细胞功能。

表4 PGSO 对衰老小鼠巨噬细胞吞噬能力以及IL-1β 和NO 分泌能力的影响Table 4 Effects of PGSO on the ability of endocytosis and IL-1β/NO secretion of macrophages derived from aging mice

表5 PGSO 对D-Gal 诱导衰老小鼠巨噬细胞内IL-1β 含量和caspase-1 活性的影响Table 5 Effects of PGSO on intracellular IL-1β content and caspase-1 activity in macrophages derived from aging mice
2.5 PGSO 对衰老模型小鼠血清免疫球蛋白和补体含量的影响
免疫球蛋白和补体是高等动物体液免疫的重要组成成分。与健康组相比,衰老小鼠血清内免疫球蛋白IgG、IgM 和IgA 的含量均明显下降(P<0.01)。PGSO 剂量依赖性地上调了衰老小鼠血清中3 种免疫球蛋白的含量(PGSO 各剂量组数据均具统计学意义,P<0.01)。试验结果如表6所示。类似的,在衰老小鼠体内,血清补体C3 和C4 的含量较健康小鼠均明显下降(P<0.01)。经口服PGSO剂量依赖性地提高了衰老小鼠血清中补体C3 和C4 的含量。试验结果如表7所示。
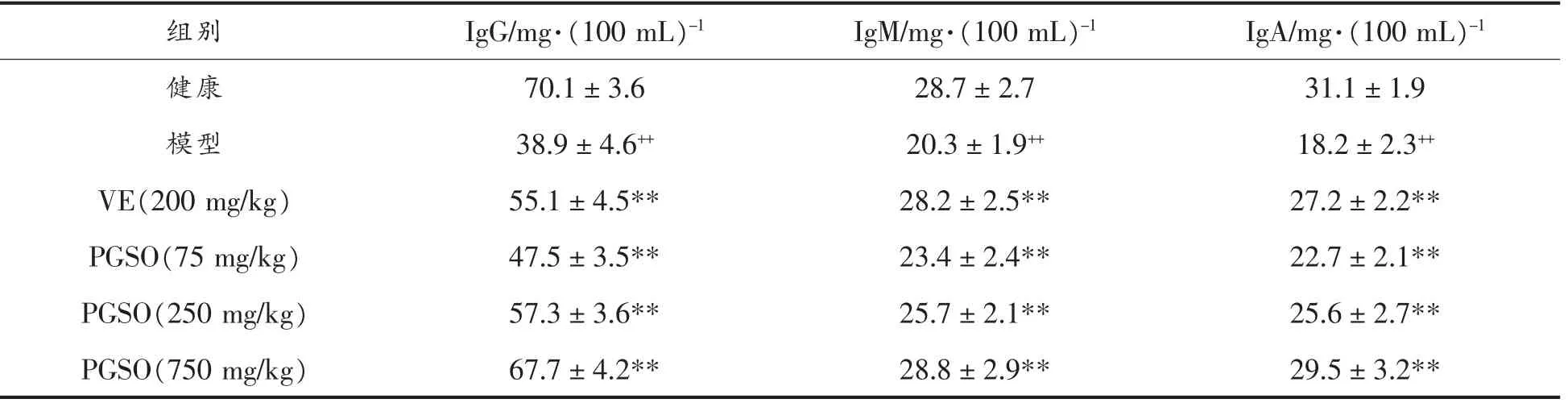
表6 PGSO 对D-Gal 诱导衰老小鼠血清免疫球蛋白含量的影响Table 6 Effects of PGSO on immunoglobin contents in serum from D-Gal-induced aging mice

表7 PGSO 对D-Gal 诱导衰老小鼠血清补体含量的影响Table 7 Effects of PGSO on complement contents in serum from D-Gal-induced aging mice
3 结论与讨论
在衰老模型小鼠体内,脾脏/胸腺指数均有明显降低。与此一致的是,ConA 刺激的脾脏/胸腺细胞增殖亦明显降低,处于分裂期的脾脏细胞比例减少。以上试验事实说明在衰老模型小鼠体内发生了明显的免疫器官萎缩。已有研究表明,在DGal 诱导的衰老小鼠体内,可以观察到明显的脾脏/胸腺指数下降[15-16]。这与本文的研究结果一致。PGSO 剂量依赖性提高了衰老动物的脾脏/胸腺指数以及处于分裂期的脾细胞所占的比例,增强了脾脏、胸腺细胞的增殖能力。以上研究结果说明PGSO 可改善衰老模型小鼠的免疫器官萎缩。
巨噬细胞是高等动物免疫系统的重要组成成分。通过直接的吞噬作用,巨噬细胞可以清除机体内的有害异物——主要包括病原微生物以及已经死亡或发生恶性转化的细胞。不仅如此,巨噬细胞还可以被病原体激活。活化的巨噬细胞将迅速分泌一系列免疫调节因子。这些因子将启动更加深层次的免疫应答[17-18]。LPS 是常见病原微生物革兰氏阴性细菌内毒素的代表性化学成分。在LPS 的刺激下,巨噬细胞将活化并进一步分泌以NO 和IL-1β 为代表的免疫因子。这些免疫因子在调节机体进一步的免疫应答过程中扮演了重要的角色。在一些免疫抑制的动物模型中,巨噬细胞的吞噬功能和免疫因子分泌功能都受到了损害[19-20]。在衰老模型小鼠体内,巨噬细胞吞噬中性红染料和对LPS 刺激的响应能力均明显降低。而PGSO 则有效改善了衰老模型小鼠体内的巨噬细胞功能的下降。
免疫球蛋白在高等动物体液免疫中发挥着至关重要的作用,是免疫系统的有机组成成分之一。在血清中,IgG 的含量较高。IgG 具有包括抗菌,抗病毒,抗肿瘤在内的多种复杂的免疫活性[21]。IgA在血清中的含量仅次于IgG。IgA 在局部黏膜免疫过程中扮演了重要角色。尤其值得注意的是,IgA对经黏膜感染机体的病原微生物具有较强的抵抗作用[22-23]。IgM 的相对分子质量大于IgG 和IgA,在中和毒素及抵御病原体感染过程中起到重要作用[24]。补体是血清内另一种主要的体液免疫因子。激活的补体可协同机体免疫系统的其它组分消灭侵入机体的病原体[25-26]。在衰老模型小鼠的血清中,3 种免疫球蛋白的含量均较健康小鼠明显下降。不仅如此,补体C3 和C4 的水平亦显著降低。PGSO 剂量依赖性地提高了衰老小鼠血清中的免疫球蛋白和补体含量,提示PGSO 能改善衰老模型小鼠的体液免疫。

