骨髓间充质干细胞通过激活Wnt通路防治阿尔茨海默病
陈鹏 姚宏波
(齐齐哈尔医学院 1口腔医学院,黑龙江 齐齐哈尔 161006;2基础医学院组胚教研室)
阿尔茨海默病(AD)是一种进行性发展的中枢神经系统退行性疾病。临床表现为记忆能力的失活、失用,执行功能障碍,认知能力下降,同时多出现精神行为的异常,对中老年人身心健康产生严重危害。近年来,应用干细胞治疗AD逐渐被认可,其中骨髓间充质干细胞(BMSCs)是一种专能干细胞,来源于骨髓,具有自我更新和多向分化的能力,可以在特定的条件下转变成构成人体某种组织的细胞,BMSCs来源广泛,能为AD的治疗提供丰富资源,也为临床的自体细胞移植奠定了实验基础〔1〕。Wnt信号通路在神经系统的发生、发育及神经系统疾病的发生、发展等方面发挥重要作用,如轴突导向、突触形成、成年神经再生和神经细胞的保护和迁移等〔2〕。有研究显示,Wnt/β-catenin 信号的激活可以促进成体动物神经干细胞的增殖及向神经元分化〔3〕。本研究通过在AD大鼠海马区移植BMSCs,探讨在治疗AD的过程中是否存在Wnt通路的激活及对Wnt通路相关蛋白β-catenin及细胞周期蛋白(Cyclin)D1表达的影响。
1 材料与方法
1.1 实验动物及试剂 6~8月龄清洁级雄性Wistar大鼠,体重(200 ± 20)g,来自哈尔滨医科大学实验动物中心。兔抗β-catenin,Cyclin D1抗体一抗;羊抗兔 IgG;二氨基联苯胺(DAB)显色法检测试剂盒;β-淀粉样蛋白(Aβ)23~35;氢溴酸加兰他敏。
1.2 动物分组及处理 将40只大鼠随机分为5组,每组8只,正常组:常规鼠粮饲养,饮用水;模型组:称重后10%水合氯醛腹腔注射麻醉,固定于脑立体定位仪,切开皮肤暴露顶骨,按照大鼠脑立体定位仪图谱在双侧海马区注射10 μl Aβ23~35,缓慢注射5 min注完,注射结束需继续留针5 min,将骨孔用牙托粉封固,皮肤缝合,前3 d,每日肌注10万U青霉素。常规饲养7 d后,用Moriss水迷宫检测造模是否成功,成功后不进行任何治疗;模型对照组:注射生理盐水代替Aβ23~35,方法同模型组;移植组:建立AD大鼠模型2 w后,对AD模型大鼠进行BMSCs移植,注射部位为原Aβ23~35的注射部位,术后处理同模型组;西药组:建立AD大鼠模型后,氢溴酸加兰他敏灌胃治疗,每日每千克体重0.6 mg,治疗30 d〔4〕。
1.3 BMSCs的培养、鉴定及移植 原代培养,将大鼠麻醉后在无菌条件下取双侧股骨,将两侧干骺端剪断,注射器将骨髓冲出,淋巴细胞分离离心,去上清,取云雾状细胞,接种于75 cm2培养瓶中,密度5×105/cm2,培养体系为DMEM培养基、10%胎牛血清、青/链双抗,隔日在倒置显微镜下观察细胞形态。当细胞约80%汇合时,胰蛋白酶-乙二胺四乙酸(EDTA)进行消化,然后终止消化用含胎牛血清的培养液,制成单细胞悬液后进行传代,细胞扩增好后对其进行CD44免疫组化染色鉴定。检测造模成功后,行BMSCs移植,注射部位为原Aβ23~35的注射部位,将BMSCs悬液注入AD模型大鼠双侧海马区,每侧10 μl缓慢注射,1 μl/min,留针约5 min。染色后BMSCs阳性为胞核蓝色,胞质褐色。
1.4 行为学实验 Morris水迷宫的组成:一个不锈钢圆形水池和一个可以移动的平台。水池上方有摄像机和监视器与计算机相连,跟踪记录大鼠游泳轨迹和游泳时间。水池被等分为平台象限、对侧象限、右侧象限和左侧象限4个象限,并用不同形状进行标记。在平台象限正中放置平台,将大鼠头部染成黑色,将大鼠面向池壁,在其他3个象限中任一点放入水中。记录大鼠逃避潜伏期,即每次自入水至爬上平台的时间。方法如下:将大鼠编号,第1天让大鼠适应环境,自由游泳2次,每次120 s;第2天起,每天上、下午各进行水迷宫训练1次,连续3 d,共计6次,训练时间同上,120 s未找到平台则以120 s计算,为了加强记忆,每次训练后,将大鼠引导至平台上15 s。记录大鼠平均逃避潜伏期。
1.5 形态学实验 取脑组织海马进行石蜡切片制作并采用苏木素-伊红(HE)染色观察海马神经元的形态及超微结构的改变。HE染色步骤:①石蜡切片二甲苯脱蜡;②梯度乙醇脱水至蒸馏水水洗;③苏木精染色;④自来水稍冲洗;⑤1%盐酸乙醇分化、水洗;⑥伊红复染;⑦酒精脱水;⑧二甲苯透明、自然干燥;⑨封片。光学显微镜下观察并拍照。
1.6 免疫组化染色 采用PV二步法进行免疫组化检测各组AD大鼠海马Wnt信号通路β-catenin及Cyclin D1蛋白的表达,对照组一抗用0.01 mol/L磷酸盐缓冲液(PBS),光学显微镜下观察。
1.7 统计学方法 应用SPSS17.0软件进行方差分析;图像处理应用ImageJ。
2 结 果
2.1 BMSCs的培养、鉴定及移植 BMSCs呈细长纤维状,贴壁生长后变成长梭形,分布呈漩涡样,折光性好,形态饱满。染色后可见BMSCs表达阳性,阳性细胞比例在99%以上。
2.2 行为学检测 模型组与正常组、模型对照组比较,逃避潜伏期及游泳路程明显增长(P<0.01);移植组和西药组明显低于模型组(P<0.05)。见表1。
2.3 形态学变化 正常组和模型对照组海马区锥体细胞和颗粒细胞胞质丰富,排列规则且整齐紧密,层数较多。模型组锥体细胞和颗粒细胞可见被破坏现象,胞质浓缩染色较深,核固缩,细胞排列稀疏且紊乱,细胞体积缩小,间隙扩大。移植组和西药组颗粒细胞核圆,但细胞数量较正常组减少,细胞排列较规整,界限较清晰。见图1。

表1 各组平均逃避潜伏期及游泳路程比较
与模型组比较:1)P<0.01,2)P<0.05;下表同
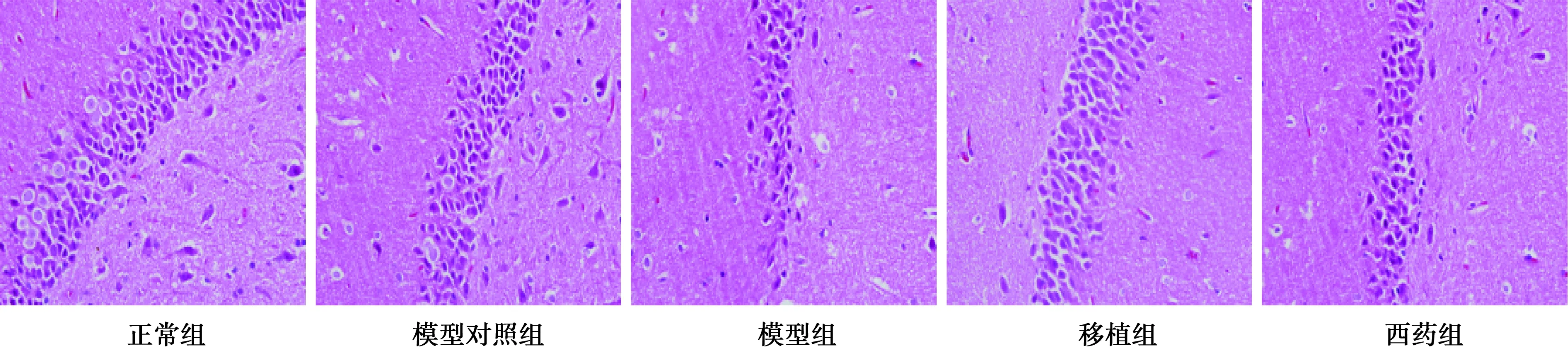
图1 各组海马HE染色(×400)
2.4 免疫组化检测结果 正常组和模型对照组β-catenin蛋白在大鼠海马神经元的胞质内阳性表达;模型组阳性表达细胞数明显减少(P<0.01);移植组和西药组明显多于模型组(P<0.05)。正常组、模型对照组Cyclin D1蛋白在细胞核内表达;模型组阳性表达明显降低(P<0.01);移植组和西药组明显多于模型组(P<0.05),见表2。
表2 各组海马蛋白β-catenin 及Cyclin D1表达阳性细胞数个/mm2,n=8)
3 讨 论
AD病因目前尚不明确。根据2010年失智症报告显示,全球AD患者约有3 560万例,且增长速度约每20年翻1倍,估计到2030年AD患者将达约6 500万例,且发展中国家居多〔5〕。AD主要有三大病理改变:Aβ形成、tau蛋白的过度磷酸化及神经炎症,其产生的神经毒性最终导致大量海马神经元凋亡。
BMSCs具有多向分化的潜能,应用不同的诱导剂可分化为多种细胞,如脂肪细胞、软骨细胞、骨细胞及神经元等〔6〕,故近些年BMSCs被作为移植治疗多种疾病的种子细胞〔7〕。在体内外实验中,BMSCs在适当的条件下可诱导分化为神经元,但调控机制目前尚不清楚。据报道,BMSCs在定向分化过程中,Wnt信号通路具有一定的调控作用〔8〕。Wnt/β-catenin信号通路是最经典的Wnt通路,Wnt 3a蛋白与细胞膜上的相应受体结合,Wnt信号通路被激活,使未被磷酸化的β-catenin从细胞质进入细胞核,并启动相应靶基因的转录,从而产生多种细胞效应〔9〕。其中激活Wnt 信号通路后,可启动靶基因Cyclin D1 的转录〔10〕。Beaulieu等〔11〕发现,在Wnt /β-catenin 通路激活剂或Wnt 配体作用下,可增强 β-catenin蛋白的表达及该通路下游靶基因中存活基因如 Cyclin D1的表达,减弱 Aβ 的神经毒性,对神经元起保护作用。有研究还发现Cyclin D1的调控机制有利于Cyclin D1在 AD 病理发展中作用的研究〔12〕。
目前有报道证实,通过Wnt信号通路的激活可使AD大鼠脑组织内的炎症得到改善〔13〕。BMSCs在向神经元分化时,胞质内游离β-catenin蛋白的表达明显增加;而Wnt信号通路受到抑制时,BMSCs的分化明显减少〔14〕。所以推断Wnt 信号通路对AD的发生有严重影响,但目前许多机制仍不明确,还有待继续研究〔15〕。本研究显示,BMSCs移植可以缩短AD模型大鼠的逃避潜伏期和游泳路程,对学习记忆能力起到改善作用;模型组胞质内游离的 β-catenin 减少,抑制了Wnt信号通路的转导,从而使靶基因 Cyclin D1 的表达有所下调。经过BMSCs移植后,胞质内游离β-catenin表达增多,激活了Wnt信号通路,使Cyclin D1 的表达增强,并且能够促进神经元之间突触的发生。因此,BMSCs移植治疗AD的机制可能是通过激活Wnt/β-catenin通路,调控细胞周期,从而起到保护神经元的作用。
BMSCs具有高分化潜能,可以实现自体移植,具有低免疫原性,避免了移植后的排斥反应。同时,BMSCs易于获取,故不涉及医学伦理问题,作为组织工程的种子细胞,具有十分广阔的应用前景〔16〕。

