黄芪总黄酮对骨关节炎软骨细胞氧化应激和炎症因子分泌的影响
任伟亮,焦永伟,张 健,王 响,齐立卿,杜双庆
河北省中医院骨三科 石家庄 050011
骨关节炎是一种常见的退行性疾病,其发生与关节软骨损伤有关。正常的软骨组织由软骨细胞和软骨基质组成,其中软骨细胞不仅可以清除坏死退变的基质,还可以不断合成新的基质,维持关节软骨的正常功能[1]。黄芪总黄酮是一种从蒙古黄芪中分离出来的抗氧化活性成分,研究[2-4]显示,黄芪总黄酮具有抗肿瘤、抗动脉粥样硬化、抗损伤等生物学作用。研究[5]还显示,黄芪总黄酮具有治疗关节炎的作用,黄芪总黄酮处理可以减少关节炎性细胞浸润,抑制炎症反应。本实验通过分离骨关节炎软骨细胞,探讨黄芪总黄酮对骨关节炎软骨细胞炎症反应和氧化应激的作用,为黄芪总黄酮治疗骨关节炎提供依据。
1 材料与方法
1.1材料本实验所用的骨关节炎软骨组织均来源于2017年3月河北省中医院膝关节置换术患者,标本保存在液氮中。超氧化物歧化酶(SOD)活性检测试剂盒购自碧云天生物研究所;谷胱甘肽过氧化物酶(GSH-Px)活性检测试剂盒购自上海哈灵生物科技有限公司;NF-κB p65亚型(NF-κBp65)抗体购自武汉伊莱瑞特生物科技股份有限公司;基质金属蛋白酶-13(MMP-13)抗体购自上海研晶生物技术有限公司;白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)含量检测试剂盒购自北京热景生物技术股份有限公司;黄芪总黄酮购自西安恒堡生物科技有限公司。
1.2骨关节炎软骨细胞的分离培养参照文献[6]分离培养骨关节炎软骨细胞,在无菌条件下将骨关节炎软骨组织用1.5 g/L的胶原酶消化以后,用含青、链霉素的DMEM培养液(培养液中添加体积分数10%胎牛血清)培养。以22目细胞筛过滤以后,1 000×g离心10 min。用不含血清的DMEM将细胞悬浮,1 000×g离心10 min,弃上清。把分离的细胞种植到细胞培养瓶中,每3 d换液1次,细胞融合度超过90%时,用2.5 g/L的胰蛋白酶消化传代。
1.3MTT法检测细胞增殖能力取第3代骨关节炎软骨细胞接种至96孔细胞培养板中,每个孔中添加3 000个细胞,培养过夜以后,将细胞培养液换成含有0、5、10、20 mg/L的黄芪总黄酮细胞培养液,每个浓度3个复孔,继续培养72 h以后,将培养板从培养箱中取出,每孔添加20 μL MTT溶液,常规方法培养4 h以后,把孔内的液体吸除,添加DMSO溶液150 μL,振荡孵育10 min后,将培养板置于酶标仪中,将波长调整为490 nm,测定每孔的OD值。实验重复3次。
1.4ELISA法检测培养上清中IL-6、IL-1β水平取第3代骨关节炎软骨细胞,经过0、5、10、20 mg/L的黄芪总黄酮细胞培养液培养72 h以后,收集培养上清,ELISA法检测上清中IL-6、IL-1β含量,步骤同试剂盒说明。实验重复3次。
1.5细胞培养上清中SOD、GSH-Px活性检测取第3代骨关节炎软骨细胞,经过0、5、10、20 mg/L的黄芪总黄酮细胞培养液培养72 h以后,收集培养上清,用WST-8法检测SOD活性,用ELISA法检测GSH-Px活性,步骤均参照试剂盒说明。实验重复3次。
1.6Western blot检测NF-κBp65、MMP-13蛋白表达水平0、5、10、20 mg/L的黄芪总黄酮处理72 h以后,收集各组细胞,在细胞中添加含有1 mmol/L PMSF的裂解液,置于冰上裂解。4 ℃高速离心以后,取上清液转移到离心管中,保存于-80 ℃。在蛋白中按照1∶4的体积比添加适量的Loading Buffer混匀后煮沸5 min。用BCA法进行定量。配制100 g/L的分离胶、50 g/L的浓缩胶。按照蛋白样品50 μg进行上样,电泳,转膜,转膜电流为250 mA。将NC膜置于一抗反应液(NF-κBp65以1∶600稀释、MMP-13以1∶800稀释)中反应过夜后,再置于二抗反应液中室温孵育2 h,二抗以1∶2 000稀释,滴加ECL发光液。采用Quantity-One软件分析条带的灰度值,以β-actin作为参照,目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。实验重复3次。
1.7统计学处理数据采用SPSS 21.0进行分析。4组细胞OD值,培养上清中IL-6、IL-1β含量及SOD、GSH-Px活性,MMP-13、NF-κBp65蛋白表达水平的比较均采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.14组细胞增殖能力的比较MTT结果显示,细胞OD值随着黄芪总黄酮浓度的升高而升高。见表1。
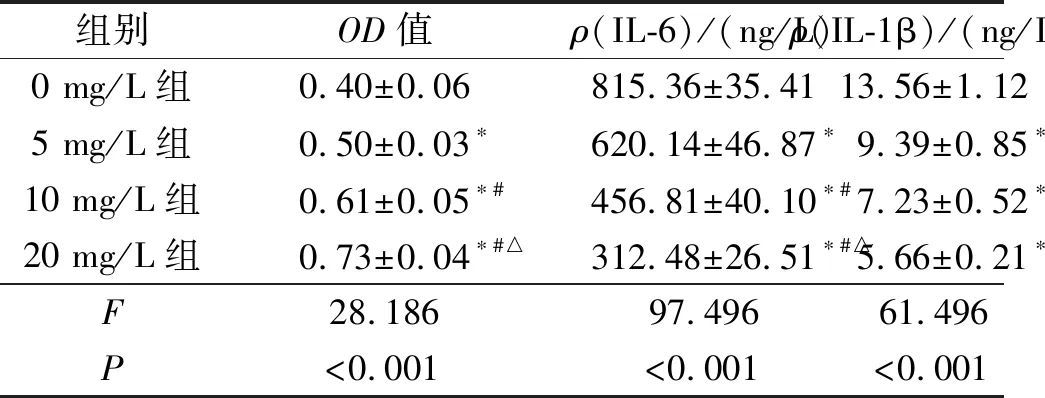
表1 4组细胞OD值及培养上清中IL-6、IL-1β含量的比较(n=3)
*:与0 mg/L组比较,P<0.05;#:与5 mg/L组比较,P<0.05;△:与10 mg/L组比较,P<0.05
2.24组细胞培养上清中IL-6、IL-1β含量的比较ELISA检测结果显示,细胞培养上清中IL-6、IL-1β含量随着黄芪总黄酮浓度的升高而降低。见表1。
2.34组细胞培养上清中SOD、GSH-Px活性的比较结果显示,细胞培养上清中SOD、GSH-Px活性随着黄芪总黄酮浓度的升高而升高。见表2。

表2 4组细胞培养上清中SOD、GSH-Px活性及MMP-13、NF-κBp65蛋白表达水平的比较(n=3)
*:与0 mg/L组比较,P<0.05;#:与5 mg/L组比较,P<0.05;△:与10 mg/L组比较,P<0.05
2.44组细胞MMP-13、NF-κBp65蛋白表达水平的比较Western blot检测结果显示,细胞中MMP-13、NF-κBp65蛋白表达水平随着黄芪总黄酮浓度的升高而降低。见图1和表2。

1:0 mg/L组;2:5 mg/L组;3:10 mg/L组;4:20 mg/L组
3 讨论
黄芪属于豆科黄芪属植物,其含有多种活性成分,黄芪总皂苷、黄芪总黄酮、黄芪总多糖等是其主要的活性成分,其中黄芪总黄酮含有6种单体,具有提高免疫细胞活性、减轻氧化损伤、抑制突变、抗失血性休克等功效[7]。有研究[8]报道,黄芪总黄酮具有保护关节软骨的作用,其可以减轻关节软骨炎症因子释放。本实验结果表明,黄芪总黄酮处理后的关节炎软骨细胞增殖活性升高,细胞培养上清中炎症因子IL-6、IL-10水平降低,说明黄芪总黄酮具有抑制关节炎软骨细胞炎症因子释放的作用。
骨关节炎是一种慢性疾病,关节功能破坏是其主要的病理变化,氧化应激是关节软骨损伤发生的重要原因[9]。氧化应激是指机体受到炎症因子等各种有害刺激以后产生过量的氧自由基或导致机体内抗氧化能力降低,从而引起氧自由基在机体内积累,导致机体氧化还原状态受到破坏,引起氧化损伤[10-12]。SOD、GSH-Px是抗氧化酶,可以将细胞内过量的氧自由基清除,是机体内抗氧化系统的重要组成部分[13]。黄芪总黄酮具有清除氧自由基、抗氧化损伤的作用,目前在肝损伤、紫外线损伤等过程中已被证实[14]。本实验结果显示,黄芪总黄酮处理后的骨关节炎软骨细胞培养上清中SOD、GSH-Px活性升高,提示黄芪总黄酮可以通过提高细胞内抗氧化酶的活性发挥保护关节细胞的作用。
正常情况下,软骨细胞可以分泌大量的蛋白多糖,这些蛋白多糖能够被基质金属蛋白酶降解,从而维持细胞支撑力量的循环和平衡;受损的软骨细胞可以分泌过量的基质金属蛋白酶,导致上述平衡受到破坏,引起软骨细胞支撑力量缺失,诱导骨关节炎的发生[15]。基质金属蛋白酶是细胞外基质降解的重要源头,MMP-13能够将Ⅱ型胶原、Ⅰ型胶原和蛋白聚糖等降解,其中Ⅱ型胶原是软骨胶原的主要组成部分,其与蛋白聚糖共同维持软骨的弹性[16]。本研究结果表明,黄芪总黄酮能够抑制骨关节炎软骨细胞中MMP-13的表达,黄芪总黄酮可以通过抑制细胞外基质降解发挥抗骨关节炎的作用。
NF-κB是一个与炎症、细胞生长、氧化损伤等密切相关的信号通路,其可以诱导下游炎症因子释放,促进炎症反应,引起细胞氧化应激。NF-κBp65是NF-κB二聚体形成的必需组成单位,也是NF-κB信号功能发挥的关键[17]。NF-κB在骨关节炎软骨组织中过度激活,NF-κBp65在骨关节炎软骨组织中的表达水平升高,白藜芦醇等药物可以通过下调NF-κB信号的激活抑制骨关节炎软骨组织的炎症反应[18-19]。黄芪总黄酮具有抗炎和负调控NF-κB信号的作用[20]。本实验结果表明,黄芪总黄酮处理后骨关节炎软骨细胞中的NF-κBp65蛋白表达水平降低,提示黄芪总黄酮可以通过抑制NF-κB信号通路激活发挥抗炎、抗氧化的作用。
综上,黄芪总黄酮能够抑制骨关节炎软骨细胞的炎症反应和氧化应激,其作用机制可能与下调NF-κB信号有关。这为以后研究黄芪总黄酮抗骨关节炎的作用机制提供了依据,为骨关节炎的治疗提供了参考。

