白蛋白的功能化载体研究及临床应用*
吴艺舟 陈雨佳,2 沈义凯,3 冯翮飞 孙 杰
南京医科大学 1 基础医学院细胞生物学系 2 第一临床医学院2016级八年制临床医学 3 2017级八年制临床医学 4 护理学院2016级护理学,江苏省南京市 211166; 5 南京医科大学公共卫生学院,江苏省医药农药兽药安全性评价与研究中心
白蛋白是人血清中含量最多的蛋白质,在成年人血液中达到40~55g/L,其功能主要维持血液的正常渗透压和运输小分子物质。在传统临床应用中,白蛋白主要作为血浆容量扩充剂广泛用于出血、休克、烧伤、恶性肿瘤、红白细胞增多症等治疗。近年来随着冷冻电镜等技术的蓬勃发展,白蛋白的高级空间结构得以深入研究,尤其在结合小分子物质方面。最新报道显示白蛋白具有多种可调节的分子结合位点,能够进行化学或物理修饰,有望开发成为绿色安全的新型纳米药物载体。
1 白蛋白的高级空间结构
人血清白蛋白(Human serum albumin)含有35个半胱氨酸,形成17对二硫键和1个自由的半胱氨酸。白蛋白由三个同源结构域构成,其中结构域Ⅰ和Ⅱ成90°直角,结构域Ⅱ和Ⅲ成45°(图1)。每个结构域又分为A、B两个子域,两个子域均由4~6个α螺旋结构组成[1-2]。不同物质与白蛋白的结合位置不同,可以通过选择性水解白蛋白产生的片段与配体结合的方法,研究白蛋白与配体的结合位点。在目前已发现的这些结合位点中,位于结构域ⅡA(Drug Site 1,结合口袋Ⅰ)和结构域ⅢA(Drug Site 2,结合口袋Ⅱ)的两个口袋状结合位点作用最为广泛(图1)。口袋的结合特异性基本取决于它们的形状以及极性残基在疏水性口袋内壁上的特定分布,同时也与电荷中和、氢键相互作用有关[3]。
结合口袋Ⅰ是水杨酸盐、胆红素、磺胺药物及其他多种药物的结合位点(图1)。由于所结合的配体均为大分子,所以这一口袋结构相对较大,弹性极好,甚至可以同时结合2个不同的配体[4]。结合口袋Ⅰ位于结构域ⅡA核心处,包含了全部6个α螺旋结构和1个结构子域IB的环形螺旋结构[3]。由1个中心区域形成大结合腔,从其中延伸出3个不同的子室,这3个不同的子室可结合不同的药物。右侧的子室可结合苯巴比妥、华法林等,左侧子室可结合苯基丁烷和CMPF(3-羧基-4-甲基-5-丙基-2-呋喃丙酸),而前侧子室可结合氧吩丁酮和华法林。结合位点Ⅰ的入口由结构子域ⅡB和ⅢA所包围,这些子域的氨基酸残基有助于结合吲哚美辛,并容纳碘帕胺、苯丁酮和华法林等[3]。
结合口袋Ⅱ是甲状腺素、色氨酸和双氟尼、安定、布洛芬等一些药物的结合位点,其空间结构小于结合口袋Ⅰ(图1)。结合口袋Ⅱ是由结构子域ⅢA的全部6个α螺旋结构组成,还包括1个预先形成的极性疏水腔。结合口袋Ⅱ主要的药物结合区域对应结合口袋Ⅰ的中央部分。与结合位点Ⅰ相比,结合位点Ⅱ的入口处无阻碍,更容易暴露在溶剂中,有利于药物结合[3]。除了上述两个主要的结合口袋外,白蛋白的结构子域ⅠB和ⅢB等结构上也存在如保泰松等药物结合位点。
2 参与生物分子代谢
白蛋白是一种非特异性的运输蛋白,在体内能与许多难溶性的小分子有机物和无机离子可逆地结合形成易溶性的复合物,从而提高药物的溶解率、降低生物毒性,因此白蛋白是一种天然的运输载体。白蛋白参与胆固醇的代谢过程,胆固醇可分别与白蛋白的结合口袋Ⅰ和结合口袋Ⅱ结合[5]。分子一侧带有负电荷的酸性基团的芳香性羧酸,如L-色氨酸、甲状腺素等可与结构域Ⅱ结合[6]。甲状腺素可与白蛋白的结构域ⅡA、ⅢA和ⅢB中的4个位点结合,而脂肪酸可与甲状腺素竞争结合这些位点。此外脂肪酸在与白蛋白结合后还能进一步诱导后者的结构改变,产生第5个结合位点与甲状腺素结合[7]。
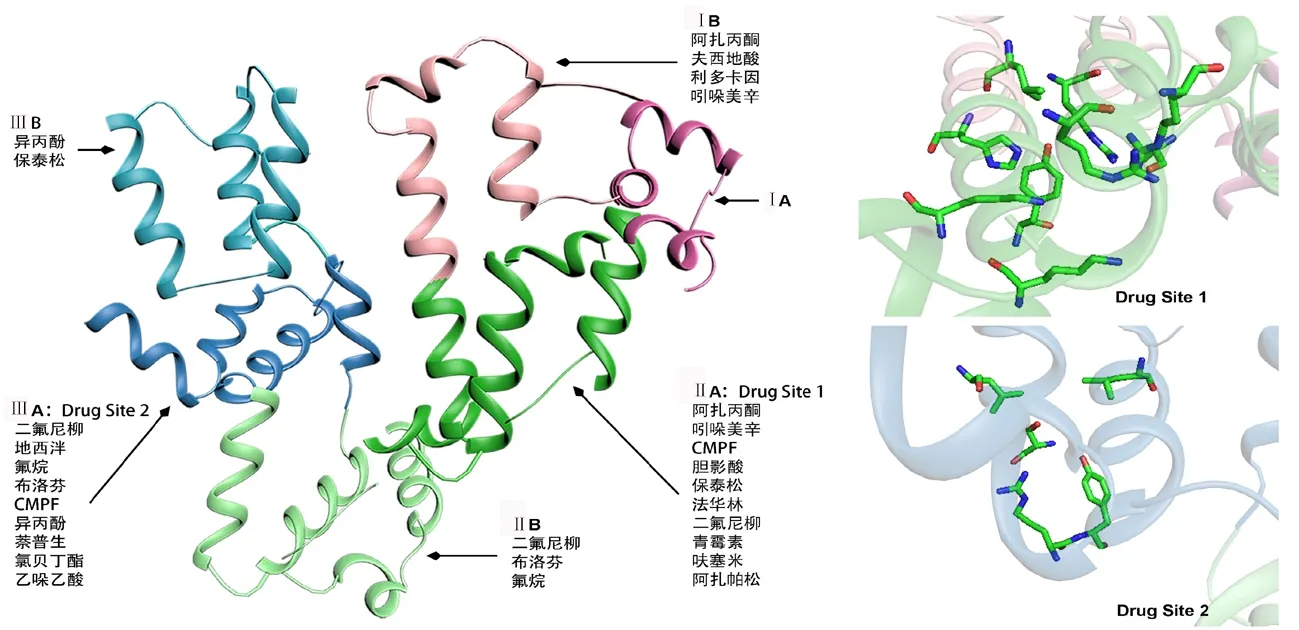
图1白蛋白空间结构和药物结合位点
3 参与药物分子代谢
能够与白蛋白结合的药物分子非常多,其相互作用主要由四种类型组成:疏水相互作用、氢键、范德华力和静电相互作用[8]。结合口袋Ⅰ识别二羧酸及分子中心带有负电荷的体积较大的杂环分子如青霉素等,也识别其他药物如法华林、保泰松、呋塞米、鞣花酸等(图1)。结合口袋Ⅱ识别萘普生、布洛芬、地西泮、氯贝丁酯等(图1)。此外,利多卡因和夫西地酸等主要结合在结构子域IB[3]。
4 参与纳米药物的靶向传递
白蛋白纳米药物是以白蛋白作为载体包封或吸附药物,经固化分离而形成的实心球体。目前以白蛋白为载体的药物蛋白偶联物大多是在交联剂的作用下通过药物或其衍生物与白蛋白的游离氨基相连接,例如临床最早使用的氨甲蝶呤白蛋白偶联物[9]。白蛋白能够包裹的药物有抗肿瘤药、抗结核药、降血糖药、抗生素、激素、支气管扩张剂等,可通过静脉注射、肌肉注射、关节腔内注射、口服、呼吸系统等多途径给药[10]。一方面,白蛋白纳米药物进入体循环后主要被肝、肾、骨髓等处网状内皮系统的巨噬细胞吞噬,具有器官靶向性。另一方面,白蛋白纳米药物可以通过gp60受体/calveolin-1/SPARC通路实现药物分子穿过肿瘤血管内皮细胞并靶向运输至肿瘤细胞。在这一过程中,白蛋白纳米药物首先结合到血管内皮细胞表面的受体,如gp60受体。通过激活calveolin-1诱导细胞膜内陷形成直径为50~100nm有被小泡。有被小泡以跨细胞方式转运进入其中的白蛋白纳米药物,将其由基底外侧质膜释放到细胞间隙。进一步通过肿瘤组织细胞外基质高表达的SPARC等蛋白介导运输至肿瘤细胞[11-12]。
5 参与金属离子代谢
白蛋白与金属离子的结合可以抑制自由基的产生。由于存在1个自由的半胱氨酸残基Cys-34,白蛋白成为血管内还原性巯基的主要来源。这些巯基是活性氧和活性氮的清除剂,尤其是超氧化物、过氧化亚硝酸盐等。铜离子是促进这些自由基产生的重要离子,白蛋白通过结合自由的铜离子来抑制自由基生成[13]。白蛋白主要含有四个金属离子的结合位点:(1) 多肽链N端(N-terminal site,NTS)。该位点是白蛋白结合金属离子的标志性位点,由蛋白序列N端的三个残基Asp-Ala-His组成。这个结合位点的主要特征是肽键的氮原子与金属离子配位,由同时存在的末端自由胺和His-3激活。这四个配位原子的配位结构更倾向于形成金属离子的平面络合物,例如Cu2+和Ni2+。(2)还原型Cys-34。Cys-34使得白蛋白易于形成含半胱氨酸或谷胱甘肽的异型二硫化物[14]。白蛋白部分变性后以Cys-34硫醇盐的形式结合金属离子。Cys-34位于子域IA的第二和第三α螺旋结构之间。X射线衍射分析显示这一区域还存在其他潜在的金属结合的残基,例如Asp-38与His-39,但它们不与Cys-34同时结合金属离子[14]。(3)金属结合位点A(MBS /Site A His-67)。核磁共振和圆二色性研究表明白蛋白结构域I的His-67咪唑氮是Cd2+和Zn2+的主要结合位点。Asn-99的羰基、Asp-249的羧酸以及His-247的咪唑和酰胺氧也参与结合Zn2+。此外,MBS 也是Cu2+和Ni2+的第二结合位点[15-16]。(4)金属结合位点B。这是Cd2+的第二结合位点,与Site A的亲和力大致相同。Site B同时也是Mn2+的主要结合位点,但对Zn2+的亲和力较低[15]。
6 参与金属纳米颗粒的体内自发合成
本课题组首次报道在哺乳动物的心血管系统中可以自发合成金属纳米颗粒并揭示其合成机制[17]。通过摄入含有低浓度锌离子的饮用水,可以在动物外周血中检测到大量的生物氧化锌纳米颗粒,表征结果显示其结构核心为粒径约6nm的氧化锌纳米晶体,外侧覆盖血清白蛋白。通过在白蛋白溶液中添加锌离子,可以在体外环境中模拟生物氧化锌纳米颗粒的合成过程。可见金属离子进入心血管系统后,能够被血清白蛋白大量捕获并结合形成生物纳米颗粒。笔者由此提出当大量金属离子进入体内后,能够自发结合至白蛋白形成金属纳米颗粒即“金属库”,从而有效降低游离态金属离子的强氧化及毒副作用。与锌离子或者化学合成的氧化锌纳米晶体相比较,病理和免疫学等实验均证实生物氧化锌纳米颗粒具有低毒性和良好的生物相容性。可以进一步对其修饰抗癌药物,实现了靶向诱导体内肿瘤细胞凋亡的作用[17]。以上结果表明白蛋白不但是体内合成生物纳米颗粒的关键分子,还是发挥药物修饰连接的新型载体。
7 白蛋白纳米药物的临床开发前景
近年来基于白蛋白的功能化生物材料在制备方法、表面改性、临床应用等方面不断取得新进展。白蛋白可制成多种剂型如微球、纳米粒等,所包埋的药物多为抗肿瘤药,主要用于静脉注射途径给药。其他用法也逐渐增多,如包埋焦磷酸铁用于口服制剂,通过高亲和力白蛋白可以降低游离态药物的浓度。目前的研究热点是使用金属离子、酶或者叶酸等修饰白蛋白,提高白蛋白与药物的结合率和稳定性,从而提升药物的利用率。例如二价钙离子或二价镁离子与白蛋白的结合有利于暴露其亚油酸结合位点,可促进亚油酸与白蛋白的结合[18]。通过酶或叶酸修饰,使白蛋白某些基团活化,也能促进白蛋白与药物结合。例如叶酸与白蛋白在缩合剂作用下形成偶联复合体,由于肿瘤细胞表面叶酸含量显著高于正常细胞,叶酸和白蛋白偶联可使得白蛋白载药系统的肿瘤靶向效率显著提升。
在临床应用方面,美国食品和药物管理局(FDA)批准使用人类的血清白蛋白,提取自人血浆或者通过基因重组表达产生。目前生产多用人血浆为原料,采用低温乙醇法和层析法[19]。然而原料供应是最大问题,例如捐献者可能存在的病毒感染等因素也限制了白蛋白生产。因此白蛋白来源的明确、稳定和安全仍然是一个巨大挑战,尤其在病毒感染的情况下必须要谨慎筛选适合的捐献者。 优化生产方式、寻找替代蛋白是今后发展面临的主要问题,如应用基因工程手段生产重组白蛋白等将有助于解决这一问题。

