姜黄素对肺纤维化模型大鼠TGF-β1表达的影响
薛爱芹 张争辉 李银生
1 菏泽医学专科学校,山东省菏泽市 274000; 2 河南省新乡医学院
肺纤维化(Pulmonary fibrosis,PF)主要表现为肺实质渐进性不可逆性纤维化进展,同时伴有肺功能降低,表现为干咳、进行性呼吸困难,发病率和死亡率逐年增加,死亡率高于大多数肿瘤,被称为一种“类肿瘤疾病”,博莱霉素现已用作研究PF的经典模型[1]。关于PF机制和治疗的进展是近几年的研究热点,如:通过小分子靶向抑制Wnt/β-连环蛋白信号传导,阻碍了转化生长因子-β1(TGF-β1)介导的纤维化作用。Wnt/β-连环蛋白信号传导可能是调节成纤维细胞分化及其进一步参与PF发展的重要机制[2];尼达尼布是特发性肺纤维化(Idiopathic pulmonury fibrosis,IPF)已经获批的治疗方法[3],姜黄素是一种植物多酚,具有抗氧化、抗炎、降脂、抗肿瘤的作用。本文主要探讨博莱霉素诱导的PF模型大鼠在应用姜黄素干预后,检测TGF-β1在各组间的变化,从而探讨姜黄素在PF中的作用机制,为我们进一步探讨PF的发病机制及其防治提供一种新线索。
1 材料与方法
1.1 动物的选择 健康雄性昆明大鼠96只,体重(20±2)g,由郑州大学医学院实验动物中心提供。实验期间为各组大鼠提供标准饲料、自由饮水,饲养于安静、温暖且避强光的环境中。
1.2 试剂与仪器 姜黄素(四川金郁金科技有限公司生产);醋酸泼尼松片(天津太平洋制药有限公司生产);注射用盐酸博莱霉素(日本化药株式会社生产);SABC二抗试剂盒、DAB显色试剂盒、兔抗鼠CTGF多克隆抗体、兔抗鼠TGF-β1多克隆抗体等均购自武汉博士德公司。
1.3 建立肺间质纤维化模型及建模后给药 建模:健康SD雄性大鼠随机分为4组,空白对照组(A)、模型组(B)、阳性药物对照组(C,醋酸泼尼松片)和姜黄素干预组(D),每组24只。B、C、D均一次性气管内给予博莱霉素(5mg/kg)制作肺纤维化动物模型,空白对照组以同样方法一次性气管内注入等体积的生理盐水。28d后大鼠肺组织基质沉积,呈纤维化表现。给药:造模成功后,A、B组给予等量生理盐水[0.014L/(kg·d)],C组给予醋酸泼尼松混悬液[0.56mg/(kg·d)],D组给予姜黄素羧甲基纤维素钠混悬液[200mg/(kg·d)]。
1.4 HE、免疫组化染色
1.4.1 取材:腹腔注射10%水合氯醛溶液麻醉(2.5ml/kg)后将大鼠固定,快速取肺脏,冷生理盐水清洗后,用15%的甲醛预固定肺左叶组织,抽真空后再用10%甲醛固定。经梯度酒精脱水、二甲苯透明、浸蜡包埋成蜡块。并将分离出的肺右叶组织冻存到-80℃冰箱。
1.4.2 分别留取常规病理、免疫组化切片各1套。HE染色:经过切片、展片、烤片、脱蜡、至水、染色。免疫组化:石蜡切片置烤箱60℃约1h,常规脱蜡至水,PBS洗涤5min, 过氧化氢3%孵育25min,PBS洗涤,5min×3次, 微波修复抗原,5%BSA封闭液滴加,室温孵育30min。加稀释的一抗TGF-β1兔抗鼠多克隆抗体1∶300, 4℃冰箱过夜, PBS漂洗5min×3次。滴加羊抗兔生物素化标记的二抗,37℃孵育30min。PBS漂洗5min×3次, SABC复合液滴加,PBS再漂洗,DAB显色,苏木素复染,显微镜下观察,清水冲洗玻片, 37℃烘箱中烘干,封片,避光,1周内采图。免疫组化染色结果采用半定量分析。
1.5 Western-blotting测定方法 取0.1g肺组织,放入研钵,倒入适量液氮后用钳子夹碎,倒入匀浆器,用0.4ml裂解液溶解粉末30min后,将裂解液移至1.5ml EP管中,放入离心机,12 000rpm,离心5min。取上清液,分装于0.5ml EP管中后加入5x蛋白上样液和DTT,混匀后,放入沸水中煮8min,取出冷却后放入-20℃保存。灌胶、电泳、转膜、封闭及杂交、发光鉴定、结果判断。以β-actin为内参照,将胶片进行扫描或拍照。
1.6 统计学方法 采用SPSS18.0统计软件进行统计学分析,计量资料的数据用均数±标准差(Mean ± SD)表示,P<0.05时差异有统计学意义。
2 结果
2.1 HE染色结果 见图1。空白对照组大鼠肺组织结构未见异常(图A1)。模型组大鼠逐渐观察到弥漫性肺纤维化和大量胶原沉积(图B1);阳性药物对照组的肺组织纤维化情况有所好转,可见散在炎性细胞,肺泡间隔窄,纤维病灶可见于周围支气管(图C1)。姜黄素干预组肺组织纤维化情况好转明显,纤维增生灶肺泡间隔较少。细支气管周围的纤维化程度明显低于模型组(图D1)。

图1 HE染色×200
2.2 四组大鼠肺组织中TGF-β1表达免疫组化表达结果 见图2。模型组在灌注BLM后28d TGF-β1表达水平达到高峰。模型组肺组织TGF-β1的表达较对照组差异有统计学意义(P<0.05)。与模型组比较,阳性药物对照组和姜黄素干预组TGF-β1表达都明显降低,但二者间差异无统计学意义(P>0.05)。
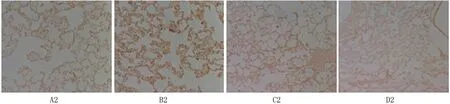
图2 TGF-β1表达变化
2.3 各组大鼠肺组织中TGF-β1表达Western blotting检测结果 见图3。与空白对照组相比,模型组大鼠肺组织中TGF-β1的表达均明显升高;与模型组相比,阳性药物对照组及姜黄素干预组大鼠肺组织中TGF-β1的表达均明显降低,差异有统计学意义(P<0.05)。
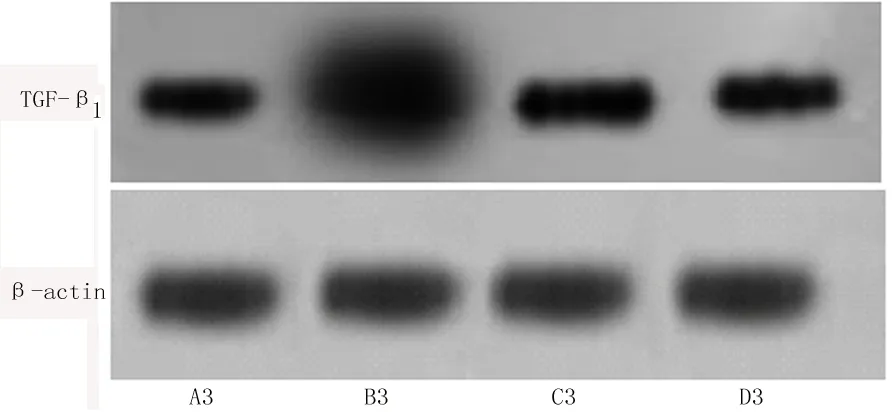
图3 TGF-β1表达
3 讨论
PF是一种纤维增生性疾病,最终可导致致命的肺衰竭。其特征在于成纤维细胞的异常增殖,成纤维细胞向肌成纤维细胞的分化失调以及无组织的胶原和细胞外基质的产生、沉积和降解。其中以IPF发病率最高,预后较差,目前PF发病机制尚不明确并缺乏有效的治疗策略。相关研究显示转化生长因子-β1(TGF-β1)与PF有密切关系:PF患者患肺癌的风险增加,TGF-β1信号传导在组织纤维化和肿瘤发生中起重要作用,特别在IPF肺组织中,其介导的病理学变化可以促进致癌过程并提供有利于癌症进展的微环境[4]。 另外一项研究观察到博莱霉素(BLM)造模后第28天引起大鼠肺部出现炎症浸润和胶原沉积增加。施用PM014(一种草药提取物)后的大鼠出现炎症反应的抑制和纤维化变化。其可能是因为PM014抑制TGF-β1诱导的上皮—间质转化和成纤维细胞活化作用,或靶向调节了TGF-β1信号的传导[5]。那么姜黄素在在肺纤维化方向的研究进展又是什么呢?姜黄素通过抑制促炎细胞因子和抑制NF-κB介导的炎症而显示出抗炎作用,一项研究利用可吸入姜黄素大多孔微粒来治疗IPF[6]。肺纤维化与不可逆或部分可逆的气流阻塞相关,并且最终对诸如皮质类固醇的哮喘治疗无反应,鼻内姜黄素可调节慢性哮喘的气道炎症和重塑[7]。姜黄素可以在纤维化阶段抑制BLM诱导的大鼠肺纤维化,其机制可能是抑制I型胶原蛋白的合成和沉积,抑制TGF-β1mRNA的过度表达。姜黄素对肺纤维化的治疗效果优于泼尼松[8]。在TGF-β超家族的亚家族中,TGF-β1是目前研究最多的与疾病相关分子,TGF-β1自1972年发现以来, 国内外实验研究发现其在脏器纤维化、肿瘤、创伤修复、炎症性疾病及自身免疫性疾病等发生发展中具有重要意义[9],在肺纤维化过程中扮演着重要角色,与肺纤维化关系密切。本实验结果证实:肺纤维化模型组大鼠肺组织蛋白中TGF-β1含量明显高于空白对照组,这与文献报道结果一致。姜黄素干预组大鼠给予姜黄素后肺组织蛋白中TGF-β1的含量有一定程度的降低,与模型组比较,有显著差异,这说明姜黄素能够从蛋白水平调节肺组织TGF-β1的活性。阳性药物对照组与姜黄素干预组肺组织中TGF-β1表达相似,差异无统计学意义。本研究初步探讨了姜黄素抗肺纤维化的作用以及作用机制,也为临床新药的开发提供一种新的思路。另外该药具有毒性低、价格低、药源充足等优点,具有良好的开发应用前景,但是肺纤维化的形成是一个慢性复杂的过程,需要进一步的实验研究与临床研究。

