促红细胞生成素通过AMPK-KLF2信号通路调节脑缺血后血管新生的分子机制*
刘敏, 王英, 王敬东, 张凤香, 李红燕
(青岛大学医学院附属第二医院 重症医学科, 山东 青岛 266042)
促红细胞生成素(erythropoietin,EPO)是一种糖蛋白激素,是哺乳动物调节红细胞生成必不可少的体液性生长因子[1]。在临床上,EPO多用于治疗肾功能不全合并的贫血、恶性肿瘤伴发的贫血及风湿病贫血等[2-3]。有研究表明他汀类药物能通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)上调转录因子KLF2的表达、增加NO的合成、并作用于血管内皮细胞,从而促进血管新生[4-7]。血管新生是影响动脉粥样硬化及多种缺氧、缺血性心血管疾病的病程发展和转归的重要因素[8]。Dorsomorphin (Compound C) 2HCl是一种有效的、可逆的、选择性AMPK抑制剂。本研究旨在通过构建大脑中动脉栓塞动物模型,给予Compound C干预,观察动物新生血管数目及AMPK-KLF2信号通路mRNA和蛋白的表达情况,探究EPO通过AMPK-KLF2信号通路调节脑缺血后血管新生的分子机制。
1 材料与方法
1.1 实验动物
清洁级24周雄性SD大鼠92只,体质量250~280 g,由青岛大学医学院动物实验中心提供(合同号2018-0216)。
1.2 动物分组与造模
1.2.1大脑中动脉栓塞(MCAo)模型的建立 参考毕方方等[8]方法进模:取250~280 g大鼠76只,4%水合氯醛麻醉固定,于颈正中纵切口,暴露右侧颈内动脉、颈总动脉和颈外动脉,准备两个动脉夹、一个动脉夹夹住颈总动脉的向心端,一个动脉夹夹住颈内动脉的远心端;用线结扎颈外动脉远心端,在颈外动脉的向心端的管壁上剪“V”形切口,通过自制4-0线栓经过切口绕过颈动脉窦向颈内动脉放置,结扎劲外动脉“V”切口下方;打开颈内动脉动脉夹,再打开颈总动脉动脉夹。另16只大鼠(假手术组)只做手术、分离血管,但不夹闭或结扎任何血管、亦不放置线栓及不在外动脉上做切口。
1.2.2分组 24周清洁级雄性SD大鼠92只,16只大鼠用于假手术组,76只大鼠造模成功的64只,随机均分成脑缺血组、Compound C组、EPO组及EPO+Compound C组,每组16只。脑缺血组大鼠造模后每天腹腔注射生理盐水,Compound C组在大鼠造模24 h后每天腹腔注射Compound C溶液1 mL,EPO组在大鼠造模24 h后每天注射EPO 1 mL(4 000 UI/kg)。EPO+Compound C组大鼠造模24 h后每天注射 Compound C 和EPO溶液各1 mL,药物总剂量同Compound C组和EPO组,均注射7 d;假手术组仅4%水合氯醛麻醉后固定,于颈正中纵切口,暴露右侧颈内动脉、颈总动脉和颈外动脉,不夹闭颈内动脉和用线结扎颈外动脉远心端及在颈外动脉的向心端的管壁上剪“V”形切口。
1.3 新生血管数目
显微镜下观察,完成造模和干预7 d时取大鼠大脑缺血皮质制片,镜下观察顶叶缺血周围区新生血管并计数全部新生血管数目。
1.4 RT-PCR检测
完成造模和药物干预7 d时,取200 mg大鼠大脑缺血皮质提取总RNA,将组织放入1.5 mL EP管中,加入1 mL Trizol剪碎组织,震荡30 s,加0.2 mL氯仿,剧烈摇动30 s,室温3 min;12 000 r/min,4 ℃离心,15 min;计算浓度与纯度,-70 ℃保存。采用RT-PCR检测Krueppel样因子2(krueppel-like factor 2,KLF2)、内皮一氧化氮合酶(eNOS)、血栓调节蛋白(thrombomodulin,TM)及血管内皮生长因子(vascular endothelial growth factor,VEGF)mRNA水平;PCR反应体系为10×扩增缓冲液(PCR Buffer×10 μL)、脱氧核苷三磷酸底物(dNTPmix×200 umol/L)、耐热DNA聚合酶(Taq酶×2.5 μL)、寡聚核苷酸引物(Primer1×40 pmoL,Primer2×40 pmoL)、靶序列模板DNA(1 μg)。反应条件为95 ℃ 30 s,95 ℃ 5 s、60 ℃ 1 min(40个循环)95 ℃ 30 s,61 ℃ 15 s。取PCR产物进行琼脂糖凝胶电泳检测结果,以β-actin作为参照,计算KLF2、eNOS、TM及VEGFmRNA水平。

表1 引物的核苷酸序列Tab.1 Sequence of the primers
1.5 免疫印迹检测脑缺血区域的AMPK及KLF2蛋白表达
取0.1 g脑大鼠大脑缺血皮质,加500 μL蛋白裂解液,在冰浴下震荡0.5 h,将液体移至1.5 mL离心管中,在4 ℃冷冻离心机中12 000 r/min离心20 min,取上清,利用BCA蛋白法对蛋白浓度进行测定。加入适量上样缓冲液,100 ℃水浴加热5 min,使蛋白变性,8 000 r/min离心5 min后上样。通过SDS-PAGE凝胶电泳进行分析,上样量为20~40 μL/孔,转膜与杂交。
1.6 统计方法

2 结果
2.1 模型成功率评价
76只建模,造模失败12只,1只不明原因死亡、5只未观察到神经功能缺损、1只死于麻醉过量、3只出现蛛网膜下腔出血、1只在观察中死亡,(解剖可见左侧脑组织严重肿胀)以Fabian的神经功能5级标准评分法为标准(≥1分),造模成功64只,模型成功率达到85.5%。造模成功大鼠手术后2 h左右清醒、精神萎靡、反应迟钝、活动及进食减少甚至拒食;大鼠右前肢无力,不能抓杆且爬杆困难;大鼠行走时,身体向右侧旋转或偏斜,身体向右侧旋转或偏斜,甚至向右侧跌倒不能行走,多数动物出现Homers征。65只大鼠随机分为4组,弃掉1只。假手术组大鼠未出现明显神经功能缺损症状与体征,手术后动物进食及活动恢复较好。
2.2 显微镜下观察新生血管数目
EPO组大脑皮质新生血管数量较脑缺血组增多,差异有统计学意义(27.46±2.58 vs 16.21±1.22,P<0.05), Compound C组和EPO+Compound C组大鼠大脑皮质新生血管数目少于脑缺血组(12.15±1.27 vs 14.32±2.11,P<0.05),EPO+Compound C组大鼠大脑皮质新生血管数目多于Compound C组,少于脑缺血组,差异有统计学意义(P<0.05), 镜下新生血管形态见图1。
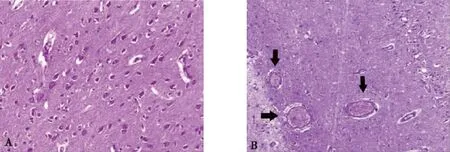
注:A为假手术组,示正常脑组织形态;B为脑缺血损伤后出现新生血管,箭头所指示新生血管处图1 顶叶缺血周围区新生血管形态Fig.1 Morphology of neovascularization around parietal lobe ischemia
2.3 KLF2、eNOS、TM及VEGF mRNA表达
RT-PCR实验对各组大鼠大脑缺血皮质KLF2、eNOS、TM和VEGF的mRNA的表达量进行测定发现, EPO组各mRNA的表达量较脑缺血组升高,差异有统计学意义(P<0.05),Compound C组KLF2、eNOS、TM和VEGFmRNA的表达量低于脑缺血组(P<0.05),EPO+Compound C组KLF2、eNOS、TM和VEGFmRNA的表达量高于Compound C组(P<0.05),低于脑缺血组,差异无统计学意义(P>0.05)。见表2。
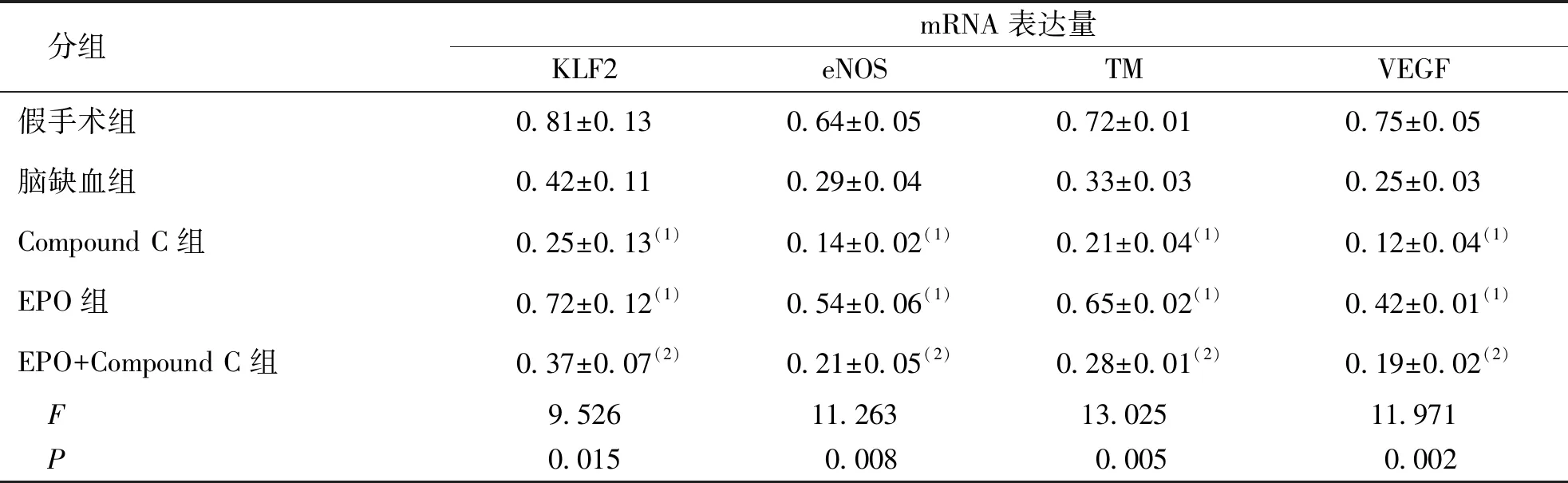
表2 mRNA表达量的测定结果(n=16)Tab.2 Detection results of mRNA expression levels
(1)与脑缺血组比较,P<0.05;(2)与Compound C组比较,P<0.05
2.4 AMPK及KLF2蛋白表达
通过检测KLF2及AMPK蛋白表达水平发现,正常组与假手术组大鼠有少量AMPK及KLF2蛋白表达,差异无统计学意义(P>0.05)。Compound C组AMPK及KLF2蛋白表达水平低于脑缺血组,差异有统计学意义(P<0.05),EPO组AMPK蛋白的表达水平与脑缺血组比较有所增加,EPO+Compound C组AMPK及KLF2蛋白的表达水平高于Compound C组,低于脑缺血组,差异有统计学意义(P<0.05)。见表3、图2。

表3 KLF2及AMPK蛋白的表达水平(n=16)Tab.3 Expression levels of KLF2 and AMPK protein
(1)与脑缺血组比较,P<0.05;(2)与Compound C组比较,P<0.05

图2 大脑皮质AMPK和KLF2蛋白 在不同组别的表达Fig.2 Expression levels of KLF2 and AMPK protein in different groups
3 讨论
脑缺血后,血管新生是脑微循环修复重建的重要病理过程[9],而神经血管单元促成细胞分泌、释放促血管新生因子,例如EPO、VEGF等,从而促进缺血区血管生成[10]。有研究指出,EPO的来源有血源性与脑源性两种,是一种直接促血管新生物质,可促进套式血管生长和芽生,促进VEGF的表达,,同时促进脑血管新生和骨髓造血[11]。另EPO为中枢神经系统内源性的细胞因子,可通过神经元与胶质细胞的旁分泌作用,作用至神经元EPO-R,并发挥神经保护、神经营养及调节胚胎发育的作用[12]。据报道,EPO可引起AMPK和eNOS的磷酸化作用[13],在此过程中,同时促进了KLF2蛋白质的表达水平[14]。复合物C或Ad-AMPK-DN抑制AMPK后限制了KLF2的表达上调,这是一种重组腺病毒,它编码了AMPK的显性负突变体[15-16]。本研究以Compound C为抑制剂成功建立了AMPK缺陷脑缺血大鼠模型。有研究表明,KLF2的敲除降低了eNOS和VEGF,并限制了红细胞生成素的迁移和内皮细胞集落形成新生血管的能力[17]。故AMPK通路中KLF2表达的上调在EPO诱导血管生成中起着至关重要的作用[18-19]。本研究表明,EPO治疗+Compound C干预组各mRNA的表达量高于Compound C干预组,由此结果可以推测出,加入AMPK抑制剂后,KLF2的表达量下降,并且eNOS、TM、VEGF等mRNA的表达量均呈现下降的趋势。据报道,EPO可以激活AMPK蛋白激酶,提高ECs分化,最终促进血管新生。另有研究者认为,EPO的血管生成效应是通过VEGF/KDR完成的[20,21]。相反,也有研究指出,由EPO控制的ECFCs的血管生成能力依赖于AKT而不是VEGF[22]。但在ECFCs中EPO的血管生成效应以及相关的分子机制,特别是转录水平的机制,仍然不清楚。而本实验研究发现,EPO治疗组新生血管数量较脑缺血组增多,EPO治疗+Compound C干预组新生血管数目多于Compound C干预组。同时, AMPK及 KLF2蛋白表达量测定结果表明,EPO治疗+Compound C干预组AMPK及 KLF2蛋白的表达量高于Compound C干预组,故推测EPO可通过促进AMPK及 KLF2蛋白的表达量,激活AMPK,上调KLF2的表达,促进内皮一氧化氮合酶(eNOS)表达,进而增加NO产生,促使内皮克隆形成细胞向内皮细胞分化,进而提高血管新生。
综上所述,EPO可通过上调KLF2、eNOS、TM、VEGFmRNA的表达量,促进AMPK蛋白的表达进而调节脑缺血后血管新生。

