广东石豆兰内生细菌分离鉴定及抑菌活性
高景凯, 赵前程, 孙佳琦, 苗永美
(安徽科技学院 生命与健康科学学院,安徽 凤阳 233100)
植物内生菌(Endophytes)是指那些生活史的一定或全部阶段生活于健康植物的组织和器官内部的真菌、细菌或放线菌,可通过组织学方法或从植物组织内直接扩增出微生物DNA的方法来证明其内生[1-2]。内生菌分布非常广泛,内生菌与宿主植物在长期的进化过程中形成了互惠共生的关系[3]。基于内生菌种类多样性、代谢途径的丰富性和能够独立合成和促进寄主合成结构新颖、活性多样的化合物等原因,内生菌是生产天然产物的重要来源[4-6]。
石豆兰为兰科石豆兰属(Bulbophyllum)多年生常绿匍匐小草本植物,全草或假鳞茎皆可入药[7],具有祛风除湿,消肿止痛,凉血活血、抗癌等功效[8-9]。由于环境污染问题和过度采挖,石豆兰自然数量日益减少。因此,大力发展人工种植石豆兰,研究其药用成分及生物价值成为石豆兰产业的一门重要课题。石豆兰组织组培和细胞培养过程中发现,石豆兰内生菌丰富,有些菌株能与寄主离体共培养,进一步证明了内生菌在促进兰科植物种子萌发、供应营养物质及促进幼苗生长等方面起重要作用的观点[10-11]。
植物内生菌丰富,蕴含着优异基因,是天然产物的重要来源,故研究火热,并取得重大进展。关于石豆兰内生菌多样性未见报道,本研究以福建南屏的广东石豆兰(BulbophyllumkwangtungenseSchltr.) 为材料进行内生菌分离,研究内生菌及其代谢产物的应用价值,以期获得优良菌株,为进一步丰富和开发内生菌资源提供初步前期研究基础。
1 材料与方法
1.1 材料
石豆兰采自福建南屏鸳鸯猕猴自然保护区,由安徽科技学院从事植物学教学与科研的王玉良副教授鉴定为广东石豆兰。病原菌为致棉花枯萎的尖孢镰刀菌萎蔫专化型(Fusariumoxysporumf.sp. vasinfectum)和致黄瓜枯萎的尖孢镰刀菌萎蔫专化型(Fusariumoxysporumf.sp cucumerinum),由本校农学院段海明博士提供。
分离培养基共7种:NA培养基(牛肉膏3 g、蛋白胨5 g、酵母膏1 g、葡萄糖10 g、琼脂15 g、蒸馏水1 L、pH 7.0~7.2);金氏培养基(蛋白胨20 g、甘油10 g、琼脂15 g、K2HPO41.5 g、MgSO4·7H2O 1.5 g、蒸馏水1 L、pH 7.2);YPD培养基(酵母提取物10 g、蛋白陈20 g、葡萄糖20 g、蒸馏水1 L、pH 7.2);LB培养基(蛋白胨10 g、酵母膏5 g、琼脂15 g、NaCl 10 g、蒸馏水1 L、pH 7.0);大豆酪蛋白琼脂培养基(胰蛋白胨10 g、大豆胨5 g、琼脂15 g、NaCl 5 g、蒸馏水1 L、pH 7.2~7.4);YG培养基(酵母膏3 g、胰蛋白胨5 g、葡萄糖5 g、琼脂15 g、蒸馏水1 L、pH 9.0);R2A培养基(酵母粉0.5 g、胰蛋白胨0.25 g、葡萄糖0.5 g、淀粉0.5 g、丙酮酸钠0.3 g、琼脂15 g、K2HPO40.3 g、MgSO40.024 g、pH 7.0~7.4)。以上培养基均经过121 ℃灭菌15 min,备用。
1.2 方法
1.2.1 内生细菌的分离、纯化与保存 材料经过清洗,称取叶片、假鳞茎、横走茎、根4种器官各1 g,分别用75%的酒精处理30 s,无菌水清洗3次,再用0.1%HgCl2消毒8 min,无菌水洗涤5次。取最后一次洗涤水涂平板,培养3 d,确定外植体表面是否消毒彻底。将表面消毒彻底的材料切碎,按1∶20比例加入无菌水研磨成匀浆。4种研磨原液依次稀释成1×10-1、1×10-2、1×10-3共3个梯度,涡旋混匀,吸取100 μL涂布于7种分离培养基上,每个浓度涂布3个皿,培养4 d。依据颜色、大小、形态等特征统计数量和种类,并挑单菌落,划线纯化保存。
1.2.2 内生细菌的分子鉴定 菌株基因组DNA提取参照苗翠苹的方法[12],采用16S rRNA基因的通用引物进行PCR扩增,引物序列如下:
PA:5’-CAGAGTTTGATCCTGGCT-3’(对应E·coli的7-24位碱基)
PB:5’-AGGAGGTGATCCAGCCGCA-3’(对应E·coli的1 540-1 522位碱基)
PCR扩增体系及扩增程序参照苗翠苹的方法[12],扩增产物送至上海生工进行测序。将测序结果使用EzBioCloud(http://eztaxon-e.ezbiocloud.net)在线比对工具进行序列分析,确定各菌株的有效发表近缘种。从Genbank中调取相似性高的近缘种的16S rRNA基因序列,用Clustal X进行多重序列比对,通过MEGA 7.0软件选用Kimura2-parameter距离模型计算进化距离,采用Neighbor-Joining法构建系统发育树,1 000次随机抽样计算Bootstrap值以评估系统发育树的置信度。
1.2.3 对峙抑菌试验 采用菌落对峙法对分离到的38株细菌进行抑制棉花枯萎病和黄瓜枯萎病原菌初筛试验。直径为9 cm的培养皿,制作PDA平板,在直径线上距皿边缘2.5 cm处分别接内生菌、棉花枯萎病原菌或黄瓜枯萎病原菌,使内生细菌和病原菌形成相距4 cm的对峙状态,于28 ℃培养3 d,观察病原菌生长状况,对照和处理都重复3次。
1.2.4 内生细菌代谢产物抑菌试验 对峙抑菌试验筛选到有抑菌效果的内生菌,从试管斜面刮取一环接种到5 mL液体LB中,30 ℃震荡培养过夜得种子液。按2%接种量接入发酵培养基中,摇瓶装量25 mL/50 mL,30 ℃,180 r/min培养3 d,10 000 r/min离心20 min,取上清依次经过0.45 μm和0.22 μm无菌微孔滤膜过滤得发酵滤液。6 mL发酵滤液与54 mL PDA混合均匀倒3个平板(9 cm)。病原菌经过活化长满平皿后,用直径0.8 cm的打孔器沿边缘一圈打菌饼,将菌饼倒扣在平板中央,以不加发酵液PDA为对照,28 ℃培养4 d,十字交叉法测量菌落直径,平均值为菌落直径。计算抑菌率(%)=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%。
2 试验结果及分析
2.1 内生细菌的分离

表1 不同器官不同培养基上内生菌的株数
试验结果表明,0.1%HgCl2消毒8 min能杀死外植体表面微生物,10-3是分离、容易挑取单菌落的最佳稀释梯度。不同器官不同培养基上分离到的菌株数不同(表1),从四种器官分离到的菌株数由多到少顺序:假鳞茎>横走茎>根>叶;8种分离培养基分离得到菌株数最多的是LB培养基,明显高于其它七种培养基,说明LB培养基适合绝大多数内生细菌的生长,因此,后面的试验采用LB为基础培养基。对分离到的内生细菌在初步形态鉴定的基础上进行分子学鉴定,共39种。根据图1系统进化树可以将39种菌分为两大类群。第一大类群为厚壁菌门(Firmicutes),涉及3科4属,共34种(表2)。有芽孢杆菌科(Bacillaceae)的芽孢杆菌属(Bacillus,30种,76.92%)和赖氨酸芽孢杆菌属(Lysinibacillus,1种,2.56%),类芽孢杆菌科(Paenibacillaceae)的类芽孢杆菌属(Paenibacillus,2种,5.13%),葡萄球菌科(Staphylococcaceae)的葡萄球菌属(Staphylococcus,1种,2.56%);第二大类为γ-变形菌门(γ-Proteobacteria),涉及2科4属5种,有肠杆菌科(Enterobacteriaceae)的肠杆菌属(Enterobacter,2种,5.13%)、勒克菌属(Leclercia,1种,2.56%)、科萨克氏属(Kosakonia,1种,2.56%)和假单孢菌科(Pseudomonadaceae)的假单孢菌属(Pseudomonas,1种,2.56%)。

表2 石豆兰内生细菌与其相似菌株的分析及抑菌活性
注:Ah和Am是分别表示对峙法对黄瓜枯萎病菌和棉花枯萎病菌的抑菌率,Bh和Bm是分别是发酵液法对黄瓜枯萎病菌和棉花枯萎病菌的抑菌率,“-”代表无抑菌活性

图1 石豆兰内生细菌分离株16S rRNA系统进化树
2.2 内生细菌抑菌结果
对峙法抑菌试验结果表明(表2),39株内生细菌中对黄瓜枯萎病原菌具有抑制作用的有16株,对棉花枯萎病原菌具有抑制作用有14株,对两种病原菌都有抑制作用的有10株。将初步筛选出具抑菌功能的阳性菌株,用LB为基础培养基发酵3 d,其无菌滤液经PDA稀释10倍后,接种两种病原菌。结果表明发酵产物对对黄瓜枯萎病原菌具抑制功能的有13株,抑菌率在3.36%~40.38%之间,其中BK15号抑菌率最高,对棉花枯萎病原菌具抑制功能的有13株,抑菌率在5.77%~60.78%之间,BK26号菌抑菌率最高。编号BK1、BK3、BK8、BK15、BK19、BK23、BK31共7株菌对两种病原菌均有抑制功能。

图2 对棉花枯萎病和黄瓜枯萎病菌丝生长抑制效果
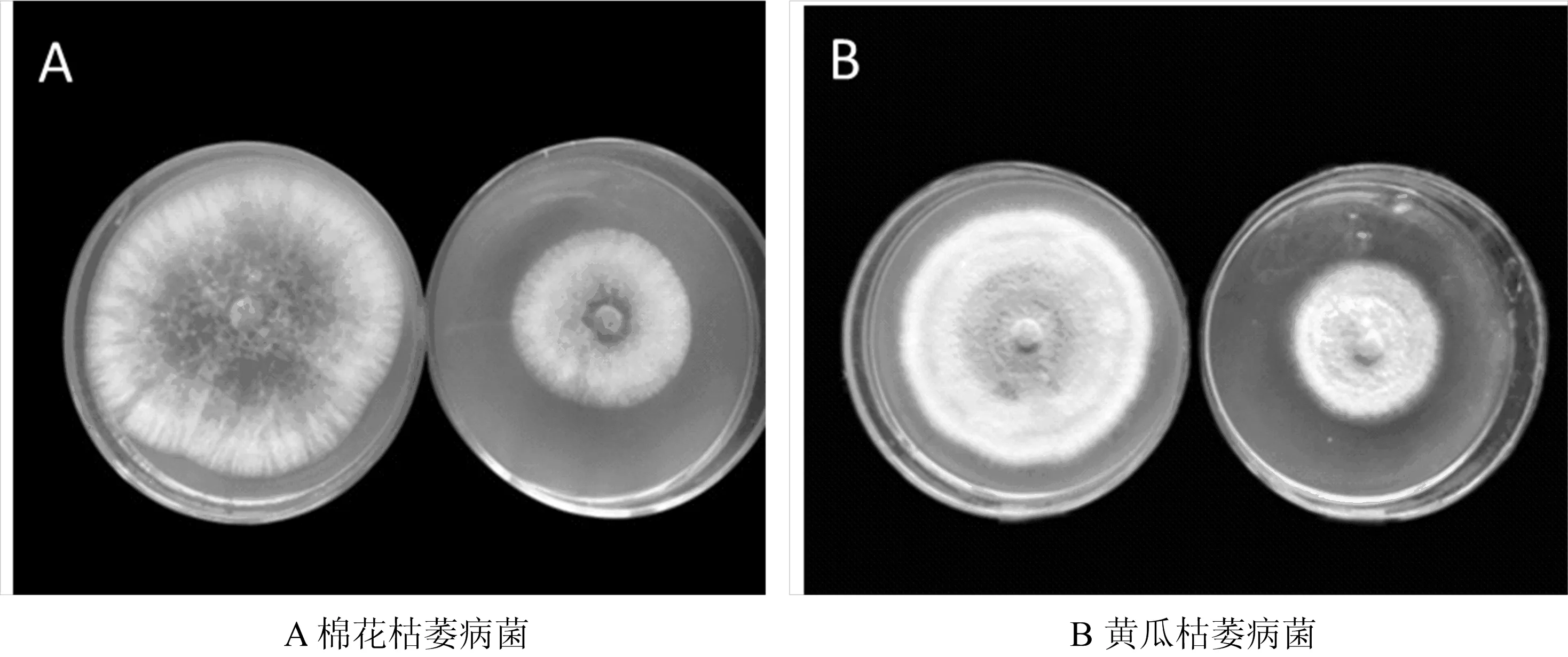
图3 发酵产物对棉花枯萎病和黄瓜枯萎病菌丝生长抑制效果
3 结论与讨论
本研究前期预实验确定广东石豆兰表面消毒方式是用0.1%HgCl2处理8 min,此条件足可以杀死表面微生物。表面消毒方式对确保分离到的菌是否内生至关重要,消毒方式与材料种类、来源、部位等因素有关,不同植物采取的消毒方式不同[13],因此,分离内生菌之前先确定消毒方式,即保证能杀死表面微生物,又不伤害内部菌。本研究选用了四种器官进行内生菌分离,不同器官含细菌的丰富程度不同,假鳞茎内生菌含量最为丰富,在8种培养基上分离到菌最多,横走茎次之,叶最少;可能是因为假鳞茎是石豆兰的药食部位,生长周期长,营养丰富,其内生环境适合细菌生长,而叶片革质,组织成分较为单一,不太适合内生菌的繁殖。而在铁皮石斛中,根部分离到的内生菌数量多于茎和叶部[14]。
基于不同内生菌需要不同的生长环境,设计了8种分离培养基[15-16],四种器官均利用LB培养基分离得到菌株数最多,菌株数明显高于其它七种培养基,说明LB培养基适合广东石豆兰绝大多数内生细菌的生长。本研究结果表明,从广东石豆兰分离到的内生细菌种类并不多,经过16S rRNA比对共有39株内生细菌,可能因为广东石豆兰内生菌材料来源单一,生长条件苛刻,大多数不可培养。39株菌归属厚壁菌门(Firmicutes)和γ-变形菌门(γ-Proteobacteria),植物分离结果与Galdiano等[17]、俞婕等[18]从兰科植物种分离的内生菌结果类似,其中芽孢杆菌属(Bacillus)最多,占76.92%,这与杨娜等从兰科植物中分离得到的内生细菌种群优势的结果较为一致[19]。同时分离出的内生细菌中还有假单胞菌属,这与严亮等[14]对云南铁皮石斛内生细菌的鉴定结果较为一致。对筛选到的内生菌选用对峙法初步筛选出抑制黄瓜枯萎病原菌和棉花枯萎病原菌的菌株,用其发酵液进行复筛,对两种病菌具抑制作用各有13株,占分离菌株的33.33%,其中7株兼有抑制两种病菌的作用,说明广东石豆兰内生菌可作为生防菌用于农作物病害的防治。
综上所述,本研究结果表明,广东石豆兰体内拥有一定丰富度的内生细菌资源,33.33%内生菌对黄瓜枯萎病原菌或棉花枯萎病原菌有抑制作用,17.95%内生菌对两种病菌都具抑制作用。研究结论为广东石豆兰内生菌资源的生物活性物质筛选以及开发利用提供了基础理论依据。

